Свързани термини:
- Потискане на костния мозък
- Инфузия
- Диария
- Хистамин
- Токсичност
- Гадене
- Елиминационен полуживот
- Интравенозно приложение на лекарства
Изтеглете като PDF
За тази страница
Хистаминови рецептори и техните лиганди: механизми и приложения ☆
Н1 агонисти
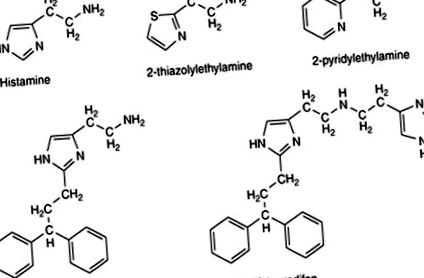
Доскоро бяха налични много малко селективни Н1 агонисти и тези, които имаха ниво на активност много по-ниско от това на неселективния хистамин, което ги прави само за ограничена употреба. Най-широко използваните агонисти са аналозите на 2-тиазолил и 2-пиридил (фиг. 3). Хистаминовите производни, показани на фиг. 1, когато носят в позиция С2 ароматна група с алкиленов линкер (фиг. 3), значително подобряват материята; съединения като хистапродифен и суперхистапродифен станаха важни инструменти за изучаване на ролята на Н1 рецепторите във физиологията и патологията.
Фигура 3. Н1 агонисти, използвани като фармакологични инструменти за изследване.
Конститутивна дейност в рецептори и други протеини, част А
Саския Неймейер,. Хенри Ф. Вишер, в Методи в ензимологията, 2010
2.5.2 Описание на анализа
HeLa клетки, ендогенно експресиращи H1R, се инкубират в продължение на 24 часа с обратния агонист трипеленамин, който показва една от най-бързите дисоциационни кинетики от всички инверсни H1R агонисти. Пълната дисоциация на трипеленамина от предварително обработените клетки е от съществено значение, за да се избегне пряка намеса в свързването на радиолиганда, което води до подценяване на нивата на експресия на H1R. HeLa клетките се събират и хомогенизират в леденостуден свързващ буфер (50 mM Na2/K-фосфатен буфер, рН 7.4). Клетъчните хомогенати се центрофугират за 5 минути при 1400 × g и впоследствие супернатантата за 20 минути при 15 000 × g. Клетъчните мембрани на HeLa/H1R се инкубират за 30 минути при 30 ° С в свързващ буфер, съдържащ 1 пМ [3Н] -мепирамин. Α специфичното свързване се определя в присъствието на 1 μM миансерин. Инкубациите се спират чрез бързо разреждане и последващо филтриране върху 0,3% покрити с полиетиленимин филтри Whatman GF/C с използване на ледено студен буфер за свързване. Свързаният радиолиганд, задържан на филтрите, се измерва чрез течно сцинтилационно броене.
Невро-отология
J.M. Espinosa-Sanchez, J.A. Lopez-Escamez, в Наръчник по клинична неврология, 2016
Бетахистин
Това лекарство се използва широко в световен мащаб, с изключение на САЩ, тъй като не е одобрено от Американската администрация по храните и лекарствата. Бетахистинът е структурен аналог на хистамина, който действа като слаб частичен постсинаптичен хистаминов Н1 рецепторен агонист и пресинаптичен Н3 рецепторен антагонист, без ефект върху постсинаптичните Н2 рецептори (Gbahou et al., 2010). Изглежда, че механизмът на действие на лекарството зависи главно от неговото действие върху Н3 рецепторите, медиирани от два метаболита, аминоетилпиридин и хидроксиетилпиридин (Bertlich et al., 2014).
Експериментални проучвания при животни показват, че бетахистин подобрява микроциркулацията на лабиринта чрез вазодилатация на артериолите на stria vascularis, а също и в задната полукръгла ампула на канала. По този начин, бетахистинът ще намали ендолимфатичното налягане чрез постигане на намаляване на производството и увеличаване на реабсорбцията на ендолимфа (Dziadziola et al., 1999; Laurikainen et al., 2000; Ihler et al., 2012).
Ефектът на бетахистина зависи от дозата и продължителността (Tighilet et al., 2005; Ihler et al., 2012). Стандартната доза е 48–96 mg/ден, въпреки че понякога се използва по-висока доза между 288 и 480 mg/ден (Strupp et al., 2008; Lezius et al., 2011). Неблагоприятните ефекти са редки, леки и самоограничаващи се. Кожната реакция на свръхчувствителност е най-често съобщаваното оплакване. Понякога се съобщава за гадене, повръщане, епигастрална болка и главоболие, особено при по-високи дози (Jeck-Thole and Wagner, 2006; Benecke et al., 2010).
Клиничната ефикасност на бетахистин е оценена в няколко проучвания и има противоречиви доказателства. Прегледът на Cochrane заключава, че няма достатъчно доказателства, за да се каже дали бетахистин оказва влияние върху честотата или продължителността на епизодите на световъртеж (Джеймс и Бъртън, 2001). Впоследствие е извършен мета-анализ, подкрепящ терапевтичната полза от бетахистин както за MD, така и за вестибуларно световъртеж (Nauta, 2014). Бетахистин 144 mg/ден дава подобна скорост на контрол на световъртежа като интратимпаничния дексаметазон (Albu et al., 2015). Неотдавнашно дългосрочно, двойно-сляпо, рандомизирано плацебо-контролирано клинично проучване (проучване BEMED), използващо 48 или 114 mg/ден бетахистин, показа, че бетахистинът няма благоприятен ефект при MD (Adrion et al., 2016) . Допълнителни дългосрочни рандомизирани, плацебо контролирани клинични проучвания с по-високи дози бетахистин са оправдани, за да потвърдят констатациите от проучването BEMED. Клиничните изследвания трябва също да се фокусират върху идентифицирането на биологични маркери или клинични предиктори за отговор на бетахистин при MD.
Основни концепции за съня, наука, лишаване и механизми
Н. Сакай, С. Нишино, в Енциклопедия на съня, 2013
Хистаминергични Н3 антагонисти
Хистаминът отдавна е замесен в контрола на бдителността, тъй като H1 антагонистите са силно успокоителни. Намаляване на нивата на хистамин в цереброспиналната течност се наблюдава и при нарколепсия при хора и други хиперсомнии от централен произход. Въпреки че централно инжектираният хистамин или хистаминергичните Н1 агонисти насърчават събуждането, системното приложение на тези съединения предизвиква различни неприемливи странични ефекти чрез стимулиране на периферни Н1 рецептори. За разлика от тях, хистаминергичните Н3 рецептори се разглеждат като инхибиторни авторецептори и са обогатени в ЦНС. H3 антагонистите подобряват будността при нормални плъхове и котки и при модели на нарколептични мишки. Хистаминергичните H3 антагонисти могат да бъдат полезни като събуждащи събуждането съединения за лечение на EDS или като когнитивни подобрители и се изучават от няколко фармацевтични компании.
Истории на случаите
8.02.3 Да бъдеш професор в Амстердам
Към края на 70-те години Наута трябваше да се пенсионира (поради възрастта си, в съответствие със строгите холандски закони) и аз бях назначен за негов наследник (Фигура 3). Реших да съживя (анти) хистаминовите изследвания на групата. Тъй като не изпитвах нужда от разработване на ново лекарство, избрах да работя върху Н2 агонисти, а не антагонисти. Искрено съм убеден, че учените трябва да използват свободата си за избор на изследователски области; те никога не трябва да имитират това, което правят техните колеги, работещи във фармацевтичната индустрия; те така или иначе биха били в лошо положение. По това време беше предложено, че за активиране на Н2 рецептора, преносът на протони чрез тавтомерните видове на имидазоловото ядро на хистаминовата молекула е от съществено значение. Можем да покажем чрез относително високата активност на H2 агонист на правилно субсидирани тиазолови аналози на хистамин, че това не може да е вярно. Междувременно идентифицирахме високоселективен H2 (срещу H1) агонист амтамин, заместен тиазолов аналог на хистамин, съединение, което стана много използван инструмент за изследване.
Фигура 3. Авторът отдава почит на своя професор W. Th. (Wijbe) Наута по време на лекция в неговата алма матер, Vrije Universiteit Amsterdam.
Това, което се беше случило с H1 антагониста през 50-те години, беше видяно в H2 блокерите през 1980-те. Първите съединения бяха умерено активни (циметидин), но скоро бяха идентифицирани изключително мощни Н2 антагонисти. Отново беше показано, че когато е налице интересна цел, лекарствената химия ще излезе с лиганди. Не след дълго изглежда, че книгата с хистамин може да бъде затворена за втори път; медицинската химия в областта е завършена.
Въпреки това, един въпрос, свързан с клиничния профил на класическите антихистамини (H1 антагонисти) досега не е бил разрешен. Всички съединения причиниха тежка седация, но механизмът, по който тя беше причинена, беше неизвестен. Много изследователи смятат, че ефектът не е свързан с взаимодействие с хистаминергичната система, а по-скоро е причинен от блокада на мускариновия рецептор (по това време само един тип). Общоприето беше, че хистаминът няма функция като невротрансмитер.
Но това мнение се промени, когато Шварц показа чрез елегантни проучвания ex vivo, че има ясна връзка между нивото на заемане на хистаминовите рецептори в централната нервна система (ЦНС) и нивото на седация, причинено от H1 антагонисти. Резултатите от Schwartz доведоха до два важни извода: хистаминът вероятно е невротрансмитер и H1 антагонистите причиняват седация чрез блокиране на H1 рецепторите в мозъка. И двете заключения се оказаха верни скоро след това. 4
Впоследствие H1 блокерите привлякоха ново внимание на фармакохимичната индустрия. Първият неседиран или второ поколение H1 блокер, терфенадин, е открит случайно; той е разработен като средство за блокиране на влизането на Са. Неседиращите свойства на този умерено активен H1 антагонист са резултат от слаб капацитет за навлизане в мозъка; този подход беше изпробван по-рано, но без успех. Но сега е доказано, че принципът е продуктивен; нови неседиращи съединения достигнаха пазара и се превърнаха в блокбъстъри; след терфенадин, например, бяха въведени цетиризин и лоратадин.
Всички производни от ново поколение причиняват само минимална блокада на Н1 рецепторите в ЦНС и в учебниците се посочва, че това е „поради висока хидрофилност.“ Въпреки това, неседиращите съединения показват log P стойности, които според правилото на липофилните характер ще им позволи лесно да преминат през кръвно-мозъчната бариера. Опитахме се да обясним откритието чрез прилагане на теорията на Δlog P: високият Δlog P (log P октанол – вода минус log P цикъл хексан – вода) би означавал висок водород-свързващ капацитет и следователно силно свързване с плазмените протеини и следователно лошо Капацитет на проникване в ЦНС. Можем да обясним откритията само като използваме, освен Δlog P, допълнителни свойства на съединенията. Изглеждаше почти невъзможно да се проектират непроникващи в ЦНС съединения; до голяма степен беше въпрос на шанс. По-късно реалният механизъм стана ясен, когато беше показано, че всички съединения от второ поколение са субстрати на транспортера P-gP. Всъщност новите съединения са резултат от особено добър късмет.
Хистамин
Значение на мозъчния хистамин за действие на наркотици
Много клинично достъпни лекарства, които модифицират цикъла сън-събуждане и апетита действат чрез хистаминергичната система
Лекарствата, които модифицират възприемането на болката, действат отчасти чрез хистаминергичната система
Въпреки че облекчаващите болката опиоидни лекарства като морфин инициират много неврохимични промени, активирането на освобождаването на невронния хистамин от тези агенти и последващото стимулиране на мозъчните Н2 рецептори са критични за механизма на действие на тези съединения (Gogas et al., 1989; Eriksson и др., 2000). Стресовите реакции също могат да допринесат за опиоидна аналгезия, а хистаминергичните неврони изглежда медиират индуцираното от стреса усилване на морфиновата антиноцицепция. Въпреки че не са разработени лекарства за облекчаване на болката, базирани на Н2 рецептори, е открито семейство нови аналгетици от лекарства, свързани с циметидин (Н2 антагонист) и буримамид (лекарство с Н2 и Н3 свойства). Досега тези импоган-подобни лекарства се използват само като изследователски инструменти. Извън мозъка, H1 рецепторите на сензорните нервни влакна се активират по време на някои видове болка и възпаление, а H1 антагонистите се използват за техните противовъзпалителни и аналгетични профили (Raffa, 2001). Чрез противоположен механизъм, H3 агонистите намаляват предаването на болката, предизвикана от химични и механични стимули (Hough & Rice, 2011).
Н3 рецепторът е привлекателна цел за лечение на няколко заболявания на ЦНС
Н3 рецепторът е не само авторецептор, но също така контролира освобождаването на други невротрансмитери, включително 5-НТ, ацетилхолин, допамин и норадреналин (Фиг. 16-7; Haas et al., 2008). Тези характеристики го правят много привлекателна терапевтична цел за разстройства на ЦНС, тъй като агентите с множество и допълващи се начини на действие са по-склонни да показват широко базирана ефикасност срещу основните и съпътстващите симптоми. Няколко H3 рецепторни антагонисти са в клинични изпитвания за лечение на нарколепсия, когнитивни нарушения, свързани с болестта на Алцхаймер, болестта на Паркинсон, шизофрения и разстройство с хиперактивност с дефицит на вниманието (ADHD) (Benarroch, 2010). Поразително свойство на Н3 рецепторите е тяхната висока степен на конститутивна активност in vivo (Morisset et al., 2000). Това откритие е важно за разработването на лекарства, тъй като способността да се конкурират с конститутивно активни H3 рецепторни състояния (обратен агонизъм) има важни терапевтични последствия.
Н3 антагонистите са ефективни при лечението на нарушения на съня (Lin et al., 2011). Понастоящем първичната нарколепсия, разстройство, характеризиращо се с прекомерна сънливост през деня, катаплексия и нарколептични епизоди, както и сънливост по различни причини, понастоящем се лекува главно чрез стимулиращи събуждането съединения като модафинил или психостимуланти, като амфетамин, които действат чрез допаминергичната система. Въпреки мощните си възбуждащи ефекти, тези съединения вероятно не активират хистаминергични механизми, тъй като техните ефекти се запазват при HDC-KO мишки. Понастоящем мозъчният H3 рецептор е най-обещаващата цел за лечение на хиперсомния, тъй като неговата блокада увеличава освобождаването на хистамин, което стимулира постсинаптичните H1 рецептори. В действителност, H3 антагонистите показват забележителен ефект, стимулиращ събуждането при експериментални животни и клиничните проучвания потвърждават валидността на този клас лекарства за лечение на сънливост и дефицит на бдителност с различен патологичен произход (Lin et al., 2008). Всички тези съединения показват по-добър фармакологичен профил от другите психостимуланти, тъй като за разлика от амфетамините, кофеина или модафинила, те не предизвикват възвратни ефекти или поведенческо възбуждане.
Лекарствата, които действат върху хистаминергичната система, също са обещаващи кандидати за лечение на затлъстяване, епилепсия и невродегенеративни нарушения. Антагонистите на Н1 рецептора увеличават консумацията на храна и телесното тегло, докато активирането на Н1 рецепторите потиска приема на храна, а увеличаването на наличността на мозъчен хистамин под антагонистите на Н3 рецепторите предизвиква загуба на тегло (Passani et al., 2011). Въпреки че антагонистите на Н3-рецепторите не предизвикват значителна промяна в теглото при пациенти, включени в клинични изпитвания, целящи тестване на тяхната ефикасност при нарколепсия или ADHD, тези съединения може да се окажат ефективни при лечението на специфични хранителни разстройства. Предклиничните данни предполагат, че Н3 антагонистите могат да бъдат полезни за лечение на алкохолизъм (Nuutinen et al., 2010), както и за епилепсия (Benarroch, 2010). Хистаминът също участва в патологията на множествената склероза и нейния миши модел, експериментален автоимунен енцефаломиелит и в момента се разглежда ролята му в невропротекцията.
Сънливост през деня и нарколепсия
- Чернодробна поликистозна болест - общ преглед на ScienceDirect теми
- Нискомаслено мляко - преглед на ScienceDirect теми
- Чревна дисмотилитет - общ преглед на ScienceDirect теми
- Кефир - общ преглед на ScienceDirect теми
- Твърди изпражнения - преглед на ScienceDirect теми