Е. А. Трифонова
Изследователски институт по медицинска генетика, Сибирски клон, Руска академия за медицински науки, Nab. Ushayky 10, 634050, Томск, Русия
Томски държавен университет, Ленина авеню, 36, 634050, Томск, Русия
Т. В. Габидулина
Сибирски държавен медицински университет, Министерство на здравеопазването на Руската федерация, Московски тракт, 2, 634050, Томск, Русия
Н. И. Ершов
Институт по цитология и генетика, Сибирски клон, Руска академия на науките, просп. Лаврентиева 10, 630090, Новосибирск, Русия
В. Н. Сереброва
Изследователски институт по медицинска генетика, Сибирски клон, Руска академия за медицински науки, Nab. Ushayky 10, 634050, Томск, Русия
А. Ю. Ворожищева
Градска клинична болница № 1, Ул. Хитарова, 32, 654000, Новокузнецк, Русия
В. А. Степанов
Изследователски институт по медицинска генетика, Сибирски клон, Руска академия за медицински науки, Nab. Ushayky 10, 634050, Томск, Русия
Томски държавен университет, Ленина авеню, 36, 634050, Томск, Русия
Резюме
ВЪВЕДЕНИЕ
Проведените досега многобройни проучвания за асоцииране в целия геном (GWAS) предоставиха ценна информация за генетичната архитектура на многофакторни заболявания (MFD) и разкриха стотици алели на риска от еднонуклеотидни полиморфизми (SNP), свързани с много фенотипове. Те обаче обясняват само относително малка част от наследяването на сложни признаци и имат само много леко въздействие върху фенотипа на асоциираните варианти [1]. Тези резултати повдигат липсващия проблем с наследствеността, който се обсъжда интензивно днес. Друго ограничение на ефективността на GWAS, свързано с проучвания на наследствения компонент на предразположение към MFD, е свързано с използването на tagSNP. Рисковите алели, идентифицирани в GWAS, обикновено не принадлежат към „причинно-следствените“, но са в неравновесие на връзката (LD) с функционално значими варианти на алели [2]; следователно биологичното тълкуване на резултатите от GWAS е сериозен проблем.
Съвременните подходи за идентифициране на „причинно-следствените“ алелни варианти, свързани с полиморфизмите, открити в GWAS, се основават на анализа на кодиращите или транскрибирани геномни области [2-4]. По-голямата част от SNP, идентифицирани в GWAS, се намират в нетранскрибираните региони. Те не са свързани с варианти, разположени в екзони, и механизмът на тяхното действие очевидно е свързан с регулирането на генната експресия [5, 6]. Следователно постгеномните методи (които лесно предоставят информация за почти всички компоненти, координиращи основните функции на гените, RN A и протеините на различни йерархични нива) стават особено актуални при изучаването на генетичната архитектура и молекулярните механизми на MFD. Един такъв подход, а именно високоефективното измерване на генната експресия с помощта на технологията на микрочиповете, беше използван в настоящата работа за характеризиране на моделите на транскриптома при нормална бременност и прееклампсия (РЕ), едно от най-тежките гестационни усложнения.
Прееклампсията, която е свързана със синдрома на полиорганна дисфункция, е специфичен синдром, който се появява след 20-та седмица от бременността и се характеризира с хипертония и протеинурия. PE се диагностицира при 70% от хипертоничните разстройства по време на бременност и през последните години се наблюдава увеличаване на честотата на тежки и комбинирани форми на това заболяване [7]. Въпреки големия брой теории, свързани с етиопатогенезата (неврогенни, хормонални, плацентарни, имунологични, генетични и др.), Многобройни изследвания на механизмите на развитие на това заболяване и появата на нови терапии, PE остава водеща причина за майчините и перинатална заболеваемост и смъртност. Заболяването е отговорно за до 70% от мъртвородените и спонтанните аборти; рискът от перинатални загуби се увеличава почти пет пъти при PE [7, 8].
Според съвременните концепции етиопатогенезата на прееклампсията е тясно свързана с неадекватна цитотрофобластна инвазия в маточните спирални артерии и развитие на синдром на исхемия-реперфузия, който предизвиква оксидативен стрес и системно възпаление [9, 10]. Етиологичните фактори и механизмите на това разстройство остават неясни и изискват голямо внимание. За да се идентифицират потенциалните биомаркери на ПЕ и да се изследват молекулярните механизми на гестационни усложнения, ние анализирахме моделите на плацентарния транскриптом, които са специфични за ПЕ и физиологичната бременност, тъй като плацентарната тъкан очевидно играе ключова роля в развитието на PE. Стратегията за използване на микрочипове в този контекст изглежда разумна и достатъчно мощна, тъй като позволява на човек да проучи задълбочено възможните промени в генната експресия, свързани с патофизиологията на прееклампсията на ниво транскриптом.
ЕКСПЕРИМЕНТАЛЕН
Характеристика на изследваните групи
Обследвани са общо 10 пациенти с ПЕ и 11 пациенти с физиологична бременност (контролната група) (Таблица 1). Въпросникът включваше демографска информация (етническа принадлежност) и антропометрични параметри (височина, тегло), начин на живот (навик на тютюнопушене, злоупотреба с психоактивни вещества), както и информация за соматичната и акушерско-гинекологичната история. PE е диагностициран въз основа на водещи клинични симптоми с различна тежест, като протеинурия, оток, хипертония (систолично кръвно налягане над 140 mm Hg, диастолично кръвно налягане над 90 mm Hg) съгласно 10-тата ревизия на Международната класификация на болестите. Тежестта на PE е оценена съгласно критериите на клиничния протокол 2012 „Хипертония по време на бременност. Прееклампсия. Еклампсия ”[11].
маса 1
Характеристика на изследваните групи
| Средна възраст, години | 26 ± 2 | 28 ± 3 | 0,241 |
| Средно тегло, кг | 60 ± 7 | 62 ± 6 | 0,324 |
| Индекс на телесна маса, ИТМ | 23 ± 4 | 23 ± 3 | 0.832 |
| Средното максимално систолично кръвно налягане, mm Hg | 162 ± 19 | 121 ± 3 | 0,0001 |
| Средното максимално диастолично кръвно налягане, mm Hg | 104 ± 13 | 80 ± 4 | 0,0001 |
| Срок за доставка, седмици | 38 ± 1 | 40 ± 2 | 0,009 |
| Тегло при раждане, g | 2783 ± 560 | 3549 ± 345 | 0,004 |
| Дължина при раждане, см | 50 ± 4 | 53 ± 2 | 0,021 |
| Преждевременно раждане,% | 50 | 0 | 0,012 |
| Хронични болести, % | 60 | 50 | 0,575 |
* Нивото на значимост е определено чрез сравняване на групите с помощта на теста на Ман-Уитни или точния тест на Фишър.
Групата на пациентите с ПЕ е хетерогенна както по отношение на тежестта (проучването включва шест пациенти с умерена и четири пациенти с тежка ПЕ) и наличието на предходни заболявания и съпътстващи заболявания. Четирима пациенти са диагностицирани с PE при липса на фонови заболявания; при други гестационните усложнения се развиват на фона на екстрагенитални заболявания, включително невроциркулаторна дистония от хипо-/хипертоничен тип, хроничен пиелонефрит, хроничен холецистит и хронична артериална хипертония. Шест жени от контролната група също са диагностицирани както с хроничен пиелонефрит, така и с хроничен холецистит. Възрастта на гравидите варира от 18 до 33 години и в двете групи; групите бяха сравними по отношение на средната възраст. Установени са статистически значими разлики във височината и теглото на бебетата между контролната група и групата пациенти. Групите се различават и по отношение на артериалното кръвно налягане и времето на раждане.
Събиране на плацентарни проби
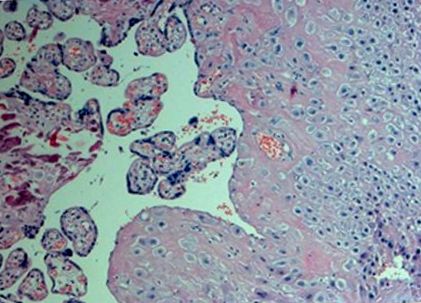
Изследвахме дисталната (майчина) част на плацентата. Тъканите се вземат проби веднага след раждането (времето на исхемия на пробата не надвишава 10 минути). Проби от плацентарна тъкан са взети от централните зони близо до пъпната връв на дълбочина на плацентата 0,5 cm. Пробите бяха събрани от макроскопски нормални участъци на плацентата (без кръвоизлив, калцификация, некроза или отлагане на фибрин), без да се намесват големи съдове, измити с физиологичен разтвор за отстраняване на остатъчната майчина кръв и околоплодната течност, незабавно потопени в RN Alater (Ambion, UK ) и се прехвърля, за да се съхранява при –80 ° C до процедурата за изолация RN A. Хистологично изследване разкрива хорионни власинки и децидуална тъкан с огнища на фибриноидна некроза и малки калцификации във всички биопсични проби (фиг. 1).
Микрография на една от изследваните проби от биопсия на плацентата. Оцветени с хематоксилин и еозин.
Изолация на РНК
Проби от тъкани (100–200 mg) се хомогенизират с помощта на TissueLyser (Qiagen) в Trizol; След това RN A се изолира, използвайки стандартния протокол. Концентрацията на общия RN A се определя с помощта на Nanodrop ND-1000 на базата на абсорбция при 260 nm във вода. Качеството на пробите се наблюдава с помощта на система за капилярна електрофореза Agilent 2100 Bioanalyzer (Agilent Technologies Inc., Пало Алто, САЩ) и спектрофотометрично сканиране.
Анализ на микрочипове
Широкогеномният профил на генна експресия в плацентарната тъкан се определя с помощта на хибридизация върху микрочипове HT-12 BeadChip (Illumina, САЩ), съдържащи информация за повече от 48 000 транскрипта. След хибридизация микрочиповете бяха сканирани на устройство за четене Illumina BeadArray. Необработените данни бяха преобразувани в средни стойности на интензитета на сигнала за всяка проба (Sample Probe Profile) с помощта на софтуерния пакет BeadStudio v3 (Illumina).
Биоинформатичен анализ
Данните бяха анализирани в R софтуерна среда с помощта на програмния пакет limma [12]. За целия набор от данни беше извършена непараметрична корекция на фона, последвана от квантилно нормализиране (neqc функция). Образците, които са идентифицирани във всички проби от поне една от експерименталните групи (р-стойност на откриване Фигура 2 показва топлинната карта с резултатите от йерархично групиране на женски според нивото на експресия от 63 DEG. Може да се види че всички пациенти с ПЕ, освен един, попадат в един клъстер, докато жените с физиологична бременност попадат в другия.Една проба от ПЕ е причислена към контролната група вероятно поради значителната интериндивидуална вариабилност на нивата на транскрипция на плацентарните тъканни гени. явление се наблюдава в няколко човешки клетъчни линии: по-специално в клетъчните линии на хепатоцитния транскриптом [22, 23].
* Информация от базата данни GeneCards (http://www.genecards.org/), включително допълнение.
Анализирахме DEG, използвайки онлайн ресурса DAVID, за да изследваме биологичните процеси, свързани с развитието на PE (фиг. 3). Основните категории молекулярни функции на протеиновите продукти на тези гени включват реагиране на различни стимули, имунни процеси, регулиране на клетъчната комуникация, вътреклетъчни сигнални каскади и др. Анализът на метаболитните пътища, включително DEG, показва, че цитотоксичните пътища, свързани с NK-клетките, трансендотелната миграция на левкоцити и сигналните пътища, медиирани от GTPase активатори, вероятно участват в молекулярните механизми на PE.
Основни биологични процеси, включващи DEG, които са свързани с прееклампсия (p Фиг. 4). Асоциациите в изградената мрежа се основават главно на „извличане на текст“ (споменато в резюмето на една статия). Трябва да се спомене клъстерът за коекспресия, който включва гените RAC2, CYBA, TYROBP, HMHA1, ITGB2, LYN и LCP1. В допълнение, LEP и неговият рецептор SIGLEC 6 и ефрин с неговата киназа LYN представляват определен интерес.
Протеин-протеинови взаимодействия между DEG продукти. Протеините са показани като кръгове; цветната линия между тези кръгове показва категорията на доказателство за взаимодействие между протеин и протеин: жълто - данни от литературата („извличане на текст“), черно - според анализа на генната коекспресия, лилаво - експерименталните резултати, синьо - доказателства от базите данни, розово - кумулативни доказателства
Нашето проучване разкри също така особености на диференциалната генна експресия в зависимост от тежестта на PE (Таблица 3). Бяха идентифицирани общо осем DEG (FDR фиг. 5). Трябва да се отбележи, че заедно с малко количество общи гени (21 гена), които са диференцирано изразени както при тежка, така и при умерена PE, повече от 60 DEG са специфични само за тежката форма на патологията. Резултатите от функционална анотация на тези гени в уеб ресурса DAVID сочат към редица биологични процеси, които са статистически значимо свързани с развитието на тежка PE, като обработка и представяне на пептидни или полизахаридни антигени и сгъване на протеини (Таблица 4 ). Анализът на метаболитните пътища, които включват тези гени, също демонстрира важната роля на механизмите за обработка и представяне на антигени в молекулярната патогенеза на тежка РЕ (според базите данни KEGG и BIOCART A).
Диаграма на Venn, показваща резултатите от профилирането на генната експресия при умерена и тежка прееклампсия и при физиологична бременност. DEGs - гени, които се изразяват по различен начин при жени с прееклампсия и физиологична бременност (контролна група). Стрелката показва увеличаването (↑) или намаляването (↓) на генната експресия.
Таблица 4
Основни биологични процеси, които включват диференциално експресирани гени, характерни за тежката прееклампсия
| Обработка и представяне на пептиди или полизахаридни антигени чрез молекули клас MHC клас II (GO: 0002504) | HLA-DPA1, CD74, HLA-DMA, HLA-DRA | 0,0421 |
| Обработка и представяне на екзогенни пептидни антигени (GO: 0002478) | HLA-DMA, CD74, HLA-DRA | 0,0453 |
| Чаперон-медиирано сгъване на протеини (GO: 0051085) | ERO1L, HLA-DMA, CD74 | 0,0467 |
| De novo пост-транслационно сгъване на протеини (GO: 0051084) | ERO1L, HLA-DMA, CD74 | 0,0478 |
| Реакции на разгънати протеинови молекули (GO: 0006986) | ERO1L, HSPH1, HSPA1A, HERPUD1 | 0,0489 |
* Ниво на значимост, включително корекция на многократно тестване на Бенджамин-Хохберг, която характеризира точността на разпределението на този набор от гени към определен биологичен процес.
ДИСКУСИЯ
Не открихме връзка между развитието на PE и такива канонични пътища като анормална апоптоза и ангиогенеза, както е описано в няколко статии [16, 19, 30, 31]. Това вероятно се дължи на междуетническата изменчивост на профилите на генната експресия в плацентарната тъкан поради диференциацията на популацията на регулаторните региони на генома или поради различните критерии (размер на популацията, време на раждане, тежест на заболяването и т.н. ) използвани при формирането на изследваните групи. Различната плацентарна локализация на биопсичните проби, използвани в отделни изследвания на транскриптома при РЕ, е друг фактор, който очевидно влияе върху появата на тези противоречия. По този начин, високопроизводителното секвениране (RN A-Seq) разкри значителни разлики в профилите на генната експресия в амниона, хориона и децидуята на човешката плацента [32]. Подобни констатации бяха получени преди това при извършване на анализ на микрочипове на моделите на транскриптома в различни части на плацентата [33].
Въпреки гореспоменатите разлики в резултатите от функционалната анотация на DEG, остава интерес, че промените в нивата на експресия на някои DEG, идентифицирани в нашата работа, са описани и в други проучвания (Таблица 5).
Таблица 5
Диференциално експресирани гени, идентифицирани в това проучване, чиято връзка с прееклампсия е доказана по-рано в проучвания, фокусирани върху транскриптома на плацентарната тъкан
- Макрофагите на мастните тъкани (ATM) на пациенти със затлъстяване освобождават повишени нива на пролактин
- Анализ на мазнини за изгаряне на тяло Машина за отслабване Магистър - Китай Оборудване за салони за красота, лазер
- Състав на тялото - Анализ на телесните мазнини
- Прогноза за растеж на пазара за токсикологични тестове на ADME от 2020 до 2026 г. Фокус в световен мащаб за анализ на индустрията
- Анализ на телесния състав - Уелнес на Централна Флорида