Юри Казакевич
1 Babraham Institute, Cambridge, CB22 3AT UK
Елена Стоянова
1 Babraham Institute, Cambridge, CB22 3AT UK
Анке Либерт
1 Babraham Institute, Cambridge, CB22 3AT UK
3 Настоящ адрес: Институт Франсис Крик, Лондон, NW1 1AT Великобритания
Патрик Варга-Вайс
1 Babraham Institute, Cambridge, CB22 3AT UK
2 Геномика и компютърна биология, Училище за биологични науки, Университет в Есекс, Колчестър, Великобритания
Свързани данни
Наборите от данни, генерирани в това проучване, са достъпни в хранилището на GEO с номер за присъединяване> GSE122441.
Резюме
Чревният епител се подлага на постоянна регенерация, задвижвана от чревни стволови клетки. Как възрастта влияе на транскриптома в тази силно динамична тъкан е важен, но слабо проучен въпрос. Използвайки транскриптомика на сортирани чревни стволови клетки и възрастни ентероцити, ние идентифицирахме кандидат-гени, които променят експресията при стареене. По-нататъшното валидиране на тях върху чревния епител на множество мишки на средна възраст спрямо възрастни хора подчертава последователното регулиране на експресията на гена, кодиращ хемокиновия рецептор Ccr2, медиатор на възпалението и няколко болестни процеса. Наблюдавахме също така повишена експресия на Strc, кодираща за стереоцилин, и драстично намалена експресия на Rps4l, кодираща за субединица на рибозома. Ccr2 и Rps4l са разположени близо до теломерните области на хромозома 9 и 6, съответно. Тъй като само няколко гена бяха диференцирано експресирани и не наблюдавахме значителни промени в нивото на протеин на идентифицираните маркери за стареене, нашият анализ подчертава цялостната устойчивост на експресията на гена на чревен епител на мишки до старост.
Въведение
Въпреки факта, че чревният тракт е от решаващо значение за живота и здравето, има ограничени знания за това как се поддържа здравето на червата през целия живот. Много свързани с възрастта чревни разстройства, като колоректален рак, дивертикуларна болест и възпалително заболяване на червата (IBD) са станали често срещани в развитите страни с промени в начина на живот, особено в храненето, потенциално в основата на тези патологии. Стареенето засяга чревната функция и здравето 1. Възрастта също е силен рисков фактор за рак на дебелото черво, една от най-често срещаните форми на рак. Стомашно-чревните състояния са едни от най-честите причини за заболеваемост и хоспитализация на възрастните хора в Европа и все още се увеличават 2 .
Интересното е, че при различни моделни организми, като Caenorhabditis elegans и Drosophila, червата е най-важният орган при определяне на продължителността на живота и здравето 3, 4. При хората стареенето е свързано с повишена чревна пропускливост и вродени имунни реакции 5, 6 .
Стареенето, дори „здравословното“ стареене е свързано с промени в генната експресия, включително в червата 5-7. Проучване, което сравнява чревни стволови клетки (ISC) от млади (2–4 месеца) и стари (18–22 месеца) мишки, показва, че стареенето е свързано с увеличаване на броя на ISC, пролиферация и увеличаване на ISC апоптоза 8. Въпреки това, малко се знае за това как и до каква степен стареенето влияе върху генната експресия в чревните стволови клетки, които задвижват постоянната и съществена регенерация на чревния епител. Нашите собствени и други работи, включително транскриптомичен анализ на едноклетъчни клетки, предполагат промени в генната експресия в соматични стволови и прекурсорни клетки на хемопоетичната система при стареене 9, 10 По този начин е вероятно това да се случи и в чревните стволови клетки на бозайници и техните производни клетъчни типове. Следователно е важно да се разберат ефектите от стареенето върху експресията и функцията на гена на чревните клетки. Тук извършихме скрипт, базиран на транскриптом, за да идентифицираме гени, които показват промени в експресията в напреднала възраст в клетки от миши чревен епител. Идентифицирахме регулирането на Ccr2 и Strc и понижаването на Rps4l като отличителен белег за остарелите чревни клетки на фона на цялостна стабилна програма за генна експресия.
Резултати
RNAseq идентифицира кандидат-регулирани възрастови гени в чревни епителни клетки
Използвахме Lgr5-EGFP-IRES-CreERT2 мишки, за да изолираме Lgr5 + чревни стволови клетки (ISC) 11, 12 и възрастни ентероцити (AE). Високите клетки на Lgr5-EGFP и AE са изолирани от по-млади (
33 седмици) и стари мишки (
118 седмици) чрез активирано от флуоресценция сортиране на клетки, използвайки публикувани процедури 12, 13 (Фиг. S1). Изборът на мишки на средна възраст за по-младата кохорта позволява изследването на процеса на стареене, незакрит от промени, настъпили по време на ранното развитие на зрялата възраст. Поли (А) + РНК се изолира от двете клетъчни популации и генната експресия се анализира чрез РНК секвениране (RNAseq). Това показа, че сортираният ISC изразява известни маркери на стволови клетки, като Olfm4 и Lgr5 12, валидирайки схемата за пречистване на клетките (Фигури S2 и S3B). По подобен начин AE експресира известни диференцирани ентероцитни маркери Vil1, Apoc3 и Sis 13, 14. Експресионният модел на пролиферация (напр. Myc) и маркери от клетъчен тип (напр. Lgr5, Vil1) не се променят с остаряването, което показва тяхната стабилна експресия (Фигури S2 и S3B).
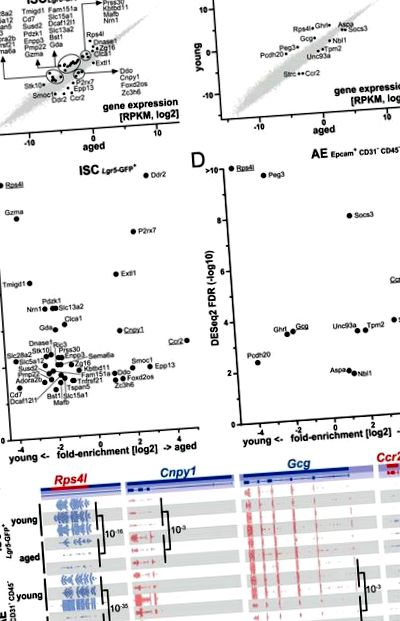
Идентифицирахме 10 значително регулирани възрастта гени и 29 гена, регулирани възрастово в стволовите клетки, както и 7 гена, регулирани възрастта и 5 гена, регулирани възрастта при възрастни ентероцити (фиг. 1). Анализът на генната онтология (GO) на комбинирания 49 генен списък идентифицира, наред с други, следните термини: възпалителен отговор (P = 0,026), активиране на миелоидни клетки, участващо в имунен отговор (P = 0,018), отрицателна регулация на отговора на външен стимул (P = 0,031) и присъщ компонент на плазмената мембрана (P = 0,0004) (за анализ и подробности за резултатите вижте Допълнителна таблица 1, фиг. S4). Забележително е, че Ccr2, най-силно регулираният нагоре диференциално експресиран ген (DEG) при възрастни мишки, е намерен както в ISC, така и в AE клетки, както и най-регулираният DEG, Rps4l (фиг. 1).
Експресията на гени се променя при стареене в тънкочревните стволови клетки (ISC) и възрастните ентероцити (AE). (A,Б.) Scatterplots показват диференцирано регулирани гени в ISC (A) и AE (Б.) и предоставят информация относно относителните им нива на експресия като количествено определяне на RPKM в мащаб 2 Показани са всички гени и значително регулирани нагоре/надолу гени (тест DESeq2 с отсечена FDR S3A .
Повишената експресия на Ccr2 и Strc и намалената експресия на Rps4l иРНК са маркери на остарели чревни епителни клетки
Тъй като стареенето е хетерогенен процес, като дори изогенни индивиди се поддават на свързани с възрастта промени с различна скорост, ние потвърдихме кандидат-гените от данните RNAseq чрез обратна транскрипция, последвана от количествена полимеразна верижна реакция (RT-qPCR), използвайки клетки, извлечени от отделни мишки на по-голяма допълнителна кохорта на възраст (
109 седмици) и млади мишки (
37 седмици). За валидиране на нашите RNAseq резултати изолирахме крипти, тъй като те съдържат предимно ISC и клетки, получени директно от ISC: усилващи транзит клетки (TA) и клетки на Paneth. По-разпространените ТА клетки се появяват от ISC в началото на чревната диференциация с експресионен модел, подобен на ISC. Следователно не очаквахме съществени ефекти върху наблюдаваните възрастови промени в генната експресия. AE бяха изолирани от вили, както беше направено за RNAseq.
Тъй като Ccr2 участва в набирането на моноцити и неутрофили 15, 16, ние оцветяваме секциите на епител на тънките черва с антитяло срещу миелопероксидаза, което открива неутрофили и моноцити, за да следим дали има промяна в набирането на тези клетки във възраст в сравнение с по-младата тъкан. Открихме, че броят на MPO положителните клетки пада в остарялата тъкан (фиг. 3 и допълнителна фиг. S6).
Неутрофили и моноцити в тънкочревния епител по време на стареенето. (A,Б.) Локализация на чревния епител на миелопероксидаза (MPO) -положителни клетки (зелено) чрез оцветяване с имунофлуоресценция и ядрено оцветяване с DAPI (синьо), показано като проекции с максимален интензитет на младите (A) и на възраст (Б.) тънкочревен епител (SI). Скала: 40 µm. Увеличено увеличение на отделенията за крипти в (A,Б.), както и отрицателните контроли за оцветяване са показани на фиг. S6. (° С) Количествено определяне на F4/80-положителни клетки на изобразена крипта/вилусна област на млади и възрастни SI. Посочени P-стойности, определени чрез двупосочен ANOVA с тест за множество сравнения на Holm-Sidak (n = 4-5). Данните за количествено определяне и пълните статистически резултати са показани в допълнителна таблица 4. Примери за точкуване са показани на фиг. S6A, C .
Дискусия
RNAseq, последван от RT-qPCR анализ на идентифицираните гени-кандидати, показва, че само шепа гени са последователно диференцирано експресирани в чревните епителни клетки между млади и възрастни животни. Това може да отразява силно здравата машина за генна експресия в тази динамична тъкан. Той също така подчертава отличното здравословно състояние на колонията на остарелите мишки в Института Бабрахам, тъй като имаме малко доказателства за повишено регулиране на маркерите, свързани с възпалението, с изключението на Ccr2 и P2rx7.
Други гени, които показват тенденция на промени в експресията при стареене в клетките от фракцията на тънкочревната крипта, са забележителни. Ddr2 кодира трансмембранния рецептор за колаген с активност на тирозин киназа и е замесен в различни болестни процеси, като атеросклероза и рак 33. Ddo кодира D-аспартат оксидаза, чийто промотор е показал, че губи ДНК метилиране при стареене при хора в няколко проучвания 34 - 36. Pcdh20 кодира протокадхерин, хомофилен клетъчно-адхезивен протеин и се предполага, че функционира като тумор-супресорен ген 37, 38. Ролята на PCDH20 в чревния епител е слабо разбрана. P2rx7 кодира за пуринергичен рецептор, медиатор на възпаление и възпалителна болка чрез регулиране на обработката и освобождаването на IL-1β, включително в червата 39 .
Нашето проучване показва значителни разлики от предишни проучвания. Moorfield et al. 8 изследваха промените в експресията сред 96 кандидат-гена между млади и стари ISC и възрастни ентероцити от мишки с количествена RT-PCR и идентифицираха няколко промени, които не сме направили. Отбелязваме значителни разлики в нашите подходи, по-специално Moorfield et al. сравнени по-млади (2–4 месеца) срещу по-възрастни (18–22 месеца) мишки, докато ние сравнихме мишки на средна възраст (
8 месеца) спрямо стари мишки (
27 месеца), следователно се изследват процеси, специфични за късното стареене.
В проучване при хора, свързаните с възрастта промени в чревната пропускливост са свързани с повишаване на регулацията на експресията на клаудин-2 иРНК, макар че няма промени в разпределението на белтъците клаудин-2 5. Не наблюдавахме промени в експресията на клаудин ген в нашите анализи. Тъй като мишките и хората имат различен период на живот, хранене, микробиоми и геномни структури, ефектът от стареенето върху генната експресия на чревния епител на човека се нуждае от допълнително проучване.
В обобщение, нашите данни подчертават стабилността на програмата за генна експресия с малко транскрипционни промени и доказателства за строг пост-транскрипционен контрол в стареенето на червата. Въпреки че епителният транскриптом е много устойчив на стареене, свързани с възрастта промени настъпват в цялостната храносмилателна система, както беше показано по-рано за микробиомния състав 29, 40 - 43 и компонентите на имунната система (прегледано в 44, това проучване).
Методи
За всички експерименти бяха използвани мъжки мишки с фон C57BL/6. Колонията със здрава възраст на мъжки мишки C57BL/6 е създадена при условия без специфичен патоген (SPF) и се поддържа в съответствие с местните правила и правилата на вътрешния офис и насоките ARRIVE. Всички мишки бяха хранени ad lib. Животните за RNAseq са били на възраст средно 118 седмици във възрастната кохорта (115,119 и 122) и 33 седмици в младата кохорта (31,33 и 35). За RT-qPCR старата кохорта е средно на 109 седмици (105–118, 11 мишки), а младата кохорта на 37 седмици (25–43, 10 мишки). Мишките в кохортите на RNAseq бяха Lgr5-GFP положителни, за да улеснят ISC-изолацията (мишки Lgr5-EGFP-IRES-creERT2, получени от лабораторията Jackson). Експерименталните протоколи бяха одобрени от местната комисия за етичен преглед на Babraham Research Campus и Министерството на вътрешните работи (PPL 70/8994 и 80/2529).
Екстракция на клетки от тънки чревни крипти и вили
Мишките бяха убити при излагане на CO2, последвано от цервикална дислокация. Тънките черва се екстрахират, отварят се надлъжно и се промиват с фосфатно буфериран физиологичен разтвор (PBS), последвано от изолиране на фракции на крипта и вилус при стайна температура, както е описано 13. За получаване на едноклетъчни суспензии от чревни крипти използвахме Dispase II (Sigma D4693, 0,05 mg/ml крайна концентрация), заедно с DNase (Qiagen 79254, 20 Kunitz U/ml крайна концентрация) и колагеназа (Sigma C7657, 0,15 mg/ml крайна концентрация).
Изолиране на РНК от AE, ISC и цял криптен епител
Клетъчни суспензии на Villus за RNAseq и RT-qPCR, както и суспензии от криптни клетки за RT-qPCR са оцветени в 2% фетален говежди серум (FBS)/PBS с 1: 200 APC-конюгирани анти-Epcam антитела (CD326, eBioscience 17-5791 -82), 1: 1000 AF488-конюгирани анти-CD45 антитела (Biolegend 103122) и 1: 1000 AF488-конюгирани анти-CD31 антитела (Biolegend 102414) за 15 минути при стайна температура, измити 3 пъти и ресуспендирани в 2% FBS/PBS с 3.2 ug/ml ROCK-инхибитор (Y-27632, Sigma). Всички клетъчни препарати бяха оцветени с 4 ’, 6-диамидино-2-фенилиндол (DAPI) преди сортирането. Epcam high CD31 - CD45 - DAPI - клетки бяха сортирани на BD Aria III SORP клетъчен сортиращ апарат със 100 µM дюза (Фиг. S1A, C). ISC (GFP с висок DAPI -) за RNAseq бяха изолирани от суспензии на крипти на Lgr5-GFP + мишки и обработени както по-горе, с изключение на етапа на оцветяване (Фиг. S1B). 60 000–100 000 клетки бяха сортирани в RLT буфер за последваща RNA-изолация съгласно протокола на производителя с RNeasy Micro kit (Qiagen 74004) с разграждане на ДНК в колона. Количеството и качеството на РНК са измерени с биоанализатор Eukaryote Total RNA Pico анализ (Agilent Technologies, 5067–1513).
RNAseq
Биоинформатичен анализ
Четенията на RNAseq бяха адаптирани с Trim Galore (версия 0.4.4) преди картографиране към референтния геном на мишката GRCm38/mm10 с HiSat2 (версия 2.1.0). Уникално картографираните RNAseq данни бяха анализирани с SeqMonk версия 1.42.0. Броят на четенията е количествено определен с помощта на количествения тръбопровод за количествено определяне на RNAseq, реализиран в SeqMonk, количествено определящ обединените транскрипти за екзони със 75-процентилна нормализация на всички библиотеки. Диференциално експресирани гени бяха извлечени от количественото определяне на броя на четените суровини с коригирания с множество тестове алгоритъм DESeq2 45, реализиран в SeqMonk. Анализът на GO-обогатяване на DEGs беше извършен с g: профилир 46 спрямо фоновия списък на чревно експресирани гени, както е подробно описано в допълнителна таблица 1 .
RT-qPCR
Подгрупа от 32 цели е избрана въз основа на тяхното биологично значение от 49-те гена, диференцирано експресирани между млади и стари животни (DESeq2, FDR 2), са проектирани от софтуера NCBI Primer-BLAST с миши mRNA шаблон. Общата РНК беше обратно транскрибирана и количествено определена с Luna Universal One-Step RT-qPCR комплект (NEB E3005) и BioRad термоциклер CFX384. Стойностите на Cq се пробват за проба, нормализирана към Actg1 и впоследствие за целта към средния целеви сигнал във всеки тип клетка. Диференциалната експресия между стари и млади животни се оценява отделно за ISC и AE, като се използва двупосочен ANOVA с корекция на Holm-Sidak за многократно тестване, праг на значимост P 47 (допълнителна таблица 3).
Количествено определяне на неутрофили/моноцити
Бяха подготвени имунофлуоресцентни оцветявания и проведено конфокално изобразяване, както е описано 48 с първично миелопероксидазно (MPO) -антитело (R&D AF3667, 5 µg/ml), инкубирано 2 часа при стайна температура и вторичен анти-козе AlexaFluor 488 (Invitrogen A11055, 10 µg/ml) инкубира се при 4 ° C през нощта. Проведена е пермеабилизация за 4 минути в 0,3% TritonX/PBS. Като блокиращ разтвор се използва 2% BSA/2% магарешки серум/PBS. Не е извършено демаскиране. Изображенията бяха извършени на конфокален микроскоп Zeiss 780 с въздушна обектив 20 × Plan Apo при оптимални настройки на разделителната способност с усредняване 2 пъти. 5 × 2 µm оптични стекове бяха обработени като наслагвания с максимална интензивност (оптична дебелина 8 µm. Контрастното усилване (праг на фоновия сигнал) беше извършено с FIJI 47. Три технически повторения (различни чревни позиции в една и съща проба) бяха измерени и осреднени за проба. Средна обща изобразена площ на крипта на проба: 0,16 mm 2, област на вилуса 0,18 mm 2. Площите на криптите и вилусите са измерени с FIJI, положителните клетки са преброени ръчно след корекция на фона.
- Последователността на целия геном идентифицира нова ABCB7 генна мутация за Х-свързана вродена церебеларна
- Програма за обща реформа на теглото - внимателна жива хипноза
- Транскрипционно регулиране на рецептора на човешки растежен хормон (hGHR) Промотор на ген V2 от
- Най-добрата сделка за живот - групова програма за отслабване
- Програма за трансформация Отслабване от 4 части; Здравна система на червата