Резюме
Заден план
Повтарящият се характер и различното географско разпространение на улцерозен колит (UC) включва факторите на околната среда като диетата в нейната етиология.
Методи
За да се определи кои храни могат да бъдат свързани с активността на заболяването в UC, е разработен и приложен нов метод за диетичен анализ. Осемдесет и един пациенти с UC бяха наети на всички етапи от болестния процес. След попълване на 7-дневен диетичен дневник е проведена клинична оценка, включваща сигмоидоскопско изследване (скала 0 (нормална лигавица) до 6 (много активно заболяване)). Теглото на храната за всеки човек се коригира (разделя) според калорийния прием на човека за седмицата. На всяка консумирана храна се дава оценка за сигмоидоскопия на храната (FSS), изчислена чрез сумиране на продуктите от (коригирано) тегло на консумираната храна и оценка за сигмоидоскопия за всеки пациент и поява на храна и разделяне на общото (коригирано) тегло на консумираната храна от всички 81 пациенти. По този начин храните, консумирани в големи количества от пациенти с много активно заболяване, имат висок FSS и обратно. Храни, консумирани от
Заден план
Улцерозният колит (UC) е хронично, рецидивиращо разстройство на лигавицата, което се разпространява непрекъснато проксимално от ректума и е ограничено до дебелото черво. Етиологията на UC включва генетичен компонент, който вероятно включва анормален клетъчно-медииран имунен отговор на коменсални ентерични бактерии в дебелото черво. Моделът на рецидив/ремисия на разстройството и субстратния характер на микробния метаболизъм в дебелото черво влияят на факторите на околната среда като диетата.
Освен хранителното напълване, диетичните мерки не играят роля в управлението на UC. Независимо от това, опитите за свързване на причината за UC с конкретни храни датират от преди поне 50 години [1]. Много храни или групи храни са свързани с UC (таблица 1 - виж допълнителен файл 1) [2–13], включително захар, яйца, безалкохолни напитки, плодове и зеленчуци, протеини, въглехидрати и мазнини. Доказано е обаче, че нито една не носи значителна полза или не допринася за причината за UC. Това отчасти може да се дължи на факта, че както оценката на активността на заболяването в UC, така и диетичният прием са трудни за измерване или защото действителният хранителен компонент, който е ключов за тази връзка, не е измерен.
Предполага се, че сулфидът, произведен в дебелото черво от аминокиселинна ферментация или редукция на сулфат, може да бъде отключващ фактор за възпалителния процес на UC [14-16]. Наскоро в проспективно диетично проучване, при което храни, богати на сярни съединения, бяха изчислени количествено, бяха открити доказателства, че серните съединения могат да увеличат вероятността от последващ рецидив на UC [17].
Основният източник на неорганична сяра, предимно сулфат, в диетата са семейството на добавките S (IV); сулфитиращите агенти. Сулфитите се използват като хранителни консерванти от 17-ти век и са сред най-широко приеманите и универсални добавки. Сулфитиращите агенти, обозначени с E220–228 в Европа и общопризнати като безопасни (GRAS) вещества в САЩ, включват серен диоксид, водородни сулфити, сулфити и метабисулфити. Сулфитиращите агенти са евтини, лесни за използване и изключително ефективни за предотвратяване на микробния растеж и намаляване на развалянето [18]. Те служат като антиоксиданти, инхибират ензимните и не-ензимните реакции на потъмняване и действат като модификатор на текстурата в бисквитеното тесто. Сулфитите подобряват извличането на цвят от и стабилизирането на гроздова мъст във винопроизводството и предпазват омарите и скаридите от обезцветяване по време на съхранение в лед.
Има обаче някои проблеми с употребата на сулфит [19, 20]. В началото на 80-те години е показано, че поглъщането или вдишването на сулфити причиняват бронхоспазъм при около 5% от астматиците. Сулфитната чувствителност може да представлява особена заплаха на работното място, където се използват сулфитиращи агенти, но може да възникне и при поглъщане на сулфитирани храни като картофени продукти и вино. Освен това се съобщава за чувствителност на кожата и има анти-хранителни ефекти, особено за тиамина, който лесно се разгражда от сулфитния йон [21]. Механизмът включва първоначална нуклеофилна атака на метиленовия въглерод, активиран от положителния заряд върху азота, като скоростта на реакцията достига пик между pH 5 и 6 [18]. В резултат на този анти-хранителен ефект статусът на GRAS за сулфитите е преразгледан в САЩ и през 1986 г. е отменено използването на сулфити в пресни и замразени плодове и зеленчуци и се изисква декларация на етикета [22, 23]. По-рано (в САЩ) употребата им в месо е била забранена, тъй като тези храни са важен източник на тиамин.
Поради това беше предприето проучване на диетата и активността на заболяванията в UC с помощта на 7-дневен диетичен дневник, пълна оценка на активността на заболяването и метод за анализ на хранителните данни, който позволява тенденциите в консумацията на храни, които не са очевидни с помощта на обичайния хранителен софтуер.
Методи
Субекти
Осемдесет и един пациенти с UC бяха наети и получено информирано съгласие. Етично разрешение е дадено от Tayside Committee on Medical Ethics, Dundee, UK (ref 007/00). Тъй като беше важно да има редица болестни дейности, набирането включваше пациенти на всички етапи на заболяването. Пациентите бяха изключени, ако клиничният преглед или хистологията показват болест на Crohn или неопределен колит, ако има положителна култура на изпражнения за патогени или ако пациентът е имал антибиотично лечение в рамките на 3 месеца преди началото на проучването.
Диетична оценка
Всички пациенти с UC бяха помолени да попълнят 7-дневен дневник на диетата [24]. Използваният диетичен дневник е валидиран за използване в Европейското проучване за проспективно разследване на рака (EPIC). След попълване на диетичния дневник субектите присъстваха на изследователската клиника и беше извършена пълна клинична оценка (вж. По-долу). Интервалът от време между първия ден на дневника и клиничното посещение е средно 28 дни. По този начин диетичните данни са перспективни.
7d диетични дневници бяха кодирани и анализирани с помощта на Tinuviel, WISP v3.0 софтуер за хранителен анализ (Warrington, UK). Поради различията в сулфитиращите протоколи и широкото използване на сулфитиращи агенти, настоящите таблици на състава на храните не съдържат стойности на неорганична сяра и не могат да се използват за количествено определяне на приема. Вместо количествено определяне на приема на определени диетични компоненти, храните и хранителните групи бяха оценени изцяло, използвайки метода, описан в раздела за анализ на хранителните данни (по-долу).
Клинична оценка
Клиничната оценка включва анамнеза, физически преглед и глобална клинична оценка, плюс пълна кръвна картина, чернодробни функционални тестове и възпалителни маркери. Пациентите бяха изследвани чрез ригидна сигмоидоскопия или флексисигмоидоскопия и степенувани по скала 0–6 (използвани са цели числа и половини цели числа) според макроскопските прояви на ректалната лигавица на разстояние 5–10 cm от аналния ръб [25]. Клиничната оценка на активността на заболяването се потвърждава във всеки случай чрез хистологично изследване, от един хистопатолог, заслепен за клиничните подробности, на ректална биопсия, взета от задната ректална стена на 5–10 cm от аналния ръб [26]. Прост резултат от клиничен колит е присвоен на пациентите при всяко посещение, следвайки системата за оценяване на Walmsley [27], заедно с кръвни параметри на тежестта на заболяването (Hb, плазмен вискозитет, CRP, серумен албумин).
Анализ на хранителните данни
Моделите на хранителен прием, свързани с активността на заболяването, станаха очевидни чрез изучаването на диетичните дневници, напр. високият прием на храни, съдържащи сулфит, съчетан със съвременна преработена, удобна диета е свързан с висок резултат на сигмоидоскопия. Традиционното диетично кодиране (WISP) не показва такива ясни връзки между приема на микро или макро хранителни вещества и оценката на сигмоидоскопията. Поради това се смяташе, че в традиционните диетични анализи липсват важни модели в диетичните данни и впоследствие беше разработен нов метод за диетична оценка.
Този нов метод използва следната процедура. За да се изчисли връзката на определена храна с клиничен резултат, на всяка консумирана храна или група храна се дава оценка на сигмоидоскопия на храната (FSS), изчислена чрез сумиране на продуктите с тегло на храната и оценка на сигмоидоскопия за всяка поява на храна или група храни и разделяне на общото тегло на храната или групата храни, съдържащи се във всички дневници. За да може всеки дневник да дава еднакъв принос към FSS, теглото на всяка храна се коригира, като се използва калоричният прием за всеки човек. Тази процедура е извършена отделно за всеки хранителен продукт, записан в 7-дневните диетични дневници, но е обяснен по-долу с примера на червено вино.
Резултат за червено вино = (Σv (i) s (i))/Σv (i) за i = 1 до 81 уравнение 1.
i е 7-дневният номер на диетичния дневник (n = 81).
v (i) е обемът (разделен на калориен прием за пациент (i) на червеното вино, записан в 7-дневен диетичен дневник i.
s (i) е резултатът за сигмоидоскопия, свързан със 7-дневен диетичен дневник (i).
По този начин храни, ядени в големи количества от пациенти с високи нива на активност на заболяването, ще имат високи резултати и обратно. Знаменателят в горното уравнение е общият обем на въпросната храна от всички дневници (коригиран за калоричност), така че резултатите от храната могат да бъдат приравнени с ефекта на типична част от въпросната храна върху резултатите от сигмоидоскопията на пациентите . Тази процедура се повтаря за всеки хранителен продукт. Храните или групите храни бяха изключени от анализа, ако 10 или по-малко хора ги консумират или ако те съставляват по-малко от 1 кг от общия прием на цялото население. Решението за това къде са границите на групата храни се взема в зависимост от размера на групата и дали разликите между храните се считат за важни за това проучване.
Статистика и обработка на данни
Диетичните данни бяха експортирани от WISP към Microsoft EXCEL 98 (версия на Macintosh, 1998). Работен лист, съдържащ основните заглавия; Идентификацията на пациента, описанието на храната, теглото и оценката за сигмоидоскопия на пациента бяха попълнени. След това данните бяха сортирани по описание на храната и всяка храна беше копирана в отделен файл EXCEL. След това уравнение 1 се използва за изчисляване на резултатите от сигмоидоскопията на храна за всяка храна по начин, подобен на примера в таблица 2 (виж допълнителен файл 2).
Стойностите на корелация за разпръснати графики бяха получени с помощта на линейната регресионна функция в EXCEL. Уравнението t = r √ ((n-2)/(1-r 2)), комбинирано с t таблици, осигури съответните нива на значимост.
Резултати
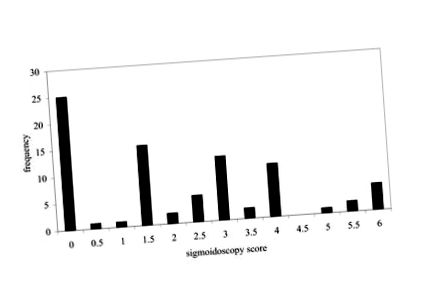
От набраните 81 пациенти 43 са мъже и 38 жени. Средната възраст (диапазон) на мъжете и жените е съответно 53 (26–78) y и 47 (19–74). Разпределението на резултатите от сигмоидоскопията е показано на фигура 1. Една трета от пациентите са имали резултати от сигмоидоскопия от 0, 0,5 или 1. Средният резултат за сигмоидоскопия за всички 81 пациенти е 2,09. Корелацията между показателите за клинична активност и резултатите от сигмоидоскопията е r 2 = 0,25 (n = 81).
Разпределение на честотата на резултатите от сигмоидоскопия (n = 81) за пациенти с улцерозен колит, наети във всички стадии на заболяването.
Таблица 3 (виж Допълнителен файл 3) показва храните и групите храни със съответните резултати от сигмоидоскопия и средните размери на порциите. Общо 75 храни (или групи храни) са получили резултати от FSS. Колкото по-висока е стойността на FSS, толкова по-голяма е връзката с активността на заболяването и обратно. Общото тегло на храните във всички дневници е 1681 кг. Средният резултат за сигмоидоскопия на храната (т.е. резултатът за сигмоидоскопия на храната, изчислен за целия набор от данни за хранителния прием, е 2.127). Храни, изключени от таблицата FSS (Таблица 3), по силата на принос 2 = 0,07, стр
Дискусия
Счита се, че улцерозният колит има генетичен компонент. Двойни проучвания [31] показват 10% съвпадение на UC при монозиготни и 3% при двуяйчни близнаци, което предполага около 90% екологичен и 10% генетичен принос. Следователно групата от генетично податливи индивиди е поне 10 пъти по-голяма от диагнозата на заболяването. Досегашният неуспех при идентифицирането на отговорния ген (и) сочи към сложен генетичен компонент, включващ множество полиморфизми. Първият остър епизод на UC трябва да наруши или екологията, или чувствителността и селективността на имунната система към коменсалната ентерична микрофлора в достатъчна степен, за да причини хроничното състояние. По-екстремните версии на условията на околната среда, които водят до последващи рецидиви, биха могли да доведат до първия остър епизод.
От всички диетични компоненти, изследвани във връзка с риска от UC и тежестта на заболяването, млякото вероятно е получило най-голямо внимание. Андресън [1] беше първият, който постулира, че хранителната алергия е причина за UC при две трети от пациентите му и чрез използването на елиминационни диети се твърди, че идентифицира нарушаващата храна и я премахва. Според опита на Андресън най-често провокиращият антиген е кравето мляко. Неговите възгледи бяха потвърдени от Rowe [32], а по-късно и от Truelove [33]. Всички те постулират, че чувствителността на млечния протеин е утежняваща причина за заболяване при до 5% от пациентите с колит, които са се възползвали от диета без мляко. Въпреки че са в състояние да демонстрират циркулиращи антитела към млечни протеини по-често и с по-висок титър, отколкото при съответстващите контроли, те не са били в състояние да свържат появата и титъра на тези антитела със степента, тежестта или продължителността на колит или с отговора на млякото -безплатна диета. В преглед на темата Мишкин [34] заключава, че пациентите с IBD избягват млечни продукти в много по-голяма степен, отколкото би могло да оправдае разпространението на лактозната малабсорбция и/или непоносимостта към мляко в тази популационна група. Това наблюдение вероятно се дължи на неправилното възприятие на пациентите и произволните съвети на лекари и автори на популярни диетични книги.
За да се установи дали диетичните антигени могат да поддържат лигавичния възпалителен отговор, две проспективни контролирани проучвания са изследвали ефективността на почивката на червата и пълното парентерално хранене като първична терапия при лечението на остър UC [35, 36]. Нито едно от проучванията не е установило каквато и да е полза от конвенционалното лечение с кортикостероиди самостоятелно, така че възможността диетичен антиген да стимулира хронифицирането на заболяването изглежда малко вероятно. Тези резултати са в съгласие с работата, показваща [37], че разделената илеостомия е от малка полза при управлението на UC, но последните наблюдения може да са объркани от развитието на диверсионен колит [38].
Докато индексите на клиничната активност бяха използвани за генериране на аналогични резултати на резултатите от сигмоидоскопията на храните, резултатите от тези измервания не са включени в тази статия. Индексът на клинична активност включва субективни измервания като чувство за благополучие. По този начин не се смяташе, че поръчките за храна, генерирани от тези измервания, са толкова точни, колкото тези, генерирани от резултатите от сигмоидоскопията.
Консенсусът от предишни проучвания относно диетата и UC посочва съвременните, преработени, високо рафинирани, западни диети като вредни. Представените тук резултати, свързващи диетата с активността на заболяванията, са в цялостно съгласие с това. Освен това те предлагат нов рисков фактор за UC, а именно прием на сулфитирани храни.
Имаше обаче подгрупа (n = 8) от тази популация, която регистрира прием на комплекс от витамин В или мултивитамини. Тази подгрупа не е имала среден резултат за сигмоидоскопия значително по-нисък от общата популация на UC. Вероятно витамин В1 е фактор в болестния процес, но не е единственият хранителен.
Всички хранителни съвети, предоставяни на пациенти с улцерозен колит, трябва да се основават на таблицата на FSS. Таблицата разбира се е несъвършена поради експериментална грешка, естествени вариации и връзките между храните. Например млякото и зърнените храни се кодират отделно, но често се консумират заедно. По този начин величината на разликата в FSS за тези две храни е по-малка, отколкото ако те са независими променливи. В тази дискусия бяха направени предложения относно факторите, отговорни за заповедта за FSS, и тези фактори да бъдат дестилирани в съветите, дадени в таблица 5 (вж. Допълнителен файл 5). Тази таблица е спекулация, тъй като тази диета не е тествана официално в популацията на UC. Това обаче представлява единственият изчерпателен хранителен съвет, който понастоящем е достъпен за пациенти с улцерозен колит.
Списъкът с диетични рискови фактори за рак на дебелото черво [42] носи сходство с диетичните рискови фактори, представени тук за UC. Пациентите с UC имат повишен риск от колоректален рак и е вероятно факторите, отговорни за възпалението при пациентите с UC, също да са отговорни за неоплазията в популацията от рак на дебелото черво.
Заключение
Описан е метод на диетичен анализ, който предоставя нов инструмент за установяване на връзката между диетата и болестта. Този метод е приложен за изследване на улцерозен колит и посочва, че сулфитът и кофеинът са вредни, като тиаминът и резистентното нишесте са потенциално терапевтични. За първи път са разработени диетични насоки за пациенти с улцерозен колит, включително размери на порциите храна.
- Успокояващи корема рецепти за болест на Crohn’s и улцерозен колит
- 20 Съвети за диета при улцерозен колит Храни, които трябва да се ядат и избягват
- Може ли хранителната диета да замени ексклузивното ентерално хранене за пациенти с Crohn; s Болест AGA
- Аюрведа улцерозен колит диета съвети, домашни средства
- Асоциации между диетата и психичното здраве с помощта на 12-позиционния въпросник за общо здраве