Резюме
През последните две десетилетия хранителната алергия се очерта като основен проблем на общественото здраве в западните общества. 1 2 При американски деца под 18-годишна възраст разпространението на хранителната алергия се е увеличило с 18%, а разпространението на алергията към фъстъци се е утроило (0,4% до 1,4%) от 1997 до 2008 г. 3, 4 5 Хранителната алергия е най-много често срещана причина за анафилаксия, оценена в спешните отделения във всички възрастови групи и броят на хоспитализациите за индуцирана от храна анафилаксия се е увеличил повече от 3 пъти през последното десетилетие в САЩ и Великобритания. 3, 6, 7 Анафилаксията, предизвикана от храна, от време на време води до смъртни случаи, като над 90% от смъртните случаи в САЩ са причинени от реакции към фъстъци или ядки. 8, 9
Подходи към имунотерапията с хранителна алергия
Неспецифичните подходи включват моноклонални анти-IgE антитела, които могат да увеличат праговата доза за реактивност към хранителни алергени, и китайска билкова формулировка, която предотвратява индуцирана от фъстъци анафилаксия в миши модел на анафилаксия на фъстъци и в момента се изследва в клинични проучвания.
Избор на кандидати за нови терапии за хранителни алергии
ТАБЛИЦА I
Значение на последователните IgE-свързващи епитопи в яйчен белтък, краве мляко и фъстъци
| Яйце бял овукоид | ||
| Cooke & Сампсън 1997 г. 16 | Деца с постоянна алергия към яйца и атопичен дерматит; овокоидните додекапептиди, припокриващи се с 10 аминокиселини (AA) са синтезирани на a ПЕТНИ мембрана. | Серумът от субект с преходна алергия към яйца няма IgE антитела срещу редуцирани и алкилирани (последователни епитопи) овукоид, докато серумът от субект с персистиращо яйце алергия разпознава последователни овукоидни епитопи. |
| Ярвинен 2007 г. 20 | 11 деца с преходни и 7 деца с постоянни алергия към яйца; централните декапептиди от всеки от основни IgE свързващи епитопи на овукоид, синтезирани на а SPOTs мембрана; Имуномаркирането беше направено с серуми на отделни пациенти. | И двете групи имат сравним диапазон на специфични за яйцето нива на IgE, но никой от пациентите с преходна алергия към яйца няма IgE антитела срещу тези епитопи на овукоид: AA 1-10, 11-20, 47-56 и 113-122. За разлика от това, всичките 7 пациенти с постоянна алергия към яйца разпознават поне 4 от тези имунодоминантни епитопи. |
| Мляко | ||
| Ярвинен 2001 г. 18 | 10 пациенти с постоянна алергия към мляко и 10 пациенти които впоследствие надраснаха млечната си алергия; 25 декапептиди на алфа (s1) -казеин, алфа (s2) -казеин, капа-казеин, алфа-лакталбумин и бета-лактоглобулин, съдържащ ядрените епитопи, синтезирани върху a SPOTs мембрана; Използвани са серуми от отделни пациенти имуномаркиране | Пет IgE-свързващи епитопи (2 на алфа (s1) -казеин, 1 на алфа (s2)- казеин и 2 върху капа-казеин) не са разпознати от нито един от пациенти с преходна алергия към мляко, но показват свързване от по-голямата част от пациентите с постоянна алергия. Антитела срещу при поне 1 от 3 епитопи (AA 123-132 върху алфа (s1) -казеин, AA 171-180 върху алфа (s2) -казеин и AA 155-164 върху капа-казеин) бяха идентифицирани при всички пациенти с постоянна алергия към мляко. |
| Уанг 2010 г. 23 | 33 деца с алергия към мляко и 8 деца, които са прераснали алергия към мляко; пептиди, състоящ се от 20 аминокиселини припокриващи се със 17 (3-офсет) и съответстващи на основния последователности на αs1-, αs2-, β- и κ-казеини и β-лактоглобулин, бяха поставени върху стъклени пързалки. | Субектите с алергия към мляко са имали увеличено епитопно разнообразие в сравнение с тези, които са прераснали алергия към мляко. Обвързване с по-голям брой IgE пептидите са свързани с по-тежки алергични реакции по време на предизвикателство. В конкурентен анализ на пептидни микрочипове, алергичен пациентите демонстрират комбинация от IgE с висок и нисък афинитет обвързващо, докато субектите, които са надраснали алергията си към мляко, са имали предимно свързване с нисък афинитет. |
| Фъстъчено Ara h 1, Ara h 2, Ara h 3 (пептиден микрочип) | ||
| Шрефлер 2004 г. 21 | Бяха седемдесет и седем пациента и 15 контролни серума анализирани. Набор от 213 припокриващи се 20 остатъка пептиди е синтезиран, съответстващ на основния последователности на Ara h 1, Ara h 2 и Ara h 3. Пептиди бяха подредени в три екземпляра заедно със съответните рекомбинантни протеини върху стъклени стъкла и се използват за имуномаркиране | По-голямата част от пациентите (97%) са имали специфичен IgE за поне един от рекомбинантни алергени; 87% са имали откриваеми IgE до последователни епитопи. Отделните пациенти са имали значителна хетерогенност в брой и модели на разпознат епитоп. Високо епитопно разнообразие е открит при пациенти с анамнеза за по-тежки алергични заболявания реакции. |
| Флинтър- ман 2008 г. 22 | 24 деца, чувствителни към фъстъци и 6 атопични контроли; Специфично свързване на IgE и IgG4 с 419, припокриващи се 15-AA пептиди, представляващи последователността на рекомбинантен Ара h 1, Ara h 2 и Ara h3 бяха анализирани с микрочип имуноанализ. | Чувствителните към фъстъци серуми свързват значително повече IgE и IgG4 епитопи, отколкото контролни серуми. Имаше положителна връзка между брой разпознат IgE епитоп и клинична чувствителност (r = 0,6; P = .021). Моделите за разпознаване на епитоп на IgE и IgG4 са стабилни период от 20 месеца. |
ИМУНОТЕРАПЕВТИЧНИ ПОДХОДИ ЗА ЛЕЧЕНИЕ НА ХРАНИТЕЛНА АЛЕРГИЯ
Пациентите с хранителна алергия могат да бъдат разделени на 3 основни фенотипа; преходна хранителна алергия, постоянна хранителна алергия и синдром на хранителен прашец (орална алергия). Въз основа на развиващите се доказателства, изглежда, че всяка от тези форми на IgE-медиирана хранителна алергия е резултат от различни имунологични механизми и следователно е вероятно да се изискват различни имунотерапевтични подходи, за да се постигне разрешаване. Изглежда, че пациентите с преходна хранителна алергия ще имат най-благоприятния отговор на терапията. Въпреки че може да се твърди, че преходната хранителна алергия не изисква лечение, потенциалните ползи от терапията включват ускорено развитие на толерантност и подобрено качество на живот и хранене. Постоянната хранителна алергия може да представлява по-трудна ситуация. Пациентите с персистираща форма на хранителна алергия е вероятно да имат по-неблагоприятен отговор на терапията, включително неуспех да се десенсибилизира, неуспех да се развие орална поносимост, нужда от по-продължителен курс на лечение и развитие на по-сериозни нежелани реакции по време на терапията. Тъй като опитът с различни режими на лечение се увеличава, ние ще бъдем по-добре подготвени да съветваме пациентите за оптимални индивидуализирани терапевтични възможности.
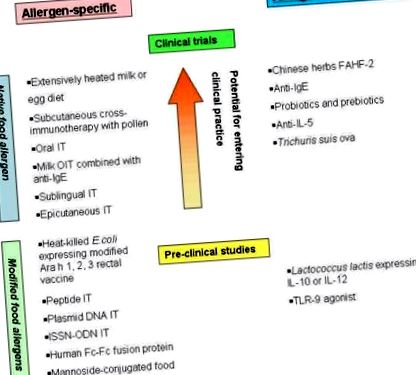
АЛЕРГЕН-СПЕЦИФИЧНА ИМУНОТЕРАПИЯ
Диета, съдържаща силно загрято мляко и яйце
Няколко проучвания демонстрират, че децата с преходна алергия към яйца и мляко произвеждат IgE антитела, насочени предимно срещу конформационно-IgE-свързващи епитопи, които се разрушават при продължително нагряване или обработка на храна. 16, 17 Въз основа на тези наблюдения, ние предположихме, че децата с преходна алергия към мляко и яйца, което включва до 80% от децата с алергия към мляко и яйца, биха толерирали печени продукти, съдържащи мляко и яйце. Две клинични проучвания изследват толерантността на силно загрято (запечено в други продукти) мляко и яйца при деца с алергия към мляко и яйца. 25, 26 И в двете проучвания приблизително 80% от децата понасят силно загрято мляко и яйчни продукти по време на първоначално орално предизвикателство, контролирано от лекар. Тежки реакции, които изискват лечение с епинефрин, се наблюдават само при деца, които реагират на силно загрятите млечни продукти, но не и при деца, които толерират силно загрято мляко и реагират на неотопляемо мляко. За разлика от това, няма такова разграничение при децата, реагиращи на силно нагрявани или неотопляеми яйчни продукти.
Специфичните за храната нива на IgE и кожните тестове не са надеждни маркери за идентифициране на деца, толерантни към силно нагрято мляко или яйце, и са необходими орални предизвикателства. Въпреки това, по-голямата част от децата, които реагират на силно нагрято мляко, имат специфични за мляко нива на IgE антитела над 35 kUA/L (UniCAP, Phadia). В проучване, проведено при различна популация пациенти, положителна точка за решение за реактивност към нагрято яйце е 10,8 kUA/L, а отрицателната точка за решение е 1,2 kUA/L (UniCAP, Phadia). 27
Децата, които са реагирали на силно загрято мляко, са имали значително по-висока реактивност на базофили към стимулация с казеин в сравнение с децата с толерантност към силно мляко. 28 Имаше значително по-висок среден процент (25% до 75th%) 16,9% (7,1-31,7) от пролифериращи казеин-специфични CD25 (+) CD27 (+) Т-клетки от индуцирани от казеин PBMC култури от 18 силно загряти млечно толерантни субекти в сравнение с 8 субекти, реагиращи на силно загрято мляко; 4,9% (2,6-7,5); P 29 Няма значителни разлики между групите в честотата на поликлонални Т клетки или специфични за казеин Т ефекторни клетки. Т-регулаторните клетки, специфични за казеин, бяха FoxP3 (+) CD25 (hi) CD27 (+), CTLA 4 (+), CD45RO (+) CD127 (-). Изчерпването на CD25 (hi) клетките преди in vitro култура значително засилва специфичното за казеин разширяване на Т ефекторните клетки, потвърждавайки наличието на по-голяма регулаторна активност на Т. По-висока честота на специфични за казеина Т регулаторни клетки корелира с фенотип на лека преходна алергия към мляко и благоприятна прогноза.
Печени изделия с мляко или яйце бяха добавени към диетите на толерантни деца, които бяха проследявани на всеки 3-6 месеца. Не са наблюдавани увеличения при остри алергични реакции или при тежест на основните атопични заболявания като астма, атопичен дерматит или екзема. Не е имало повишение на чревната пропускливост (определено с измерване на уринарния клирънс на лактулоза и манитол) през първата година върху диетата и няма отрицателни ефекти върху растежа. Имунологичните промени, наблюдавани след въвеждането на печени изделия с мляко и яйца в диетата, включват увеличаване на специфичните за храната антитела IgG4, намаляване размера на пшеницата от кожни тестове за убождане и тенденция за намаляване на специфичните за храната IgE антитела; находки, подобни на наблюдаваните при орална имунотерапия. Предварителните констатации показват, че много от децата, поставени на печени продукти, изпитват ускорена индукция на толерантност и продължава голямо проучване за установяване на безопасността и ефикасността на въвеждането на печени продукти в диетите на толерантни деца като форма на имунотерапия.
Подкожна фъстъчена имунотерапия
Подкожната имунотерапия се използва повече от 100 години за лечение на алергии към околната среда. В проучване, използващо воден екстракт от фъстъци, трима активно лекувани пациенти са показали 67% до 100% намаляване на симптомите по време на двойно-сляпо, плацебо контролирано предизвикателство за храна и са имали намаляване на 2 до 5 log в кожата в крайна точка реакция на убождане с фъстъци в края на курса на лечение, докато един лекуван с плацебо субект няма промяна в тези параметри. 30 В следствие на аптечна грешка, един лекуван с плацебо пациент почина от анафилаксия след прилагане на доза екстракт от фъстъци, което доведе до прекратяване на проучването. Това трагично събитие подчерта сериозните рискове от фъстъчената имунотерапия.
В последващо проучване 6 субекта са лекувани с поддържаща доза от 0,5 ml 1: 100 тегло/обем екстракт от фъстъци и 6 са проследени като наблюдавана нетретирана контролна група в продължение на 12 месеца. 31 В края на 12 месеца, всичките 6 лекувани субекта понасят повишена прагова доза от фъстъци по време на орални предизвикателства с храна и имат намалена чувствителност при титрирано изпитване на удряне на фъстъчена кожа, докато нелекуваните контроли не са имали подобрение в тези параметри. Анафилаксията с респираторно засягане обаче се провокира средно 7,7 пъти по време на фазата на прилив (23% от дозите) със средно 9,8 инжекции с епинефрин на субект, лекуван с имунотерапия с фъстъци. Само 3 от 6 субекта успяха да постигнат предвидената поддържаща доза поради чести нежелани реакции. По време на поддържащата фаза, честотата на системните реакции е 39%, със средно 12,6 инжекции с адреналин на субект. Докато това проучване предостави доказателства, че инжектираният хранителен алерген може да предизвика десенсибилизация, високият процент на непредсказуеми, тежки нежелани реакции обезкуражи по-нататъшната оценка на тази форма на терапия.
Имунотерапия с полени за кръстосано реактивната храна
Концепцията за кръстосана имунотерапия е приложена към синдрома на поленова хранителна алергия (PFAS, наричан още синдром на орална алергия). Няколко проучвания показват променливи благоприятни ефекти върху оралните симптоми и реактивността на кожните тестове към определени растителни храни при субекти, лекувани с полен подкожна или сублингвална имунотерапия. 32 - 35 36 Открито изпитване на подкожна имунотерапия с бреза при 49 възрастни с алергичен ринит от бреза и PFAS към ябълка установи значително намаление (50-95%) или пълно разрешаване на индуцираните от ябълката орални симптоми при 84% от лекуваните полза от контролите (P 32 В последващо проучване, над 50% от пациентите понасят ябълка при 30-месечно посещение (18 месеца след прекратяване на имунотерапията с бреза); по-голямата част се връща към положителни кожни тестове за убождане. Други клинични проучвания в кои орални симптоми на алергия към ябълка и други сурови храни са диагностицирани с DBPCFCs подкрепят благоприятен ефект от подкожна имунотерапия с бреза при подгрупа субекти.34, 37 35 Сублингвална имунотерапия (SLIT) с екстракт от брезов прашец при възрастни с алергичен ринит от бреза намаляване на симптомите на PFAS, предизвикани от ябълките
Благоприятните ефекти върху PFAS са докладвани предимно при възрастни, моносенсибилизирани към цветен прашец на бреза и лекувани с имунотерапия с полени с високи дози. Т-клетъчните имунни отговори на брезовия прашец, кръстосано реактивни основни хранителни алергени, като ябълка Mal d 1, лешник Cor a 1 и морков Dau c 1, са частично независими от Bet v 1. Следователно, ваксините, базирани на модифицирани, рекомбинантни хранителни алергени, могат да представляват превъзходен подход при лечението на PFAS.
ХРАНИТЕЛНА УСТНА ИМУНОТЕРАПИЯ
За успешна орална имунотерапия (OIT) при момче с индуцирана от яйцеклетки анафилаксия се съобщава за първи път през 1908 г. 11 В момента оралната имунотерапия (OIT) с храна е един от най-активно изследваните терапевтични подходи за хранителна алергия, въпреки че малко опити са установили пациент реактивност преди терапията и/или включва плацебо контрол. Освен това, докато проучванията показват, че повечето пациенти с алергия към храни могат да бъдат десенсибилизирани с OIT, нито едно проучване не е демонстрирало развитието на толерантност. В допълнение, нежеланите реакции по време на терапията са чести, т.е.> 25% от дозите, свързани с неблагоприятни симптоми, въпреки че повечето са с лек характер. (Таблица II)
ТАБЛИЦА II
Опити в хранителната орална имунотерапия
Орална толерантност срещу десенсибилизация
Крайната цел на терапията с хранителни алергии е постоянната орална толерантност, която се установява, когато храната може да бъде погълната без алергични симптоми, въпреки продължителните периоди на избягване. Механизмът на постоянен орален толеранс вероятно включва първоначалното развитие на регулаторни Т клетки и имунологично отклонение далеч от проалергичния Th2 отговор, последвано от анергия на по-късните етапи. 39 За разлика от това, в „десенсибилизирано състояние“ защитата зависи от редовното поглъщане на хранителния алерген; когато дозирането е прекъснато или прекратено, защитният ефект може да бъде загубен или значително намален. Имунологичните промени, придружаващи орална десенсибилизация, включват намалена реактивност на мастоцитите и базофилите, повишени специфични за храната IgG4 антитела и в крайна сметка намалени специфични за храната IgE антитела. Постоянството на защитата може да бъде тествано с умишлено прекъсване на дозирането за поне 4 - 12 седмици, последвано от контролирано орално предизвикателство за храна. 40, 41
График на дозиране
По време на OIT храната се смесва в превозно средство (безопасна храна) и се поглъща в постепенно увеличаващи се дози. Ескалацията на дозата обикновено се случва в контролирана обстановка и ежедневното поглъщане на поносими дози по време на фазите на натрупване и поддържане се извършва у дома. Ранните неконтролирани проучвания предоставят доказателства, че подгрупа от хранителни алергични субекти може да бъде „десенсибилизирана“ към различни храни, включително мляко, яйца, риба, плодове, фъстъци и целина. 42 - 45 Някои пациенти, които понасят поддържаща доза, дори за значителен период от време, отново развиват алергични симптоми, ако храната не се поглъща редовно, подчертавайки опасението, че не е постигната постоянна толерантност. 40
Мляко OIT
Модели на отговор на перорална имунотерапия с храна
От публикуваните проучвания се появяват различни модели на реакция към OIT. 40, 41, 46, 49, 51 (Фигура 2) Приблизително 10-20% от пациентите се провалят в началната фаза на прилив/ескалация (неуспех на десенсибилизация) и се оттеглят от протоколите поради значителни нежелани реакции; 10-20% не успяват да постигнат пълната планирана поддържаща доза (частична десенсибилизация). Като цяло, приблизително 50-75% постигат и понасят поддържащата доза. По-голямата част от децата понасят> 5 g от алергенната храна, докато са на терапия, но остава да се определи дали частично десенсибилизираните пациенти могат да станат толерантни с по-голяма продължителност на OIT. Също така не е ясно дали неуспехът на десенсибилизацията е свързан с най-тежкия и вероятно траен фенотип на хранителна алергия, за разлика от успешната десенсибилизация и индукция на толерантност, които могат да бъдат свързани с преходен клиничен фенотип и по-високи шансове за спонтанно разрешаване на хранителната алергия.
- Разлика в хранителните алергии IgE; IgG хранителни алергии • ImuPro
- Изкопаеми храни, консумиращи нашето бъдеще
- Хранене без страх Лечения за хранителни алергии
- Деца с екзема връзката с хранителните алергии не е ясна
- Котешки акне и хранителни алергии са разрешени напълно или цялостно, напълно цялостно; бутик за