Резюме
Заден план
Ацетаминофенът (APAP) е леснодостъпен и безопасен обезболяващ препарат. Предозирането му обаче е най-честата причина за остро чернодробно увреждане (ALI). Много предразполагащи фактори допринасят за податливостта към APAP-индуциран ALI. Безалкохолната мастна чернодробна болест (NAFLD), основната причина за хронично чернодробно заболяване, се счита за важен предиктор на АЛАР-индуцирана ALI, въпреки че точният механизъм е противоречив. В това проучване имахме за цел да изясним ефектите на NAFLD върху APAP-индуцираната ALI.
Методи
Две групи мишки, хранени с диета с нормална храна (NC) и диети за бързо хранене (FF) в продължение на 14 седмици, бяха допълнително разделени на две подгрупи: интраперитонеално инжектирани с физиологичен разтвор (NC-S и FF-S групи) или APAP (NC-A и FF-A групи). Проведени са биохимични тестове, хистологичен анализ, количествена PCR и уестърн блотинг.
Резултати
Ниво на аланин аминотрансфераза (ALT) (199,0 ± 39,0 срещу 63,8 ± 7,4 IU/L, стр
Заден план
Ацетаминофенът (APAP) е леснодостъпно и често използвано антипиретично и аналгетично лекарство в световен мащаб [1,2,3]. Той е безопасен, когато се прилага в рамките на терапевтичната доза; обаче предозирането му е най-честата (50%) причина за остра чернодробна недостатъчност в САЩ и други западни страни [2, 3]. APAP-индуцираното остро чернодробно увреждане (ALI) е дозозависимо хепатоцелуларно увреждане. APAP се метаболизира от ензими P450, предимно цитохром P450 2E1 (CYP2E1), и се превръща в н-ацетил-стр-бензохинон имин (NAPQI). NAPQI се детоксикира от глутатион (GSH) и неговото натрупване води до изчерпване на GSH [4]. В допълнение, това събитие е последвано от митохондриална дисфункция, генериране на реактивни кислородни видове (ROS) и некротична клетъчна смърт. Патологично, APAP-индуцираният ALI се характеризира със сливна центрозонална некроза [5]. Лечението на това обикновено включва ранно н-терапия с ацетилцистеин и поддържащи грижи; в някои случаи обаче е необходима спешна трансплантация на черен дроб [6].
Безалкохолната мастна чернодробна болест (NAFLD) се счита за рисков фактор за APAP-индуцирана ALI [7]. NAFLD засяга до 20–40% от населението по света [8, 9] и е основна причина за свързаната с черния дроб заболеваемост и смъртност [10]. Безалкохолният стеатохепатит (NASH), тежка форма на NAFLD, придружава от оксидативен стрес, за който също се смята, че води до тежък APAP-индуциран ALI.
Експериментите in vivo обаче дават противоречиви резултати. Повечето проучвания показват, че гризачите с NAFLD развиват тежка APAP-индуцирана ALI [11,12,13]. И обратно, някои проучвания показват, че гризачите с NAFLD са устойчиви на APAP-индуциран ALI [14, 15]. Това несъответствие може да се дължи на разликите в видовете гризачи, приложената доза APAP, методът на приложение и установяването на NAFLD.
Много методи като генетична модификация [11, 12] и различни диети [13, 14, 16] са били използвани за установяване на животински модели на NAFLD. Появата на NAFLD при хората е увеличена поради увеличената консумация на бързо хранене (FF) и консумацията на напитки, съдържащи фруктоза [9]. Модели на гризачи на NAFLD, предизвикани от диетата с FF, са установени, използвайки диети, които имитират човешка FF диета; освен това тези модели се различават от установените по-рано животински модели на NAFLD [17, 18]. Въпреки това, животински модел на FF-индуциран NAFLD все още не е използван за оценка на APAP-индуциран ALI.
Настоящото проучване изясни ранните ефекти на NAFLD върху APAP-индуцираната ALI и определи основните механизми. Доколкото ни е известно, това е първото проучване, свързано с APAP, включващо миши модел на индуцирана от FF диета NAFLD.
Методи
Лечение на животни
Биохимичен анализ
Нивата на серумна аланин аминотрансфераза (ALT), глюкоза и холестерол бяха анализирани с помощта на автоматизиран анализатор за клинична химия (DRI-CHEM 4000i; FujiFilm, Токио). Нивата на серумния инсулин и чернодробните триглицериди са измерени с помощта на търговски комплекти (съответно Alpco, Salem, NH и Wako, Осака, Япония).
Western blot анализ
Чернодробни експресии на CYP2E1, активиран от пероксизомен пролифератор рецептор гама (PPAR-γ), ядрен фактор-капа B (NF-кВ), извънклетъчна сигнално-регулирана киназа (ERK), фосфорилирана ERK (p-ERK), фосфорилирана карта киназа киназа 4 (p-MKK4), фосфорилирани c-Jun N-терминални кинази (p-JNK), p62, фосфорилирани p62 (p-p62), ядрен фактор, свързан с еритроид 2 фактор 2 (NRF2), β-актин са определени чрез извършване на уестърн попиване. Подобно претеглени чернодробни секции, получени от мишки във всяка група, се хомогенизират в лизисен буфер и се центрофугират. Протеините се разделят чрез електрофореза върху 4-12% градиент Bis-Tris гелове; прехвърлени в нитроцелулозни мембрани Hybond ECL; и имуноблотирани, използвайки anti-CYP2E1 (Abcam, Cambridge, UK), anti-PPAR-γ (Cell Signaling, Danvers, MA), anti-NF-κB (Cell Signaling), anti-ERK (Cell Signaling), anti-p- ERK T202/Y204 (клетъчна сигнализация), анти-p-MKK4 S257 (клетъчна сигнализация), анти-p-JNK T183/Y185 (клетъчна сигнализация), анти-p62 (клетъчна сигнализация), анти-p-p62 S349 (клетъчна сигнализация) ) и антитела срещу NRF2 (клетъчно сигнализиране). За оценка на равното натоварване се използва антитяло срещу β-актин (Sigma-Aldrich).
Обратна транскрипция-количествена полимеразна верижна реакция
За извършване на обратна транскрипция-количествена полимеразна верижна реакция (RT-qPCR), общата РНК от черния дроб на мишката се екстрахира с помощта на RNeasy Mini Kit (QIAGEN GmbH, Hilden, Германия). Допълнителната ДНК се синтезира с помощта на ензим Superscript II (Gibco/Invitrogen, Grand Island, NY) и се анализира чрез извършване на qPCR с SYBR Green PCR Kit и TP800 Therm Cycler Dice System в реално време (Takara Bio Inc., Otsu, Япония). Всички данни бяха нормализирани до получените за гена, кодиращ рибозомния L32. Всички праймери, използвани за изпълнение на qPCR, са изброени в Допълнителен файл 1: Таблица S2. Различията в генната експресия се считат за значими, когато относителното съотношение (RR) на нивата на иРНК между две групи е повече или равно на 1,5.
Хистологичен анализ
Части от левия страничен лоб с подобен размер, получени от черния дроб на мишки от всяка група, бяха фиксирани в 10% неутрално буфериран формалин за 24 часа. След това чернодробните части бяха изрязани, разделени на приблизително 5 μm дебели участъци, обработени и оцветени с хематоксилин и еозин (H&E) [19] и трихромно оцветяване на Masson’s. Анализът на терминиращата деоксинуклеотидил трансфераза dUTP nick-end маркиране (TUNEL) се извършва чрез оцветяване на чернодробните секции с In Situ Cell Death Detection Kit, AP (Roche Diagnostics, Indianapolis, IN), в съответствие с инструкциите на производителя [20]. Хистологичният анализ е извършен от двама опитни патолози по заслепен начин. Тежестта на NAFLD се оценява, като се използва оценка на активността на NAFLD, съставена от стеатоза, балониране и лобуларно възпаление.
Статистически анализ
Резултатите се изразяват като средна стойност ± стандартно отклонение (SD) или стандартна грешка на средната стойност (SEM), както е посочено в легендите на фигурите. Статистическите разлики бяха оценени от Student’s т-тест, с стр
Резултати
Проява на NAFLD
Мишките, хранени с FF диета в продължение на 3 седмици, са били значително по-затлъстели от тези, хранени с NC диета за три седмицистр Фиг. 1
Уестърн блотинг анализ на чернодробни молекули. Показани са нива на чернодробни противовъзпалителни и възпалителни протеини от всички групи. β-актинът е използван за потвърждаване на еднакво натоварване с протеини
Представяне на API-индуциран ALI
Нивата на ALT са били по-високи при мишки в групата NC-A, отколкото при мишки от групата FF-A (8447,8 ± 1185,3 срещу 836,6 ± 185,1 IU/L, стр Фиг. 3
Нива на ензими, свързани с метаболизма на APAP
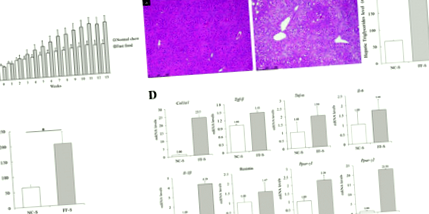
Нивата на тРНК на гените, кодиращи уридин дифосфат глюкуронозилтрансфераза 1A1 (UGT1A1) и UGT1A9, които са ключовите ензими, участващи в глюкуронирането, не се различават значително между мишките в групите NC-S и FF-S (RR = 1,34 и 1,30; Фиг. . 4А). Резултатите от Western blot анализ показват по-висока експресия на CYP2E1 при мишки, хранени с FF диета, отколкото при мишки, хранени с NC диета (Фиг. 2).
RT-qPCR на чернодробни молекули, свързани с метаболизма на APAP и оксидативен стрес. a Относителни нива на иРНК на гени, кодиращи чернодробни UGT1A1 и UGT1A9. Тези нива на иРНК не се различават значително между мишките в групите NC-S и FF-S. б Относителни нива на иРНК на гени, кодиращи чернодробни молекули между NC-A и FF-A групи. По-ниско ниво на възпалителни ензими и по-високо ниво на антиоксидантни ензими са представени в групата на FF-A
Молекули, свързани с APAP-индуциран ALI
Нивото на иРНК на гена Tribbles homolog 3 (Trib3), което индиректно отразява изчерпването на GSH [21], е по-високо при мишки в групата NC-A, отколкото при мишки от групата FF-A (RR = 1,82; Фиг. 4В). Нивата на тРНК на гени, кодиращи TNF-α, IL-6, IL-1β и p21, са по-високи при мишки в групата NC-A, отколкото при мишки от групата FF-A (RR = 2.06, 3.21, 2.30 и 1.68, съответно). Резултатите от Western blot анализ показват по-висока експресия на NF-κB, p-ERK, p-MKK4 и p-JNK в тъканни хомогенати на мишки в групата NC-A, отколкото при тези на мишки от групата FF-A (Фиг. 2 ), което показва повишените провъзпалителни сигнали в черния дроб. Обратно, нивата на тРНК на гени, кодиращи PPAR-γ, циклин-D1, GPX2 и GSTM1, са били по-ниски при мишки в NC-A група, отколкото при мишки от групата на FF-A (RR = 0.45, 0.43, 0.53 и 0.66, съответно; Фиг. 4Б). Резултатите от Western blot анализ показват по-висока експресия на PPAR-γ, p62, p-p62 и NRF2 в тъканните хомогенати на мишки от групата FF-A, отколкото при тези на мишки от групата NC-A (фиг. 2), което предполага, че повишен антиоксидантен отговор и противовъзпалителни сигнали. Това може да окаже защитен ефект срещу APAP.
Дискусия
В настоящото проучване NAFLD е успешно установено при мишки чрез прилагане на FF диета, допълнена с фруктоза в продължение на 14 седмици. Биохимичният анализ на кръвни проби показва хиперхолестеролемия, високо ниво на серумна глюкоза на гладно и инсулинова резистентност при мишки от групата на FF-S. Хистологичният анализ предполага висока степен на стеатоза и лобуларно възпаление и висок резултат на активността на NAFLD в групите FF-S и FF-A. Резултатите от RT-qPCR показват повишено ниво на иРНК на гени, кодиращи фиброза и възпалителни маркери и липидни модулатори като PPAR-γ. Резултатите от анализа на вестерн-блот също показват ярко изразяване на възпалителни и метаболитни маркери. Тези резултати показват, че краткосрочното приложение на FF диета, допълнена с фруктоза, индуцира развитието на NASH и метаболитен синдром.
Освен това установихме, че мишките от групата NC-A показват по-високо ниво на ALT, по-широка некротична област и по-висока степен на фрагментация на ДНК в сравнение с мишки от групата FF-A. Тези резултати показват, че APAP-индуцираният ALI е по-малко тежък при мишки с NAFLD и е в съответствие с тези от няколко предишни проучвания [14, 15]. Последващите анализи бяха извършени, за да се определят механизмите, в основата на ефектите на NAFLD върху APAP-индуцирана ALI.
APAP претърпява катализирано от CYP2E1 окисление след глюкурониране и сулфатиране, което води до производство на NAPQI [4]. Нивата на тРНК на гени, кодиращи UGT1A1 и UGT1A9, не се различават значително между групите NC-A и FF-A. Въпреки това, нивото на CYP2E1 в черния дроб се повишава при мишки, хранени с FF диета, което може да причини образуване на NAPQI и индуциран от APAP ALI. Следователно, този метаболитен механизъм не може да бъде причина за резултатите от ALI от настоящото проучване, което показва тежък APAP-индуциран ALI при мишки в NC-S група.
NAPQI се детоксикира чрез чернодробна GSH. Въпреки това, прекомерното количество NAPQI не може да бъде детоксикирано, което води до увреждане на черния дроб, митохондриална дисфункция и некроза [4]. Trib3 нивото на иРНК значително се е увеличило при мишки от групата NC-S, което показва повишено изчерпване на GSH. Това може да се дължи на оксидативния стрес и множеството молекули, участващи в отговора на оксидативен стрес [22].
NRF2, транскрипционен фактор, оказва защитни ефекти срещу хепатотоксичност, индуцирана от различни агенти [23]. Нещо повече, нейното активиране е свързано с производството на GSH [24]. При нормални условия NRF2 остава свързан с KEAP1 в цитозола. Въпреки това, в присъствието на оксидативен стрес, NRF2 се отделя от KEAP1 и навлиза в ядрото, за да регулира транскрипцията на гени, съдържащи антиоксидантен елемент на отговор в техните промоторни области [25]. NRF2 регулира гени, включително Gclc, Gclm, Хо-1, Gstm1, Gpx2, и Nqo-1. Настоящото проучване показа, че нивата на иРНК на Gpx2 и Gstm1 са били значително по-високи при мишки в групата на FF-A, отколкото при мишки в групата на NC-A (RR = 1,90 и 1,51, съответно), което показва, че активирането на NRF2 защитава мишки в групата на FF-A от индуцирана от APAP хепатотоксичност. Известно е, че няколко молекули като p62 и PPAR-γ активират NRF2 [24,25,26,27].
Експресията на PPAR-γ, който оказва противовъзпалително действие [28, 29], се увеличава при мишки, хранени с FF диета. Този резултат е в съответствие с резултатите от предишни проучвания, които показват лека експресия на PPAR-y в нормалния черен дроб, но повишена експресия на PPAR-y в черния дроб на пациенти със затлъстяване или пациенти с NAFLD [30, 31]. Няколко проучвания показват, че PPAR-γ активирането облекчава индуцирания от APAP ALI [32, 33]. Тези защитни ефекти на PPAR-γ активиране срещу APAP-индуциран ALI са свързани с повишаването на антиоксидантните ензими като GPx и GST, което е в съответствие с нашите резултати от нивата на иРНК. В допълнение, тези наблюдения също се обясняват с промените в нивата на експресия на чернодробния никотинамид аденин динуклеотид фосфат оксидаза, ERK и NF-кВ. В настоящото проучване ние също така открихме ниски нива на p-ERK, NF-κB, p-MKK4 и p-JNK при мишки от групата на FF-A, които показаха високо ниво на PPAR-γ в отговор на APAP-индуциран окислител стрес. Противовъзпалителният ефект на PPAR-γ може да се отдаде и на регулирането на IFN-y, тъй като PPAR-y инхибира активираното от c-Jun активиране на IFN-γ промотора [34, 35]. IFN-γ играе основна роля в имунния отговор при APAP-индуциран ALI [36, 37]. Тези открития показват, че PPAR-γ намалява имунния отговор при мишки в групата на FF-A.
Нивото на mRNA на гена, кодиращ циклин D1, който насърчава прогресията на клетъчния цикъл на фаза G1-S, се увеличава при мишки в групите FF-S и FF-A. Освен това, нивото на mRNA на гена, кодиращ p21, мощен инхибитор на циклин-зависима киназа (CDK), е по-ниско при мишки в групата на FF-A, отколкото при мишки в групата на NC-A. Свръхекспресията на P21 инхибира CDK2 активността, като по този начин насърчава навлизането на клетките в G0/фаза на покой в клетъчния цикъл [38]. Следователно, повишен циклин D1 и намалена експресия на p21 в групата на FF-A може да увеличи пролиферацията на хепатоцитите, което може да облекчи индуцирания от APAP ALI чрез увеличаване на възстановителния капацитет на черния дроб [24].
В обобщение, свръхекспресията на PPAR-γ по време на оксидативен стрес, свързан с APAP-индуциран ALI, има противовъзпалителни ефекти, активира противовъзпалителни молекули като NRF2 и инхибира противовъзпалителни молекули като NF-κB и IFN-γ при мишки с NAFLD . Парадоксално, индуцираният от APAP тежък оксидативен стрес заедно с свързаното с NAFLD провъзпалително състояние агресивно активират антиоксидантни каскади като PPAR-γ и NRF2, които облекчават увреждането на черния дроб. Тези ефекти намаляват APAP-индуцираното чернодробно увреждане при мишки с NAFLD. Освен това, активирането на клетъчната пролиферация може да помогне за бързото облекчаване на ALI.
Настоящото проучване обаче има някои ограничения. Първо, изследвахме проявите на APAP-индуциран ALI само в определен момент от време. Следователно не бихме могли да определим зависимите от времето промени в нивата на гореспоменатите молекули. Въпреки това, няколко проучвания [42, 43] показват, че промените в нивата на някои молекули се максимизират на 6 часа след инжектирането на APAP, което е в съответствие с ранния ефект на NAFLD срещу APAP-индуциран ALI. Второ, не можахме да определим нивата на метаболитите на APAP поради ограничената наличност на съоръжения. Тъй като точните нива на APAP глюкуронид, APAP сулфат и NAPQI не могат да бъдат определени, индуцираните от NAFLD промени в индуцирания от APAP ALI са индиректно оценени чрез определяне на нивата на ензимите, участващи във всяка стъпка от метаболизма на APAP.
Въпреки тези ограничения, настоящото проучване е първото, което използва модел на NAFLD, индуциран от FF, който имитира патогенезата на човешки NAFLD, в проучвания, свързани с APAP. Освен това, това проучване се опитва да идентифицира молекули, свързани с метаболитния път на APAP, както и провоспалителния и антиоксидантния път.
Заключения
Резултатите от настоящото проучване предполагат, че индуцираната от FF диета NAFLD упражнява ранни инхибиторни ефекти върху APAP-индуцираната ALI. Механизмът е включен от няколко антиоксидантни молекули като PPAR-γ и NRF2 в отговор на тежък оксидативен стрес. Необходими са обаче допълнителни проучвания, за да се провери дали NAFLD оказва сходни ефекти върху по-продължителната продължителност и други видове ALI.
- Ефективност на въглехидратната диета за лечение на безалкохолна мастна чернодробна болест при
- Стомашно-чревни усложнения на затлъстяването Безалкохолна мастна чернодробна болест (NAFLD) и нейните
- Приключване на по-доброто лечение на безалкохолната мастна чернодробна болест
- Екстрактът от зелен чай (заедно с упражненията) може да помогне за борба с мастните чернодробни заболявания - Проучване - NDTV Food
- Ефект от консумацията на алкохол върху неалкохолната мастна чернодробна болест - Weng - Translational