Малте Х. Вехмайер
a I. Катедра по медицина, Университетски медицински център Хамбург-Епендорф, Хамбург, Германия
Birgit-Christiane Zyriax
b Превантивна медицина, Катедра по обща и интервенционна кардиология, Университетски център за сърце на Хамбург, Хамбург, Германия.
Бетина Ягеман
a I. Катедра по медицина, Университетски медицински център Хамбург-Епендорф, Хамбург, Германия
Евгения Рот
a I. Катедра по медицина, Университетски медицински център Хамбург-Епендорф, Хамбург, Германия
Еберхард Уиндлър
b Превантивна медицина, Катедра по обща и интервенционна кардиология, Университетски център за сърце на Хамбург, Хамбург, Германия.
Julian Schulze zur Wiesch
a I. Катедра по медицина, Университетски медицински център Хамбург-Епендорф, Хамбург, Германия
Ansgar W. Lohse
a I. Катедра по медицина, Университетски медицински център Хамбург-Епендорф, Хамбург, Германия
Йоханес Клуве
a I. Катедра по медицина, Университетски медицински център Хамбург-Епендорф, Хамбург, Германия
Свързани данни
Резюме
Ние имахме за цел да оценим диетичните модели, свързани с неалкохолната мастна чернодробна болест (NAFLD) и ефикасността на диетичните интервенции в реална обстановка в третичен медицински център в Северна Германия.
Клиничните и лабораторни данни, както и данните, получени чрез полуколичествен въпросник за честотата на храната от 55 последователни пациенти с диагноза NAFLD, са сравнени с възрастова и полово съвпаднала кохорта от 88 здрави индивида чрез еднофамилен анализ. Ефективността на диетичната интервенция е оценена в подгрупа от 24 пациенти с NAFLD 6 месеца след получаване на диетични съвети. Макронутриционните компоненти на диетата бяха нормализирани за абсолютен дневен енергиен прием.
Пациентите с NAFLD консумират повече калории на ден в сравнение със здравите контроли (P Ключови думи: етиология, NAFLD, NASH, риск, терапия
1. Въведение
Основната цел на нашето проучване беше да се тества хипотезата, че пациентите с NAFLD консумират диета с отличителен, специфичен за заболяването хранителен състав в сравнение със здрави субекти. В подгрупа от пациенти анализирахме дали диетичното консултиране води до промяна на хранителния състав и дали това е свързано с намаляване на теглото и подобряване на чернодробните функционални тестове.
2. Пациенти и методи
2.1. Проучвайте популация
В нашето проучване бяха включени всички пациенти, наблюдавани за предполагаема NAFLD в хепатологичната амбулатория на Медицинския център на Хамбургския университет, които са получили диетични консултации от януари 2012 г. до януари 2014 г. (N = 61). NAFLD се дефинира като: повишени нива на аланин трансаминаза (ALT; горна граница на нормата, ULN: 50 U/L за мъже, 35 U/L за жени), чернодробна стеатоза при ултразвуково изследване и изключване на съпътстващи чернодробни заболявания (подробности за изключване на съпътстващи чернодробни заболявания може да се намери в допълнителния материал) или прекомерна консумация на алкохол (> 40 g/ден за мъже и> 20 g/ден за жени).
За контрола бяха получени анонимни данни за здрава контролна група, съобразена с пола и възрастта, от германската кохорта от напречното сечение „Проучване на стреса, атеросклерозата и ЕКГ“ (СТРАТЕГИЯ), която вече е наела здрави мъже и жени. [16] Шест пациенти с NAFLD на възраст под 25 години бяха изключени преди анализа поради недостатъчен брой сравними млади контроли от проучването STRATEGY. Общо 55 пациенти с NAFLD и 88 контроли са включени в окончателния анализ.
2.2. Хранителна, клинична, лабораторна и техническа оценка на изследваната популация
Всички пациенти с NAFLD получиха задълбочен клиничен преглед, рутинни лабораторни изследвания, ултразвуково изследване на горната част на корема, преходна еластография на черния дроб (Fibroscan; Echosense, Париж, Франция) и анализ на биоелектричен импеданс (BIA; BIA 101 Anniversary; SMT medical, Вюрцбург, Германия) преди получаване на задълбочени диетични консултации. [17,18] Фиброзата е класифицирана според Kleiner от F0 до F4 [19] и резултатите от преходната еластография са разпределени по степени на фиброза, както се предлага от Wong et al. [20] Следователно, F2 фиброза се предполага при пациенти със 7,0 до 8,6 kPa, F3 при пациенти с 8,7 до 10,2 kPa и F4 фиброза при пациенти с ≥10,3 kPa. Всички пациенти са попълнили валидиран полуколичествен въпросник за честотата на храните (FFQ), използван в проучването „European Prospective Investigation on Cancer“ (EPIC). [21] Данните, получени от FFQ, бяха потвърдени от диетолог. Подробности за диетичното консултиране и валидиране на FFQ можете да намерите в допълнителния материал. Поведението на начина на живот на всички пациенти с NAFLD се оценява по заседнал начин на живот, слабо активен начин на живот или активен начин на живот според Министерството на здравеопазването и хуманитарните услуги на САЩ и Министерството на земеделието на САЩ. [22]
2.3. Статистически анализ
Хранителни, клинични, антропометрични, лабораторни и BIA данни от пациентите с NAFLD са сравнени с тези на здрави контроли чрез едновариатен анализ. Категоричните променливи бяха анализирани чрез точен тест на Фишер, а непрекъснатите променливи чрез t тест (за променливи с предполагаемо разпределение на Гаус, например възраст) или U-тест на Mann-Whitney (за ненормално разпределени променливи). Хранителните данни, получени от FFQ, бяха нормализирани до 1000 kcal калориен прием. Статистическите анализи бяха проведени с помощта на SPSS версия 22 (IBM Corporation, New York, NY) и графиките бяха създадени с помощта на GraphPadPrism 4 (GraphPad Software Inc, La Jolla, CA). Изследването е одобрено от местната комисия по етика (Ethikkommission der Ärztekammer Hamburg, PV4357).
3. Резултати
3.1. Сравнение на клинични, лабораторни и хранителни данни между пациентите с NAFLD и контролите
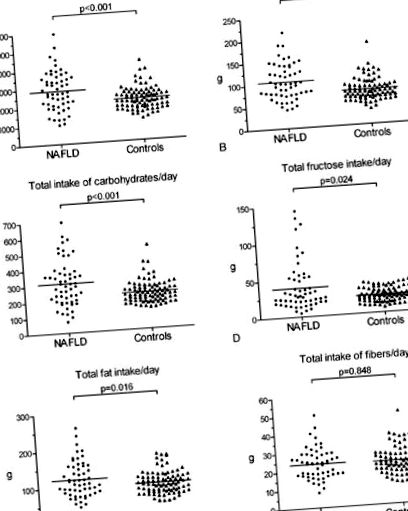
Подробности за 143 пациенти с NAFLD и контролите са представени в Таблица Таблица1. 1. Средното телесно тегло, индекс на телесна маса (BMI), обиколка на талията, мастна маса, нива на аланин аминотрансфераза (ALT), аспартат трансаминаза (AST) и гама-глутамил транспептидаза (γGT) са значително по-високи при пациентите с NAFLD в сравнение с контролите ( P Фиг. 1A, 1 A, допълнителна таблица 2). Средният общ прием на мазнини на ден е 109 g (46-260) в групата с NAFLD и 97 g (50-180) в контролната група (P = 0,016). Дневните количества консумирани въглехидрати и протеини в групата с NAFLD са съответно 293 g (68–697) и 100 g (41–216), в сравнение с 222 g (137–529) и 74 g (36–185) в контролата. група (P Фиг. 1, 1, Допълнителна таблица 2).
Диетични модели при пациенти с NAFLD и здрави контроли. Вертикалните ленти представляват медианата. NAFLD, неалкохолна мастна чернодробна болест.
3.2. Сравнение на състава на диетите на пациентите с NAFLD и контролите
В групата на NAFLD, в сравнение с контролната група, прием на фибри на 1000 kcal (8,6 (3,6–14,4) срещу 10,4 (6,9–15,2); P Фиг. 2E) 2 E) и минерални хранителни вещества на 1000 kcal (7,3 (4.2–10.7) срещу 7.7 (6.0–10.5); P Фиг. 2D) 2 D) е значително по-ниска. Въпреки това, пациентите с NAFLD са имали по-висок прием на протеин на 1000 kcal (36,1 (27,6-56,2) спрямо 34,8 (24,8-56,0); P = 0,009; Фиг. 2B) 2 B) и глюкоза на 1000 kcal в сравнение със здравите контроли (8,8 (2,9–41,1) срещу 7,7 (3,1–17,4); Р = 0,041; Таблица Таблица2). 2). Изненадващо не открихме значителна разлика в относителния прием на фруктоза на 1000 kcal между пациентите с NAFLD и здравите контроли (10,5 (2,9–37,4) срещу 10,3 (3,6–28,4); P = 0,353; Таблица Таблица2). 2). Пациентите и контролите с NALFD не се различават значително по отношение на приема на други диетични компоненти, когато се нормализират на енергиен прием; например въглехидрати на 1000 kcal (P = 0,359; Фиг. Фиг. 2A), 2 A), мазнини на 1000 kcal (P = 0,416; Фиг. Фиг. 2C), 2 C) и органични киселини (P = 0.104; Фиг. Фиг. 2F). 2 Е). Резултатите за други диетични компоненти са показани в Таблица Таблица2 2 .
Компоненти за макронутриционна диета при пациенти с NAFLD и контроли. Всяка точка представлява специфичния хранителен компонент, нормализиран до 1000 kcal на ден за всеки пациент. Вертикалните ленти представляват медианата. NAFLD, неалкохолна мастна чернодробна болест.
Таблица 2
(Макро-) хранителни компоненти, нормализирани към дневния енергиен прием (на 1000 kcal) при пациенти с NAFLD в сравнение със здрави контроли.
Установено е, че някои от пациентите и контролите с NAFLD имат отличителен хранителен режим с излишък от една или повече хранителни компоненти (фиг. (Фиг. 2). 2). По-подробно, 5 пациенти с NAFLD показват прекомерна консумация на въглехидрати над 140 g на 1000 kcal на ден, докато никой от контролната група не надвишава това ниво. За протеини е наблюдаван прием над 50 g на 1000 kcal на ден при 2 пациенти с NAFLD и при 1 здрав контрол, докато прекомерна консумация на мазнини (> 55 g/1000 kcal/ден) е установена при 5 пациенти с NAFLD и само 1 от контролите. От пациентите с NAFLD, установени с излишни нива на консумация на мазнини и протеини, само 1 попада в двете категории едновременно.
3.3. Оценка на ефикасността на диетичната интервенция при пациенти с NAFLD
Общо 24 пациенти (16 мъже и 8 жени, средна възраст 46,2 години, SD = 11,7) са завършили втори FFQ 6 месеца след първото диетично консултиране. Нито един от тези пациенти не е имал захарен диабет, 8 пациенти са имали хипертония и 20 пациенти са страдали от хиперлипопротеинемия. Диетичният състав на изходно ниво е както следва: 43% въглехидрати (диапазон 32% –62%), 42% мазнини (20% –53%) и 15% протеини (12% –21%).
Средното намаление на теглото е 3,4% (диапазон -2% до 11%; Фиг. Фиг. 3А) 3 А) от изходното телесно тегло на общата група, докато 9 пациенти (37,5%) постигат загуба на тегло ≥5 % и 2 пациенти (8,3%) са постигнали загуба на тегло ≥7%.
Средно телесно тегло и нива на аланин трансаминази преди и след диета консултиране. Двадесет и четири пациенти присъстваха на последващо посещение. Всеки ред представлява хода на 1 пациент.
Унивариантните анализи не разкриват статистически значими разлики между пациентите с NAFLD, които са постигнали загуба на тегло от поне 5% и пациентите със загуба на тегло Фиг. 4А) 4 А) и показват тенденция към по-ниска консумация на въглехидрати (медиана 104,3 g на 1000 kcal (77,8–151,8) срещу 99,2 g на 1000 kcal (73,9–119,3); P = 0,059; Фиг. Фиг. 4B) 4 B) в сравнение с изходната диета. Няма разлика в дневната консумация на протеини на 1000 kcal (медиана 36,8 g (28,8–50,4) спрямо 36,9 g (25,6–46,0); P = 0,862; Фиг. Фиг. 4C), 4 C), но значително по-висока консумация на фибри на 1000 kcal (медиана 9,2 g (4,6–14,4) спрямо 10,7 g (7,2–15,8); P = 0,002; фиг. Фиг. 4D) 4 D) и мазнини на 1000 kcal (медиана 44,6 g (21,1–57,0) срещу 47,2 g (36,5–58,8); P = 0,024; Фиг. Фиг. 4E) 4 E) бяха открити при проследяване. Важно е, че консумацията на глюкоза на 1000 kcal (медиана 8,7 g (3,9–41,1) спрямо 7,7 g (3,2–11,4); P = 0,341) и фруктоза на 1000 kcal (медиана 9,6 g (4,9–36,9) спрямо 10,1 g (3.9–16.3); P = 0.846) не се различава между изходното ниво и проследяването. Двамата пациенти с излишък от дневния прием на въглехидрати (151,8 g въглехидрати/1000kcal/ден) или протеини (50,4 g протеини/1000kcal/ден) успяха да постигнат по-балансирана диета при проследяване (Фиг. (Фиг. 4B 4 B и C). Диетичният състав след 6 месеца е както следва: 41% въглехидрати (диапазон 30% -49%), 44% мазнини (34% -55%) и 15% протеини (10% -19% ).
Общо усвояване на енергия и диетични модели преди и след диетично консултиране. Двадесет и четири пациенти присъстваха на последващо посещение. Хранителните компоненти бяха нормализирани до 1000 kcal на ден за всеки пациент. Всеки ред представлява хода на 1 пациент.
Нивата на ALT при проследяване са значително по-ниски в сравнение с изходните стойности (медиана 75 U/L (36–263) спрямо 45,5 U/L (24–237); P Фиг. 3B) 3 B) и нормализация на ALT е постигнато от 9 от 16 пациенти от мъжки пол и 6 от 8 пациенти. Въпреки това, поради малкия брой пациенти, които бяха на разположение за проследяване, не открихме връзка между загуба на тегло или намаляване на специфични хранителни компоненти и подобрение на ALT (данните не са показани).
4. Дискусия
Специфичните диетични модели се считат за основна причина за развитието на NAFLD. По този начин, декодирането на „диета с риск от NAFLD“ може да доведе до по-фокусирано хранително консултиране и по този начин да засили ефекта от терапевтичните интервенции. Тук представяме изчерпателна диетична и клинична оценка на 55 пациенти с NAFLD в сравнение с добре описаната кохорта от здрави индивиди от публикуваното преди това проучване на STRATEGY. [16]
Докато погълнатите общи количества фибри са сравними между пациентите с NAFLD и контролите, пациентите с NAFLD всъщност показват значително по-ниска консумация на фибри на 1000 kcal в сравнение с контролите. Това е в съответствие с наблюдението, че средиземноморската диета, богата на фибри, може не само да предотврати диабет, сърдечно-съдови заболявания и затлъстяване, но и NAFLD. [14] С оглед на това и факта, че ниският прием на фибри може да допринесе за повишения риск от новообразувания на дебелото черво при пациенти с NAFLD [24,25], друга независима цел на диетичното консултиране може да бъде увеличаване на консумацията на фибри.
Интересното е, че докато само 9 от 24 пациенти са постигнали загуба на тегло ≥5% 6 месеца след диетичното консултиране, всички пациенти са показали подобрение на тестовете за чернодробна функция и 15 от 24 пациенти са имали нормални стойности на ALT при проследяване. По този начин, дори ако загубата на тегло от 7% до 10%, считана за необходима за хистологично подобряване на NASH [12,13], не е постигната на 6 месеца, пациентите получават значителна полза от диетичното консултиране. Очевидно подобряването на чернодробните функционални тестове предхожда значителна загуба на тегло и хистологично подобрение. [13] Въпреки това, поради малкия брой пациенти, не бяха идентифицирани предсказващи фактори за подобряване на чернодробните функционални тестове след диетични консултации в нашата кохорта „в реалния живот“. Нашите данни са в съответствие с по-ранно проучване, демонстриращо, че както диетата с ниско съдържание на въглехидрати, така и с липиди намаляват еднакво ефективно за намаляване на чернодробните мазнини. [26] Докато нашето наблюдателно проучване се фокусира върху динамиката на серумния АЛАТ като заместващ параметър за чернодробно некроинфламация, различни диетични интервенции трябва да бъдат оценени с помощта на хистологични крайни точки или по-напреднала оценка на тежестта на неинвазивната болест в бъдеще.
В заключение, пациентите с NAFLD имат значително по-висок дневен общ прием на калории, докато общият хранителен състав показва само умерени отклонения от здравите контроли. Бъдещите перспективни мултицентрови проучвания трябва да оценят дали диетичното консултиране може да се съсредоточи върху проста учебна цел („яжте по-малко“) за пациентите с НАЖБП, а не върху специфични промени в относителната консумация на хранителни вещества.
- Безалкохолната мастна чернодробна болест е свързана с прекомерен прием на калории, а не с
- Инфекцията с opisthorchis viverrini увеличава тежестта на безалкохолната мастна чернодробна болест при
- Роля на упражненията за смекчаване на грижите за диабет при детска безалкохолна мастна чернодробна болест
- Обръщане на хода на безалкохолната мастна чернодробна болест и риск от рак на черния дроб днес
- Безалкохолна мастна чернодробна болест