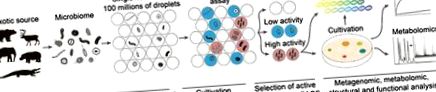
Тръбопровод за дълбоко функционално профилиране на микробиоми. Екзотична микробиота претърпява едноклетъчно капсулиране на капчици от биосъвместима микрофлуидна двойна емулсия със съответните флуорогенни репортери. Анализът, базиран на флуоресценция, позволява изследване на биологичната или биохимичната активност на капсулираните микроорганизми. Скринингът, базиран на FACS, класифицира микробиома въз основа на анализирания фенотип. Избраните субпопулации се анализират впоследствие чрез комбинация от технологии omics за подробна характеристика на техните фенотипове. NGS: Последователност от следващо поколение.
Избраният Bacillus pumilus ефективно произвежда Ami. Култивирането на произвеждащ Ami B. pumilus върху агар причинява появата на значителни зони на клирънс. Зоните на клирънс бяха наблюдавани с теста за наслагване на агар, използвайки щам репортер Staphylococcus aureus, продуциращ GFP във видима светлина (A) и чрез флуоресцентен анализ на GFP (B). Колониите около B. pumilus (в центъра) са представителни щамове, взети от оралния микробиом на кафява мечка, произволно. Данните илюстрират представителния изглед на три независими повторения. (C) Култивиране на B. pumilus в ограничени (сиви) или високи (аквамарин) условия на аерация. (D) Култивиране на B. pumilus при висока аерация в среда SYC (червено) и среда 2YT в същия обем (жълт) или в два пъти намален обем (оранжев). Концентрацията на Ami (точки) се изчислява чрез анализ на антибактериалната активност на хранителната среда в три екземпляра. Данните представляват средна стойност ± SD.
Оптимизирана процедура за пречистване на Ami. (A) Екстракция в твърда фаза (SPE) със смола на основата на полистирол LPS 500 (Technosorbent, Русия). Посочена е частта от Ami, елюирана от съответната стъпка на градиента. (B, C) Последователно пречистване на фракция, съдържаща Ami, като се използва колона C18 RP-HPLC. (D) Хроматограма на пречистената проба Ami. Добивът на Ami се изчислява чрез анализ на антибактериалната активност в три екземпляра. Данните представляват средна стойност ± SD.
Изчерпателен преглед на спектъра на активност на Ami. Филогенията на бактериите е представена със съответните средни минимални инхибиторни концентрации (MIC). Цветът и площта на маркерите на кръга показват средната стойност на MIC. Чувствителните, междинните и устойчивите бактерии са посочени в съответствие с цветната лента и маркирани като S, I и R, съответно. Филогенетичното дърво е реконструирано въз основа на 16S рРНК. Бактериите, анализирани единствено с помощта на основан на биоинформатика подход на дълбоко функционално профилиране и непотвърдени от стандартните анализи на култивиране, са оцветени в светло сиво.
Ami е особено нестабилен амид, който се разлага чрез вътремолекулна лактонизация във физиологични условия. (A) Обща схема, описваща последователната трансформация на биологично активни Ami (AmiA) в неактивни амикумацини AmiC и AmiB, съответно. (B) рН зависимост на разлагането на Ami. Представена е остатъчната част на Ami във времето. Цветът показва pH. (В) Представителен времеви ход на превръщането на AmiA в AmiC и AmiB, протичащ при pH 7,5. Представени са съответните проценти на AmiA, AmiC и AmiB в реакционните смеси. Амикумацините се анализират чрез HPLC (точки). Данните бяха апроксимирани чрез двустепенен модел на последователна реакция (линии). Концентрациите на амикумацини се анализират в три екземпляра. Данните представляват средна стойност ± SD. (D) рН зависимост на стъпката, ограничаваща скоростта на разлагане на Ami. Кинетичните константи на самопреобразуването на AmiA в AmiC са представени за рН 5-9. Данните представляват средна стойност ± SD.
Резюме
Тръбопровод за дълбоко функционално профилиране на микробиоми. Екзотична микробиота претърпява едноклетъчно капсулиране на капчици от биосъвместима микрофлуидна двойна емулсия със съответните флуорогенни репортери. Анализът, базиран на флуоресценция, позволява изследване на биологичната или биохимичната активност на капсулираните микроорганизми. Скринингът, базиран на FACS, класифицира микробиома въз основа на анализирания фенотип. Избраните субпопулации се анализират впоследствие чрез комбинация от технологии omics за подробна характеристика на техните фенотипове. NGS: Последователност от следващо поколение.
Избраният Bacillus pumilus ефективно произвежда Ami. Култивирането на произвеждащ Ami B. pumilus върху агар причинява появата на значителни зони на клирънс. Зоните на клирънс бяха наблюдавани с теста за наслагване на агар, използвайки щам репортер Staphylococcus aureus, продуциращ GFP във видима светлина (A) и чрез флуоресцентен анализ на GFP (B). Колониите около B. pumilus (в центъра) са представителните щамове, взети от оралния микробиом на кафява мечка, произволно. Данните илюстрират представителния изглед на три независими повторения. (C) Култивиране на B. pumilus в ограничени (сиви) или високи (аквамарин) условия на аерация. (D) Култивиране на B. pumilus при висока аерация в среда SYC (червено) и среда 2YT в същия обем (жълт) или в два пъти намален обем (оранжев). Концентрацията на Ami (точки) се изчислява чрез анализ на антибактериалната активност на хранителната среда в три екземпляра. Данните представляват средна стойност ± SD.
Оптимизирана процедура за пречистване на Ami. (A) Екстракция в твърда фаза (SPE) със смола на основата на полистирол LPS 500 (Technosorbent, Русия). Посочена е частта от Ami, елюирана от съответната стъпка на градиента. (B, C) Последователно пречистване на фракция, съдържаща Ami, като се използва колона C18 RP-HPLC. (D) Хроматограма на пречистената проба Ami. Добивът на Ami се изчислява чрез анализ на антибактериалната активност в три екземпляра. Данните представляват средна стойност ± SD.
Изчерпателен преглед на спектъра на активност на Ami. Филогенията на бактериите е представена със съответните средни минимални инхибиторни концентрации (MIC). Цветът и площта на маркерите на кръга показват средната стойност на MIC. Чувствителните, междинните и устойчивите бактерии са посочени в съответствие с цветната лента и маркирани като S, I и R, съответно. Филогенетичното дърво е реконструирано въз основа на 16S рРНК. Бактериите, анализирани единствено с помощта на основан на биоинформатика подход на дълбоко функционално профилиране и непотвърдени от стандартните анализи на култивиране, са оцветени в светло сиво.
Ami е особено нестабилен амид, който се разлага чрез вътремолекулна лактонизация във физиологични условия. (A) Обща схема, описваща последователната трансформация на биологично активни Ami (AmiA) в неактивни амикумацини AmiC и AmiB, съответно. (B) рН зависимост на разлагането на Ami. Представена е остатъчната част на Ami във времето. Цветът показва pH. (В) Представителен времеви ход на превръщането на AmiA в AmiC и AmiB, протичащ при pH 7,5. Представени са съответните проценти на AmiA, AmiC и AmiB в реакционните смеси. Амикумацините се анализират чрез HPLC (точки). Данните бяха апроксимирани чрез двустепенен последователен модел на реакция (линии). Концентрациите на амикумацини се анализират в три екземпляра. Данните представляват средна стойност ± SD. (D) рН зависимост на стъпката, ограничаваща скоростта на разлагане на Ami. Кинетичните константи на самопреобразуването на AmiA в AmiC са представени за рН 5-9. Данните представляват средна стойност ± SD.
- Приложни науки Безплатни пълнотекстови ефекти на диетични фибри от просо и брашно от просо върху тесто
- Безплатна пълнотекстова РНК секвениране на базата на биомедицини, идентифициране на Ganglioside GD2-позитивен рак
- Безплатно пълнотекстово изследване на животни за изразяването на имунитетни гени и бактериални профили в
- Безплатни пълнотекстови резонансни съдове в руските църкви и тяхното изучаване в концертна зала HTML
- Безплатни пълнотекстови ефекти на рака Ефектите на затлъстяването върху противораковия имунитет и имунотерапията на рака HTML