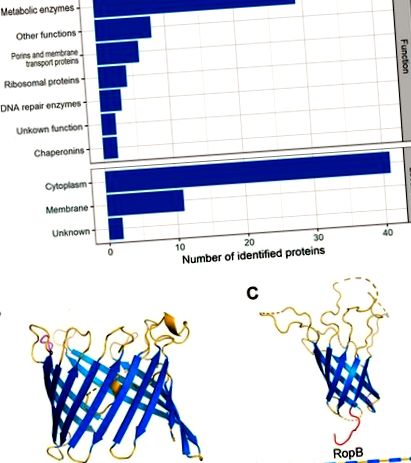
Устойчиви на почистващи препарати фракции на Rhizobium leguminosarum и протеини, които ги съдържат. (A) Функции и местоположение на протеините, съдържащи фракции, устойчиви на детергент, базирани на данни на UniProt (https://www.uniprot.org/). (B, C) Структури на RopA и RopB протеини, съответно, прогнозирани със сървъра I-TASSER [56]. Вторичните структури на RopA и RopB са представени по-долу с ленти. Сините ленти означават бета-листове, жълтите означават контури, а червените и лилавите ленти означават съответно N-терминала и C-терминала.
RopA и RopB образуват морфологично и структурно различни агрегати при различни условия. (A) TEM изображения на RopA (горни панели) и RopB (долни панели) агрегати, получени при различни условия: използване на органичен разтворител 1,1,1,3,3,3-хексафлуоро-2-пропанол (HFIP) без ( ляв панел) и със (средни панели) „засяване“ и използване на буфер с киселинно рН 2,0 (десен панел). Мащабната лента на изображенията с електронна микроскопия е равна на 1 μm. (B) релеево разсейване на светлината (RLS), (C) мътност, (D) флуоресцентна анизотропия и (E) кръгов дихроизъм (CD) на амилоиди. (F) Съдържание на елементи от вторичната структура в агрегати: бета-листове (бета), неподредена структура (unrd), завои (завой) и алфа-спирали (алфа). Цветовете на спектрите и лентите на панелите (B - F) означават характеристиките на RopA агрегатите, приготвени при pH 2.0 (тъмносин цвят) или с използване на HFIP без „засяване“ (синьо) и RopB агрегатите, приготвени при pH 2.0 (тъмночервен цвят ) и използване на HFIP без „засяване“ (оранжево).
RopA и RopB агрегати, свързващи се с амилоидно специфична сонда тиофлавин Т (ThT). (А) Конфокална микроскопия на приготвени с използване на HFIP агрегати, оцветени с ThT. Представени са флуоресцентни изображения на оцветените с ThT структури на агрегати (леви панели), предавани светлинни изображения, показващи наличието на агрегати в изследваните области на пробата (средни панели) и наслагване на изображенията (десни панели). Мащабната лента на изображенията е равна на 20 μm. Нормализирано до единица при максимално (B) поглъщане, (C) флуоресцентно възбуждане, (D) емисионни спектри и (E) криви на разпадане на флуоресценцията на ThT, свързани с амилоидни фибрили. Вложките на съответните панели показват максималните стойности на абсорбционното и флуоресцентно възбуждане и стойностите на квантовия добив на флуоресценция и живота на свързаното с фибрилите багрило. Декодирането на използваните цветове е показано на фигурата.
Амилоидни свойства на фибрилите RopA и RopB, образувани in vitro. (A) TEM изображения на получените in vitro агрегати и фибрили RopA и RopB, приготвени или в HFIP, или в киселинни условия (pH 2.0). Скалата е равна на 200 nm. (Б) Поляризирана светлинна микроскопия на оцветени с конго червено (CR) проби RopA и RopB, приготвени или в HFIP, или в киселинни условия (рН 2,0). TL - пропусната светлина, PL - поляризирана светлина. Скалата е равна на 20 μm. (C) Резистентност към детергент и протеаза на агрегатите и фибрилите RopA и RopB, открити от Western blot. Начална точка - протеини, разтворени във фосфатно буфериран физиологичен разтвор (PBS); HFIP и pH 2.0 - протеинови агрегати бяха получени в съответните буфери. U - некипявани проби, третирани с 2% студен SDS; B — варено с 2% SDS; Т - лекува се с трипсин; P - обработен с пепсин; Р - полимери; М - мономери. Посочени са съответните молекулни тегла (kDA).
Анализ на амилоидните свойства на RopA и RopB в клетките на Escherichia coli и Saccharomyces cerevisiae. (A - D) RopA и RopB извънклетъчна секреция в E. coli curli-зависими амилоидни генераторни системи (C-DAG). (А) Бактериални колонии върху средата, съдържаща CR. (B) CR-оцветени бактериални клетки в пропусната и (C) поляризирана светлина. Скалата е равна на 20 μm. Клетките на E. coli, секретиращи Sup35NM (амилоид) и Sup35M (разтворим) протеинови фрагменти се използват съответно като положителни и отрицателни контроли. (D) TEM изображения на E. coli, изнасящи целеви протеини. Показани са различни увеличения. (E) Анализ на агрегацията на RopA и RopB протеини, слети с жълт флуоресцентен протеин (YFP) в клетките на дрожди S. cerevisiae; TL - пропусната светлина, FL - флуоресцентна светлина. Протеинът YFP се използва като отрицателна контрола. Скалата е равна на 5 μm.
Амилоидни свойства на RopA и RopB в клетките на R. leguminosarum. (A, B) Откриване на устойчиво на детергент RopA и RopB образуване на агрегат в R. leguminosarum чрез електрофореза с натриев додецил сулфат-полиакриламиден гел (SDS – PAGE) (A) и полуденатурираща електрофореза с агарозен гел (SDD – AGE) (Б). U - неварирани проби, третирани със студена 2% SDS; В - пробите се варят в буфера, съдържащ 2% SDS; L-клетките се отглеждат в присъствието на 10 тМ лутеолин, R-контрол, рекомбинантни мономерни протеини RopA или RopB, съответно. Посочени са съответните молекулни тегла (kDA). (C) Микроскопия на пропусната светлина (TL) и поляризирана светлина (PL) на клетките на R. leguminosarum, инкубирани в продължение на седем дни върху TY плаки. (D - G) TEM изображение на клетки R. leguminosarum и извънклетъчен материал, белязан или с анти-RopA (D, F), или с анти-RopB (E, G) антитела, визуализирани от конюгирани със злато вторични антитела. Мащабните ленти са показани на изображения.
Резюме
Устойчиви на почистващи препарати фракции на Rhizobium leguminosarum и протеини, които ги съдържат. (A) Функции и местоположение на протеините, съдържащи фракции, устойчиви на детергент, базирани на данни на UniProt (https://www.uniprot.org/). (B, C) Структури на RopA и RopB протеини, съответно, прогнозирани със сървъра I-TASSER [56]. Вторичните структури на RopA и RopB са представени по-долу с ленти. Сините ленти означават бета-листове, жълтите означават контури, а червените и лилавите ленти означават съответно N-терминала и C-терминала.
RopA и RopB образуват морфологично и структурно различни агрегати при различни условия. (A) ТЕМ изображения на RopA (горни панели) и RopB (долни панели) агрегати, получени при различни условия: използване на органичен разтворител 1,1,1,3,3,3-хексафлуоро-2-пропанол (HFIP) без ( ляв панел) и със (средни панели) „засяване“ и използване на буфер с киселинно рН 2,0 (десен панел). Мащабната лента на изображенията с електронна микроскопия е равна на 1 μm. (B) релеево разсейване на светлината (RLS), (C) мътност, (D) флуоресцентна анизотропия и (E) кръгов дихроизъм (CD) на амилоиди. (F) Съдържание на елементи от вторичната структура в агрегати: бета-листове (бета), неподредена структура (unrd), завои (завой) и алфа-спирали (алфа). Цветовете на спектрите и лентите на панелите (B - F) означават характеристиките на RopA агрегатите, приготвени при pH 2.0 (тъмносин цвят) или с използване на HFIP без „засяване“ (синьо) и RopB агрегатите, приготвени при pH 2.0 (тъмночервен цвят ) и използване на HFIP без „засяване“ (оранжево).
RopA и RopB агрегати, свързващи се с амилоидно специфична сонда тиофлавин Т (ThT). (А) Конфокална микроскопия на приготвени с използване на HFIP агрегати, оцветени с ThT. Представени са флуоресцентни изображения на оцветените с ThT структури на агрегати (леви панели), предавани светлинни изображения, показващи наличието на агрегати в изследваните области на пробата (средни панели) и наслагване на изображенията (десни панели). Мащабната лента на изображенията е равна на 20 μm. Нормализира се до единица при максимално (B) поглъщане, (C) флуоресцентно възбуждане, (D) емисионни спектри и (E) криви на разпадане на флуоресценцията на ThT, свързани с амилоидни фибрили. Вложките на съответните панели показват максималните стойности на абсорбционното и флуоресцентно възбуждане и стойностите на квантовия добив на флуоресценция и живота на свързаното с фибрилите багрило. Декодирането на използваните цветове е показано на фигурата.
Амилоидни свойства на фибрилите RopA и RopB, образувани in vitro. (A) TEM изображения на получените in vitro агрегати и фибрили RopA и RopB, приготвени или в HFIP, или в киселинни условия (pH 2.0). Скалата е равна на 200 nm. (Б) Поляризирана светлинна микроскопия на оцветени с конго червено (CR) проби RopA и RopB, приготвени или в HFIP, или в киселинни условия (рН 2,0). TL - пропусната светлина, PL - поляризирана светлина. Скалата е равна на 20 μm. (C) Резистентност към детергент и протеаза на агрегатите и фибрилите RopA и RopB, открити от Western blot. Начална точка - протеини, разтворени във фосфатно буфериран физиологичен разтвор (PBS); HFIP и pH 2.0 - протеинови агрегати бяха получени в съответните буфери. U - некипявани проби, третирани с 2% студен SDS; B — варено с 2% SDS; Т - лекува се с трипсин; P - обработен с пепсин; Р - полимери; М - мономери. Посочени са съответните молекулни тегла (kDA).
Анализ на амилоидните свойства на RopA и RopB в клетките на Escherichia coli и Saccharomyces cerevisiae. (A - D) RopA и RopB извънклетъчна секреция в E. coli curli-зависими амилоидни генераторни системи (C-DAG). (А) Бактериални колонии върху средата, съдържаща CR. (B) CR-оцветени бактериални клетки в пропусната и (C) поляризирана светлина. Скалата е равна на 20 μm. Клетките на E. coli, секретиращи Sup35NM (амилоид) и Sup35M (разтворим) протеинови фрагменти се използват съответно като положителни и отрицателни контроли. (D) TEM изображения на E. coli, изнасящи целеви протеини. Показани са различни увеличения. (E) Анализ на агрегацията на RopA и RopB протеини, слети с жълт флуоресцентен протеин (YFP) в клетките на дрожди S. cerevisiae; TL - пропусната светлина, FL - флуоресцентна светлина. Протеинът YFP се използва като отрицателна контрола. Скалата е равна на 5 μm.
Амилоидни свойства на RopA и RopB в клетките на R. leguminosarum. (A, B) Откриване на устойчиво на детергент RopA и RopB образуване на агрегат в R. leguminosarum чрез електрофореза с натриев додецил сулфат-полиакриламиден гел (SDS – PAGE) (A) и полуденатурираща електрофореза с агарозен гел (SDD – AGE) (Б). U - неварирани проби, третирани със студена 2% SDS; В - пробите се варят в буфера, съдържащ 2% SDS; L-клетките се отглеждат в присъствието на 10 тМ лутеолин, R-контрол, рекомбинантни мономерни протеини RopA или RopB, съответно. Посочени са съответните молекулни тегла (kDA). (C) Микроскопия на пропусната светлина (TL) и поляризирана светлина (PL) на клетките на R. leguminosarum, инкубирани в продължение на седем дни върху TY плаки. (D - G) TEM изображение на клетки R. leguminosarum и извънклетъчен материал, белязан или с анти-RopA (D, F), или с анти-RopB (E, G) антитела, визуализирани от конюгирани със злато вторични антитела. Мащабните ленти са показани на изображения.
- Биомолекули Безплатен пълнотекстов диетичен нитрат от сок от цвекло за хипертония Систематичен преглед
- Безплатен пълнотекстов намален местен отговор на кортикостероиди при еозинофилни хронични биомолекули
- Пълнотекстов майчински произход и разнообразие от хаплотип на седем руски кози популации
- Раково безплатно комбинирано пълнотекстово инхибиране на епигенетичните четци и започване на транскрипция
- Безплатни пълноценни хранителни предпочитания за животни при котки Ефект от диетичния състав и присъщи