Нашите редактори ще прегледат подаденото от вас и ще определят дали да преразгледат статията.
- Центрове за контрол и профилактика на заболяванията - Бром
- Хиперфизика - Бром
- Chemicool - бром
- Вебелементи - бром
- Лаборатория Jefferson - Бром
- Национална лаборатория в Лос Аламос - Бром
- Кралско общество по химия - бром
- Rader's Chem4Kids.com - Бром
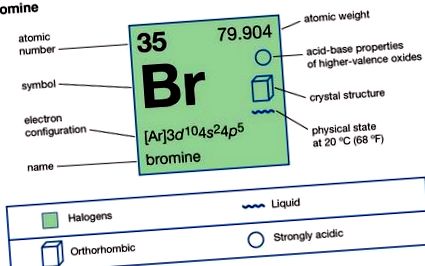
Бром (Br), химичен елемент, наситено червена вредна течност и член на халогенните елементи, или група 17 (група VIIa) от периодичната таблица.
| 35 |
| [79.901, 79.907] |
| -7,2 ° C (19 ° F) |
| 59 ° C (138 ° F) |
| 3,12 при 20 ° C (68 ° F) |
| -1, +1, +3, +5, +7 |
| (Ar) 3d 10 4s 2 4p 5 |
История
Бромът е открит през 1826 г. от френския химик Антоан-Жером Балард в остатъците (битерните) от производството на морска сол в Монпелие. Той освободи елемента, като прокара хлор през воден разтвор на остатъците, който съдържа магнезиев бромид. При дестилацията на материала с манганов диоксид и сярна киселина се получават червени пари, които се кондензират до тъмна течност. Сходството на тази процедура с тази за получаване на хлор предполага на Балард, че е получил нов елемент, подобен на хлора. (Изглежда, че германският химик Юстус фон Либиг е получил елемента преди Балард, но погрешно го е сметнал за йоден хлорид.) Поради лошата миризма на елемента, Френската академия на науките предлага името бром от гръцката дума bromos, което означава „лоша миризма“ или „воня“.
Възникване и разпространение
Рядък елемент, бромът се намира в природата, разпръснат в земната кора само в съединения като разтворими и неразтворими бромиди. Известно обогатяване се случва в океанска вода (65 тегл. Части на милион), в Мъртво море (приблизително 5 грама на литър [0,7 унция на галон]), в някои термални извори и в редки неразтворими минерали от сребърен бромид (като бромирит, намерени в Мексико и Чили). Основните източници на бром и неговите съединения са природните солени отлагания и саламура. Йордания, Израел, Китай и САЩ водят света в производството на бром в началото на 21 век; други важни страни производителки на бром през този период включват Япония, Украйна и Индия.
Естественият бром е смес от два стабилни изотопа: бром-79 (50,54%) и бром-81 (49,46%). От 17-те известни радиоактивни изотопи на елемента, бром-77 има най-дългия полуживот (57 часа).
Физични и химични свойства
Свободният бром е червеникавокафява течност със значително парно налягане при стайна температура. Бромните пари са кехлибарени на цвят. Бромът има остра миризма и дразни кожата, очите и дихателната система. Излагането на концентрирани бромисти пари, дори за кратко време, може да бъде фатално. Подобно на другите халогени, бромът съществува като двуатомни молекули във всички агрегационни състояния.
Около 3,41 грама (0,12 унция) бром се разтварят в 100 милилитра (0,1 литра) вода със стайна температура. Разтворът е известен като бромна вода. Подобно на хлорната вода, тя е добър окислител и е по-полезна, защото не се разлага толкова лесно. Той освобождава свободен йод от йодид-съдържащи разтвори и сяра от сероводород. Сярната киселина се окислява от бромова вода до сярна киселина. На слънчева светлина бромовата вода се разлага с отделяне на кислород, както е в следното уравнение:
От бромова вода може да се изолира хидрат (клатрат), който съдържа 172 водни молекули и 20 кухини, способни да приемат бромовите молекули. Бромът се разтваря във водни разтвори на алкален хидроксид, като дава бромиди, хипобромити или бромати, в зависимост от температурата. Бромът се извлича лесно от вода чрез органични разтворители като въглероден тетрахлорид, хлороформ или въглероден дисулфид, в които той е много разтворим. В органичните разтворители той дава портокалов разтвор.
Електронният афинитет на брома е висок и е подобен на този на хлора. Той обаче е по-малко мощен окислител, главно поради по-слабата хидратация на бромидния йон в сравнение с хлоридния йон. По същия начин връзката метал-бром е по-слаба от съответната връзка метал-хлор и тази разлика се отразява в химическата реактивност на брома, която се намира между тази на хлора и тази на йода. Органично бромо съединение прилича на съответното хлорно производно, но обикновено е по-плътно, по-малко летливо, по-малко запалимо и по-малко стабилно.
Бромът се комбинира бурно с алкалните метали и с фосфор, арсен, алуминий и антимон, но по-малко бурно с някои други метали. Бромът измества водорода от наситените въглеводороди и добавя към ненаситените въглеводороди, макар и не толкова лесно, колкото хлорът.
Най-стабилното окислително състояние на елемента е -1, при което бромът се среща естествено. Но степента на окисление на 0 (елементен бром, Br2), +1 (хипобромит, BrO -), +3 (бромит, BrO - 2), +5 (бромат, BrO - 3) и +7 (пербромат, BrO - 4 ) също са известни. Първата йонизационна енергия на брома е висока и съединенията, съдържащи бром в положителни окислителни числа, се стабилизират от подходящи лиганди, главно кислород и флуор. Всички съединения с окислителни числа +1, +3, +4, +5 и +7 съдържат ковалентни връзки.
Производство и употреба
Основният търговски източник на бром е океанската вода, от която елементът се извлича чрез химично изместване (окисляване) от хлор в присъствието на сярна киселина чрез реакцията
Продуктът на реакцията е разреден разтвор на бром, от който елементът се отстранява чрез издухване на въздух през него. След това свободният бром се смесва със серен диоксид и смесените газове се подават нагоре по кула, по която тече вода. В кулата протича следната реакция:
в резултат на което се получава смес от киселини, която е много по-богата на бромиден йон от морската вода. Второ третиране с хлор освобождава бром, който се освобождава от хлор и се пречиства чрез преминаване през влажни железни стружки.
Търговският бром обикновено съдържа до 0,3% хлор. Обикновено се съхранява в стъклени бутилки или в бъчви, покрити с олово или метал Монел.
Промишлената употреба на бром е била доминирана от съединението етилен бромид (C2H4Br2), което веднъж е добавено към бензин с тетраетил олово, за да се предотврати отлагането на олово в двигателя. След отказването от оловен бензин, бромовите съединения се използват главно в забавители на горенето, но етиленбромидът все още е важно съединение поради използването му за унищожаване на нематоди и други вредители в почвите. Бромът се използва и при производството на катализатори, като алуминиев бромид.
Бромът има и други приложения, като например при производството на различни багрила и съединенията тетраброметан (C2H2Br4) и бромоформ (CHBr3), които се използват като течности в измервателните уреди поради високото им специфично тегло. До развитието на барбитуратите в началото на 20-ти век, калиев бромид, натрий, калций, стронций, литий и амоний се използват широко в медицината поради тяхното седативно действие. Сребърният бромид (AgBr), важен компонент на фотографския филм, подобно на сребърен хлорид и йодид е чувствителен към светлина. За подобряване на печенето към пшеничното брашно се добавят следи от калиев бромат (KBrO3). Други значими бромови съединения включват водороден бромид (HBr), безцветен газ, използван като редуктор и катализатор в органични реакции. Разтворът на газа във вода се нарича бромоводородна киселина, силна киселина, която наподобява солна киселина по своята активност спрямо металите и техните оксиди и хидроксиди.
- Загуба на телесно тегло Използване на етерично масло от пачули и лечебни свойства
- 8 невероятни предимства; Употреба на органични факти от масло от пшенични зародиши
- Aamchur Powder (Raw Mango powder) Приготвяне, употреби, хранителни факти, калории, ползи за здравето, рискове
- Принцип на Архимед Описание и факти Британика
- Определение на самолета, типове, механика и факти Британика