Jeung Hee Lee
1 Департамент по храните и храненето, Национален университет Chungnam, Gung-dong, Yuseong-gu, Daejeon 305-764, Корея.
Чан Уук Син
1 Департамент по храните и храненето, Национален университет Chungnam, Gung-dong, Yuseong-gu, Daejeon 305-764, Корея.
Ми Йон Ким
1 Департамент по храните и храненето, Национален университет Chungnam, Gung-dong, Yuseong-gu, Daejeon 305-764, Корея.
Мин Хи Ким
1 Департамент по храните и храненето, Национален университет Chungnam, Gung-dong, Yuseong-gu, Daejeon 305-764, Корея.
Хай Ран Ким
1 Департамент по храните и храненето, Национален университет Chungnam, Gung-dong, Yuseong-gu, Daejeon 305-764, Корея.
Ън Шил Куак
1 Департамент по храните и храненето, Национален университет Chungnam, Gung-dong, Yuseong-gu, Daejeon 305-764, Корея.
Сена Ким
2 Отдел за здравословни и функционални храни, Катедра за корейски изследвания на храните за глобализация, Национална академия на земеделските науки, Администрация за развитие на селските райони, Сувон, Кюнгги 441-853, Корея.
Мий Рий Ким
1 Департамент по храните и храненето, Национален университет Chungnam, Gung-dong, Yuseong-gu, Daejeon 305-764, Корея.
Резюме
Въведение
Реактивните кислородни видове (ROS) са силно реактивни молекули поради наличието на несдвоени валентни електрони на черупката и реагират с всички класове биологични молекули, водещи до оксидативен стрес (Aviram, 2000; Parthasarathy et al., 1999; Stehbens, 1999). В човешкото и животинското тяло ROS могат да бъдат неутрализирани от антиоксидантни защитни системи, включително антиоксидантни ензими (Fang et al., 2002) и антиоксидантни съединения (Catapano et al., 2000; Duthie & Bellizzi, 1999). Въпреки това, прекомерното производство на ROS и изчерпаната антиоксидантна защита водят до оксидативен стрес и предизвикват оксидативно увреждане, причинявайки патологична дисфункция в организма (Urso & Clarkson, 2003). Освен това оксидативният стрес участва в патогенезата на хронични заболявания като невродегенеративно заболяване и коронарна болест на сърцето (ИБС) (Nishimura et al., 2000; Urso & Clarkson, 2003). Данните от кохортните проучвания подкрепят виждането, че достатъчният прием на плодове и зеленчуци е обратно свързан с риска от хронични заболявания (Dauchet et al., 2006; Dyun & Pivonka, 2000) и са предложени редица възможни механизми с антиоксидант хранителни вещества чрез намаляване на оксидативния стрес (Ames et al., 1995). Следователно много внимание е било съсредоточено върху естествените антиоксиданти в плодовете и зеленчуците (Ames et al., 1995).
Листата от червено цвекло (Beta vulgaris L.) са добър източник на естествени антиоксиданти като беталаини, флавоноиди, полифеноли, витамини и фолиева киселина. Общото съдържание на фенол в червеното цвекло е най-високото сред 23 изследвани зеленчука (Vinson et al., 1998). Беталаините включват бетацианини (червено-виолетови пигменти) и бетазантини (жълти пигменти). В листата на червеното цвекло ROS индуцира синтез на бетацианин, който може да действа като поглъщачи на ROS, ограничавайки щетите, причинени от бактериална инфекция и нараняване (Sepúlveda-Jiménez et al., 2004). Бетанинът, основният бетацианин, показва силни антиоксидантни ефекти при липидна пероксидация на мембраните и инхибиране на LDL окислението, при което скоростта на окисление е по-добра от тази на катехина (Kanner et al., 2001).
Повечето проучвания, които са оценили полезния ефект на червеното цвекло, са ограничени до корена. Листата от червено цвекло се консумират в салата с други зеленчуци по целия свят. В Корея обикновено се предлагат листни зеленчуци, включително листа от червено цвекло, за опаковане на варен ориз или месо и такава диета е популярна за меню, съдържащо месо. Добавянето на 8% листни зеленчукови прахове в атерогенна диета показва превенция на липидната пероксидация и увеличаване на антиоксидантната защитна система в плазмата и черния дроб на мишки (Lee et al., 2009). Малко обаче се знае за биохимичния ефект на листата от червено цвекло. Следователно, в настоящото проучване мишките C57BL/6J са хранени с високо съдържание на мазнини с високо съдържание на холестерол, допълнено с листа от червено цвекло (лиофилизирани, 8% от диетата) в продължение на 4 седмици и неговият защитен ефект срещу окислително увреждане е оценен от антиоксидантни биомаркери кръв и чернодробна тъкан.
Материали и методи
Материали
Листата от червено цвекло (Beta vulgaris L.) са получени от биологична ферма (Gongju, Корея) и лиофилизирани. Съдържанието на общите фенолни съединения и съдържанието на β-каротин в лиофилизирани листа от червено цвекло се определят по методите, описани от Teow et al. (2007). Съдържанието на бетанин и α-токоферол се анализира в съответствие с методите, описани от Sepúlveda-Jiménez et al. (2004) и Lee et al. (2006), съответно. Глутатион редуктаза (тип III от хлебни дрожди), редуциран глутатион, окислен глутатион, тетраметоксипропан, 5,5'-дитио-2-нитробензоена киселина (DTNB), NADP, NADPH, тиобарбитурова киселина (TBA) и говежди серумен албумин са закупени от Sigma -Aldrich Chemical Co. (Сейнт Луис, Мисури). Всички използвани реагенти са с аналитично качество.
Експерименти с животни
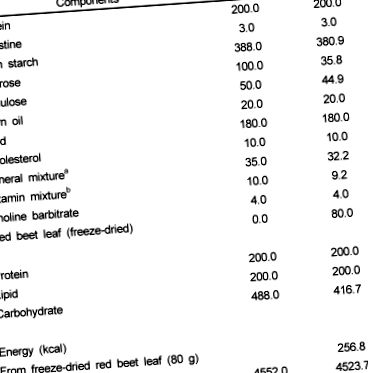
Мъжки мишки C57BL/6J (на възраст 6-8 седмици, Damul Science Co. Deajeon) с тегло 25-30 g бяха държани в поликарбонатни клетки (идентифицирани с метода на удар с уши) с контролирана температура (23 ± 3 ℃) и ниво на влажност (55 ± 10%) при 12 часа светлина: тъмен цикъл. Мишките бяха хранени с гранулирана търговска диета (Samyang Co., Сеул, Корея) през първата седмица. След аклиматизацията мишките бяха разделени на случаен принцип в две третирани групи от по 8 мишки всяка и им беше разрешен свободен достъп до вода и назначени диети за 4 седмици. Контролната диета съдържаше високо съдържание на мазнини (20% мазнини и 1% холестерол) и минерални и витаминни смеси AIN 93 (Таблица 1). Експерименталната диета (RBL) беше допълнена с 8% лиофилизирани листа от червено цвекло и нейният диетичен състав от нишесте, захароза, целулоза, минерална смес и витаминна смес беше коригиран да бъде изоенергичен с контролната диета (таблица 1). Химичният състав на листата от червено цвекло (в сухо вещество), използван в настоящото проучване, е представен в таблица 1 .
маса 1
Състав на експерименталните диети
минерална смес AIN 93 (g/kg): калциев карбонат 357,00, калиев фосфат (едноосновен) 196,00, калиев цитрат H2O 70,78, натриев хлорид 74,00, калиев сулфат 46,60, магнезиев оксид 24,00, железен цитрат, САЩ 6.06, цинков карбонат 1,65, манганов карбонат 0,63, меден карбонат 0,30, калиев йодат 0,01, натриев селенат 0,01025, амониев парамолибдат 4H2O 0,00795, натриев метасиликат 9H2O 1,45, хром калиев сулфат 12H2O 0,075, литиев 0,08 Никелов карбонат 0,0318, амониев ванадат 0,0066, захароза фино на прах 221,026
b AIN 93 Витаминна смес (g/kg): ниацин 3,00, калциев пантотенат 1,60, пиридоксин HCl 0,70, тиамин HCl 0,60, рибофлавин 0,60, фолиева киселина 0,20, биотин 0,02, витамин Е ацетат (500 IU/g) 15,00, витамин B12 ( 0,1%) 2,50, витамин А палмитат (500 000 IU/g) 0,80, витамин D3 (400 000 IU/g) 0,25, витамин K1/декстроза микс (10 mg/g) 7,50, захароза 967,23
c Състав на листа от червено цвекло (в сухо тегло): енергия 321 kcal/100 g, фибри 34,3%, β-каротин 69,27 mg/100 g, α-токоферол 5,17 mg/100 g, общо феноли 1,292 mg/100 g, бетанин 106,4 mg/100 g
Телесното тегло на мишките и приема на храна се измерват ежедневно и съотношението на ефективността на фуража (FER) се изчислява по време на експеримента. Фекалиите се събират 3 дни преди жертвоприношението. Експериментът с животни е проведен в съответствие с „Ръководство за грижи и употреба на лабораторни животни“ на Националните здравни институти (NIH, 1996). След 4 седмици мишките бяха на гладно в продължение на 12 часа и след това анестезирани по време на пост-абсорбционния период между 08.00 ч. И 10.00 ч. Избраните органи (т.е. сърце, бъбреци, мозък и черен дроб) бяха бързо отстранени и измити във физиологичен буфер, претеглени, и се съхраняват незабавно в течен азот за липидна пероксидация и антиоксидантни маркери. Мастните накладки (R, ретроперитонеални; M, мезентериални; E, епидидимни; I, ингвинални; S, далачни) също бяха събрани и претеглени. Кръвта се взима от кухата вена в хепаринови епруветки и се центрофугира при 2500 об/мин и 4 ℃ и плазмата се съхранява в течен азот за допълнителни анализи.
Плазмени и фекални липидни профили
Концентрацията на общия холестерол в плазмата, HDL-холестерола и триглицеридите се определят с помощта на автоматичен кръвен анализатор Hitachi 7020. Фекалните липиди се екстрахират, използвайки методите, описани от Folch et al. (1957) и техните концентрации на холестерол се определят с помощта на комплект, закупен от Yeongdong Pharmaceutical Co. (Сеул, Корея). Оптичната плътност беше измерена със спектрофотометър (Pharmacia Biotech, Cambridge, England).
Определяне на липидната пероксидация чрез реактивни вещества с 2-тиобарбитурова киселина (TBARS)
Черният дроб, сърцето и бъбреците се поставят върху лед и се хомогенизират с 50 mM натриев фосфатен буфер, като се използва тъканен хомогенизатор. Всеки 1 ml от тъканните хомогенати и плазмени проби се смесва с 8,1% натриев додецил сулфат (SDS, 1 ml), 20% оцетна киселина (2 ml) и 0,75% TBA (1 ml). Сместа се вари 30 минути и се центрофугира при 14 000 об/мин за 10 минути. Абсорбцията на образувания адукт на малондиалдехид (MDA) -TBA се измерва колориметрично при 533 nm със спектрофотометър (Bidlack & Tappel, 1973). Изготвя се стандартна крива с тетраметоксипропан и TBA и след това се изчисляват стойностите на MDA и се изразяват като стойности на TBARS.
Определяне на общото ниво на глутатион
Общото съдържание на глутатион (GSH) се определя ензимно по метода на Floreani et al. (1997) с лека модификация. Чернодробната тъкан (0,2 g) се пулверизира в охладен керамичен перкусионен двигател с 6% метафосфорна киселина и сместа се центрофугира (25 000 об/мин и 20 минути) при 4 ° С. Супернатантата (50 µL) се смесва със 100 mM фосфатен буфер (pH 7,4, 39 µL), съдържащ 5 mM етилендиаминтетраоцетна киселина (EDTA), 10 mM 5,5'-дитиобис- (2-нитробензоена киселина) (DTNB, 25 µL) и 5 mM NADPH (80 uL). След уравновесяване в продължение на 3 минути при 25 ° С, реакцията започва чрез добавяне на глутатион редуктаза (две единици). Образуването на DTNB се записва непрекъснато с ултравиолетов/видим (UV/VIS) спектрофотометър при 412 nm. Общото съдържание на GSH в черния дроб се изчислява от стандартна крива, получена чрез начертаване на известното количество GSH спрямо скоростта на промяна на абсорбцията при 412 nm.
Определяне на антиоксидантните ензимни активности в черния дроб и плазмата
Чернодробните тъкани се хомогенизират в 20 тМ фосфатен буфер, съдържащ 0,1 М KCl, 1 тМ EDTA и 0,5% Triton X-100 (рН 7,4). Хомогенатите се центрофугират в продължение на 30 минути при 25 000 rpm и 4 ℃ и супернатантата се използва за следващите ензимни анализи. Активността на глутатион S-трансфераза (GST) се определя, както е описано по-рано (Habig et al., 1974), като се използва 1-хлоро-2,4-динитробензен (CDNB, субстрат) в присъствието на 0.1 mM GSH. Образуването на динитрофенил тиоетер от GST при 37 ° С се наблюдава в продължение на 3 минути с UV/VIS спектрофотометър в абсорбция при 340 nm. GST активността се изразява като средно ± стандартно отклонение на четирикратния анализ. За определяне на активността на глутатион редуктаза (GR), супернатантата се смесва с 1 М глутатион дисулфид (GSSG) и 5 mM NADPH в 0,1 М фосфатен/0,5 тМ EDTA буфер (рН 7,0) и се наблюдава образуването на NADP + с UV/VIS спектрофотометър при 340 nm (Floreani et al., 1997; Pinto et al., 1984).
Активността на глутатион пероксидазата (GPx) се определя чрез смесване на супернатантата с 1 mM EDTA, 100 mM GSH, 5 mM NADPH и една единица глутатион редуктаза в 0,1 М фосфатен буфер (рН 7,0). След инкубиране в продължение на 3 минути се добавя 10 mM кумонов хидропероксид и окислението на NADPH в NADP + се наблюдава спектрофотометрично при 340 nm, при което една единица GPx води до образуването на 1 µmole NADP + на минута (Tappel et al., 1978) . За анализ на супероксиддисмутаза (SOD), супернатантата се смесва с 1 mM ксантин, 0,2 mM цитохром и 0,05 M калиев цианид в 0,05 M калиев фосфат/0,1 mM EDTA буфер. Ксантиноксидазата се добавя към реакционната смес и активността на SOD се определя спектрофотометрично (550 nm) като скорост на инхибиране на редукцията на цитохрома от супероксиден радикал (McCord & Fridovich, 1969). Дейностите на GR, GPx и SOD се изразяват като международна единица/mg чернодробна тъкан. За анализ на плазмена параоксоназа (PON), плазмата на мишките (5 uL) се прехвърля в буфера, съдържащ 20 mmol Tris/HCI и 1 mM CaCl2. След добавяне на 0,2 М фенилацетат, активността на PON се определя със скоростта на образуване на фенол чрез проследяване на нарастването при 270 nm. Една единица активност на PON е равна на 1 µM фенол на минута (Gan et al., 1991).
Определяне на съдържанието на β-каротин в плазмата
Плазмата на мишките (100 uL) се смесва с етанол (500 uL) и бутилиран хидрокситолуен (BHT) в метанол (91 mmol, 25 uL) в епруветка. Хексан (3 ml) се добавя към реакционната смес и се завихря за 30 секунди. Органичната фаза, съдържаща β-каротин, се отделя чрез дестилирана вода и се центрофугира при 1500 об/мин за 2 минути. Горната фаза се събира и хексанът се изпарява под азотен поток. Остатъкът се разтваря в изопропанол/ацетонитрил (50:50, v/v) и се инжектира във високоефективна течна хроматография (HPLC), снабдена с UV детектор, настроен на 450 nm. За отделяне беше използвана колона Nova-Pak C18 (4 µm, 150 × 3.9 mm вътрешен диаметър, Waters, Milford, MA). Елуирането се извършва с изократична подвижна фаза от ацетонитрил/изопропанол/метанол (68:20:12, v/v/v) с 0,02% амониев ацетат и скоростта на потока се определя на 1,0 ml/min. Количеството на β-каротин се определя с калибрационна крива. Като вътрешен стандарт се използва β-апо-8'-каротенал и се извършва трикратен анализ.
Определяне на увреждане на ДНК на хепатоцити и лимфоцити
Чернодробната тъкан се хомогенизира при 600 rpm с 50 mM балансиран солев разтвор на Hank с 1 mM EDTA (рН 7.4). Клетките се промиват два пъти преди гел електрофореза. Ендогенното увреждане на ДНК в лимфоцитите и хепатоцитите се анализира чрез алкална едноклетъчна гел електрофореза (анализ на Comet) с лека модификация (Singh et al., 1988).
- Естествено сладък лимонов джинджифил Рецепт от сок от цвекло
- Тестостерон ундеканоат Околен бета амилоид, ключов Алцхаймер; s Купете хапчета Andriol -
- Рецепта от сотирано цвекло с чесън и зехтин - готвене NYT
- Рецепта за сладък червено зеле и цвекло - Spry Living
- Рецепта за сладки картофени протеинови палачинки - Здравно цвекло