Субекти
Резюме
Чревната микробиота влияе върху усвояването на хранителни вещества и регулирането на енергията на гостоприемника и може да повлияе на развитието на затлъстяване, инсулинова резистентност и диабет. По време на хранене чревните микроби произвеждат късоверижни мастни киселини, които са важни енергийни източници за гостоприемника. Тук показваме, че късоверижният рецептор на мастна киселина GPR43 свързва метаболитната активност на чревната микробиота с енергийната хомеостаза на тялото на гостоприемника. Ние демонстрираме, че мишките с дефицит на GPR43 са с наднормено тегло при нормална диета, докато мишките, свръхекспресиращи GPR43, специфично в мастната тъкан, остават слаби, дори когато се хранят с високо съдържание на мазнини. Отгледани при условия без микроби или след лечение с антибиотици, и двата вида мишки имат нормален фенотип. По-нататък показваме, че активираната от GPR43 медиирана от къси вериги мастна киселина потиска инсулиновата сигнализация в адипоцитите, което инхибира натрупването на мазнини в мастната тъкан и насърчава метаболизма на неконтролираните липиди и глюкоза в други тъкани. Тези открития установяват GPR43 като сензор за прекомерна диетична енергия, като по този начин контролира използването на енергията на тялото, като същевременно поддържа метаболитна хомеостаза.
Въведение
Чревната микробиота е асортимент от микроорганизми, обитаващи стомашно-чревния тракт на бозайниците, и неотдавнашни изследвания показват, че чревната микробиота участва в затлъстяването и метаболитните нарушения 1,2,3,4. Изследвания, използващи мишки, свързани с наднорменото тегло, индуцирани от високо съдържание на мазнини (HFD), свързват променен състав на микробиота на червата с развитието на затлъстяване, инсулинова резистентност и диабет в гостоприемника чрез няколко механизма, включително повишена енергийна реколта от диетата и променени мастни киселини метаболизъм и състав в мастната тъкан и черния дроб 5,6,7,8 .
Една важна дейност на чревната микробиота е да катаболизира диетичните фибри, които не са напълно хидролизирани от ензимите гостоприемници 9. Основните продукти на бактериалната ферментация на дебелото черво от диетични фибри са късоверижни мастни киселини (SCFA) като ацетат, пропионат и бутират 10; SCFA могат да се използват за de novo синтез на липиди и глюкоза 11, които се използват като основни енергийни източници за гостоприемника.
В допълнение към енергийните източници, SCFA са установени като основни хранителни вещества, които действат и като сигнални молекули. Напоследък се съобщава, че два осиротени G протеин-свързани рецептора, GPR41 и GPR43, се активират от SCFA 12. Съобщава се, че GPR41 се свързва с Gi/o като α-субединица на хетеротримерен G протеин и действа като енергиен сензор, свързан с чревната микробиота в симпатиковата нервна система и червата 13,14,15,16. Съобщава се, че GPR43 се свързва с Gi/o или Gq като друга а-субединица на хетерометричен G протеин 17,18. Съобщава се също, че GPR43 се експресира в мастната тъкан, червата и имунните тъкани 19,20. В имунната система регулирането на възпалителните реакции чрез GPR43 е добре проучен процес 20,21,22; GPR43 обаче не е изследван толкова добре в мастната тъкан. Някои проучвания показват, че GPR43 насърчава секрецията на лептин, адипогенезата и инхибирането на липолизата в мастната тъкан и адипоцитите, като по този начин регулира енергийния метаболизъм 19,23,24. Хранените с HFD мишки с дефицит на GPR43 показват подобрен глюкозен толеранс и намалена телесна мастна маса 25. От друга страна, друга група съобщава, че GPR43, експресиран в червата, подобрява глюкозния толеранс, като стимулира секрецията на глюкагоноподобен пептид-1 (GLP-1; като инкретин) от L клетки .
Ролите на GPR43 в метаболитните процеси все още не са ясни. В това проучване, използвайки мишки без GPR43 и със специфична за адипоза свръхекспресия на GPR43, представяме истинската функция на GPR43 в мастната тъкан и ролята на GPR43 в регулирането на енергийния баланс.
Резултати
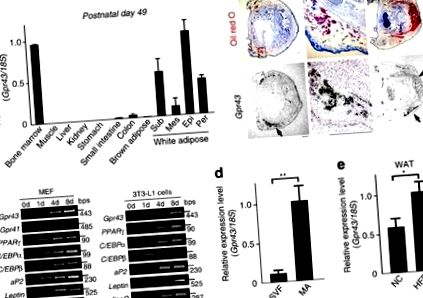
Gpr43 се изразява обилно в бялата мастна тъкан
Gpr43 се изразява главно в имунната тъкан и бялата мастна тъкан (WAT) на възрастни мишки, както се съобщава по-рано 18,19, но не и в кафявата мастна тъкан (BAT; Фиг. 1а). На място хибридизацията в постнаталния стадий (P1) потвърждава това Gpr43 е най-обилно изразено в WAT и не е изразено в BAT (фиг. 1b). По време на адипогенеза, Gpr43 се изразява в по-късните етапи на диференциация от aP2 и PPARg, маркери на зрели адипоцити (MA) в 3T3-L1 пре-адипоцити и миши ембрионални фибробласти (MEFs; Фиг. 1в). В възрастната мишка мастна тъкан, Gpr43 е експресирана обилно във фракцията на МА, но не и в стромалната съдова фракция, съдържаща преадипоцити и макрофаги (фиг. 1г). освен това, Gpr43 експресията е значително по-висока при WAT на мишки, хранени с HFD, в сравнение с мишки, хранени с нормална чау (NC) (фиг. 1д). По този начин, Gpr43 е експресиран обилно в зрялата WAT, но не и в BAT или в преадипоцитите.
Gpr43 нокаутиращите мишки проявяват затлъстяване
Адипозна специфична Gpr43 трансгенните мишки са слаби
GPR43 потиска инсулиновата сигнализация в мастната тъкан
По-нататък изследвахме връзката между функцията GPR43 и инсулиновата чувствителност. WAT, мускулите и черният дроб са трите основни тъкани, участващи в метаболизма на горивата 28. Изненадващо, въпреки че инсулиновата чувствителност беше подобрена през aP2-Gpr43TG мишки в сравнение с мишки от див тип в контекста на HFD хранене (фиг. 3o), индуцираното от инсулин фосфорилиране на Akt в WAT, но не и мускулите или черния дроб, беше значително потиснато (фиг. 4а-в). Приложението на ацетат значително потиска индуцираното от инсулин фосфорилиране на Akt в WAT, но не и мускулите или черния дроб на мишки от див тип, докато ефектът не е проявен в WAT на Gpr43 -/- мишки (фиг. 4d – f). Тези резултати показват, че GPR43 сигнализирането потиска инсулиновата сигнализация само в WAT.
Следователно, ние след това изследвахме функциите на SCFAs и GPR43 върху свързаната с WAT инсулинова сигнализация биоактивност 29. GPR43 насърчава адипогенезата инвитро 19. По този начин, за да се избегнат вариации в диференциацията на адипоцитите от дефицит на GPR43, използвахме индуцирана от пиоглитазон адипогенеза 30. Както се очаква, адипогенезата в адипоцитите, получени от MEF, получени от пиоглитазон, не се различава по дивия тип и Gpr43 -/- или aP2-GPR43TG мишки (допълнителна фигура S3a, b). Ацетатът значително потиска индуцираното от инсулина усвояване на глюкоза и мастни киселини в адипоцитите от див тип мишки, но не и Gpr43 -/- мишки (Фиг. 4g; Допълнителна Фиг. S3c), докато тя е допълнително усилена в адипоцитите от aP2-Gpr43TG мишки (фиг. 4ч). Освен това, активността на липопротеин липазата (LPL) е по-висока при HFD хранене Gpr43 -/- мишки и по-ниски в aP2-Gpr43TG в WAT, но не и в мускулите (фиг. 4k). Тези ефекти върху LPL активността в WAT бяха премахнати при GF условия и чрез антибиотично лечение (Фиг. 4m). В допълнение, Lpl експресията на иРНК в WAT е сравнима в Gpr43 -/- мишки и по-ниски в aP2-Gpr43TG мишки (допълнителна фигура S3d). Като цяло тези резултати показват, че потискането на инсулиновата сигнализация в WAT, но не и мускулите или черния дроб, променя метаболизма на глюкозата и липидите чрез ацетатзависима стимулация GPR43.
GPR43 потиска инсулиновата сигнализация чрез G (i/o) βγ – PLC – PKC – PTEN
По-нататък изследвахме GPR43-медиираното вътреклетъчно сигнализиране в 3T3-L1 получени преди адипоцити адипоцити. Фенилацетамидът (PA) е известен като GPR43-селективен агонист 31, докато циклопропанкарбоксилната киселина е частично селективен агонист на GPR41 (допълнителна фигура S4a, b). Ацетатът и PA значително потискат индуцираното от инсулин фосфорилиране на Akt, докато циклопропанкарбоксилната киселина слабо потиска същото (фиг. 5а). От друга страна, н 6-циклопентиладенозин, лиганд за аденозин А1 рецептора (Gi/o-тип G протеин-свързан рецептор) 32 няма ефект върху индуцираното от инсулин фосфорилиране на Akt (допълнителна фигура S4c). GPR43-медиираното потискане на индуцираното от инсулин Akt фосфорилиране е ефективно блокирано от лечението с коклюшен токсин (PTX), Gi/o-тип G протеинов инактиватор 33 (Фиг. 5b), докато лечението на кратко интерферираща РНК (siRNA) срещу Gq протеин (допълнителна фигура S4d, e) няма инхибиторни ефекти (фиг. 5в). Нещо повече, GPR43-медиираното потискане на индуцираното от инсулин фосфорилиране на Akt беше ефективно блокирано от лечението с Gallein (Gβy блокер), но не и NF023 (Gα (i/o) блокер 14) (Фиг. 5b). Съобщава се, че G (i/o) βγ посредничи към PLC – PKC – ERK пътя 34. GPR43-медиираното потискане на индуцираното от инсулин фосфорилиране на Akt е ефективно блокирано от лечението с U73122 (PLC инхибитор) и Go6983 (PKC инхибитор), но не и U0126 (MEK инхибитор) (Фиг. 5г).
След това изследвахме дали GPR43 потиска директно инсулиновата сигнализация. Ацетатът значително насърчава фосфорилирането на PTEN (фосфатаза и хомолог на тензин), отрицателен регулатор на инсулин/PI3K сигнализиране 35, и ефектът е ефективно блокиран чрез лечение с Go6983 и PTX (Фиг. 5д). В допълнение, медиираното от ацетат потискане на индуцираното от инсулин фосфорилиране на Akt беше ефективно блокирано чрез лечение с bpV (снимка), PTEN инхибитор (фиг. 5е). Съобщава се, че PKC-зависимото фосфорилиране на чернодробната киназа B1 (LKB1) насърчава PTEN фосфорилирането 36. Ацетатът значително насърчава фосфорилирането на LKB1 със или без инсулин и ефектът е ефективно блокиран чрез лечение с Go6983 и PTX (допълнителна фигура S4f). От друга страна, ацетатът няма ефект върху инсулиновия рецепторен субстрат1, инсулинов сигнален адаптер протеин 35) фосфорилиране (допълнителна фигура S4g). В допълнение, ацетатът значително потиска индуцираното от епидермалния растежен фактор фосфорилиране на Akt (допълнителна фигура S4h). Нещо повече, лечението с ацетат или PA значително потиска индуцираното от инсулина усвояване на глюкоза и активирането на LPL и тези инхибиторни ефекти са премахнати чрез лечение на PTX (фиг. 5g). По този начин, медиирано от ацетат активиране на GPR43 потиска биоактивността на инсулина чрез потискане на Akt фосфорилиране чрез G (i/o) βγ – PLC – PKC – PTEN (Фиг. 5i).
GPR43 насърчава енергийните разходи
Дискусия
SCFA, включително ацетат, действат като лиганди за GPR43 и се произвеждат от чревната микробиота 12. При условия на хранене с HFD, съдържанието на SCFA на фекалиите и плазмения ацетат при HFD-хранени мишки значително намалява в сравнение с тези при NC-хранени мишки (допълнителна фигура S2a, b). Това вероятно се дължи на заместването на въглехидрати с мазнини в HFD, което намалява производството на SCFA от чревната микробиота (допълнителна таблица S1). въпреки това, Gpr43 експресията е значително по-висока (приблизително два пъти) в WAT на HFD-хранени мишки в сравнение с NC-хранени мишки (Фиг. 1д). Това показва, че въпреки че е имало намаляване на ендогенни SCFA лиганди, увеличаването на експресията на GPR43 в мастната тъкан допринася за драматичния фенотип в Gpr43 -/- мишки, което допълнително се изостря от индуцирания от HFD метаболитен фенотип.
GPR43 насърчава секрецията на лептин и адипогенезата и инхибира липолизата инвитро 19,22,23,24. Въпреки това, нашите проучвания, използвайки Gpr43 -/- мишки и aP2-Gpr43TG мишки, показаха, че адипогенезата е сравнима при див тип, Gpr43 -/- и aP2-Gpr43TG мишки при Р1. Освен това плазмените нива на лептин са сравними при дивия тип и Gpr43 -/- мишки. За разлика от това, нивото на плазмен лептин в aP2-Gpr43TG мишки е по-ниска, отколкото при мишки от див тип на възрастен етап. Тези резултати предполагат, че инвитро експериментите не отразяват правилно физиологичните условия in vivo. Освен това in vivo експериментите показват, че инхибирането на липолизата чрез активиране на GPR43 намалява нивото на свободните мастни киселини в плазмата и отговорът е премахнат през Gpr43 -/- мишки 23. Тези отговори могат да се обяснят с потискане на приема на мазнини в WAT чрез инхибиране на инсулиновата сигнализация, но не и липолиза. Следователно, чрез интегриране на функцията на GPR43 в WAT, включително инхибиране на LPL активността, усвояване на глюкоза и усвояване на липиди, нашето настоящо проучване изясни, че активирането на GPR43 води до потискане на инсулиновата сигнализация и по този начин предотвратява натрупването на енергия.
SCFA се считат за важни енергийни източници за приемащия 42,43. От друга страна, настоящото ни проучване разкри, че SCFA също действат като сигнални молекули за поддържане на енергийния баланс. Храненето повишава плазмените нива на глюкоза и липиди, а излишните мастни киселини и глюкоза се съхраняват ефективно като мазнини. Въпреки това, натрупването на мазнини чрез излишно хранене води до затлъстяване и предизвиква няколко метаболитни нарушения. Нашите резултати показват, че плазмените нива на SCFA се увеличават след повишаване на нивото на глюкоза в плазмата по време на хранене. Следователно, GPR43 може да функционира като енергиен сензор за насърчаване на използването на излишната енергия в друга тъкан, вместо да съхранява излишната енергия като мазнина в мастната тъкан, като по този начин поддържа метаболитната хомеостаза. Освен това условията на GF и лечението с антибиотици напълно премахнаха свързания с метаболитната дисфункция фенотип при мишки с мутант на GPR43, което показва, че чревната микробиота е най-важният доставчик на агонисти на GPR43 и че функциите на GPR43 са тясно свързани с чревната микробиота.
В това проучване показахме, че SCFA активират GPR43 за регулиране на усвояването на енергия в WAT, което води до регулиране на енергийните разходи в други тъкани, включително черния дроб и мускулите. Също така съобщихме, че GPR41, друг SCFA рецептор, регулира енергийните разходи на тялото чрез активиране на симпатиковата нервна система на ниво ганглий 14. Тези констатации показват, че SCFAs, произведени от чревна микробиота, чрез активиране на GPR41 и GPR43, имат важна роля в разпознаването на излишъка на хранителни вещества след хранене и организирането на енергийните разходи за поддържане на енергийната хомеостаза (Фиг. 7) В допълнение, резултатите, получени в нашия модел на свръхекспресия на GPR43, показват възможността свръхстимулацията на GPR43 да бъде стратегия за терапия на метаболитни нарушения, включително затлъстяване и захарен диабет.
След хранене SCFAs, произведени чрез микробна ферментация в червата, активират GPR43 в мастните тъкани. SCFA-медиираното активиране на GPR43 потиска медиираното от инсулин натрупване на мазнини и по този начин регулира енергийния баланс, като потиска натрупването на излишна енергия и насърчава консумацията на мазнини.
- Ефективността на агонист и пребиотик на подобен на глюкагон пептид 1 рецептор върху мазнини с къса верига
- Обогатена диета за ненаситени мастни киселини за подобряване на кардиореспираторната фитнес, метаболитна гъвкавост
- Какви храни съдържат фолиева киселина; Новини-Медицински
- Какви храни да се избягват с ГЕРБ и киселинен рефлукс - Хирургичната клиника
- Какви плодове можете да ядете, ако имате тлъст черен дроб