Резюме
Заден план
Остеоартритът (ОА) на коляното включва дегенерация на ставния хрущял на диартродиалните стави. Настоящите възможности за лечение временно облекчават болката в ставите, но не възстановяват изгубения хрущял. Наскоро разработихме нов миметичен пептид с костен морфогенетичен протеинов тип I (BMPRI), CK2.1, който активира BMPRIa сигнализиране при липса на костен морфогенетичен протеин (BMP). Нашите предишни изследвания показаха, че CK2.1 индуцира хондрогенеза in vitro и in vivo; обаче е неизвестно дали CK2.1 възстановява увредения ставен хрущял in vivo. В това проучване ние демонстрираме, че CK2.1 индуцира възстановяване на ставния хрущял (AC) в модел на мишка OA.
Методи
Проектирахме хидрогелни частици (HGP), базирани на хиалуронова киселина (HA), които бавно освобождават CK2.1. HGP-CK2.1 частиците бяха тествани за хондрогенна сила върху плюрипотентни мезенхимни стволови клетки (клетки C3H10T1/2) и локално инжектирани във вътреставната капсула при мишки с хрущялни дефекти. C57BL/6J мишки бяха оперирани, за да дестабилизират медиалния менискус и тези мишки бяха държани в продължение на 6 седмици след операцията, за да претърпят увреждане, подобно на ОА. След това мишките се инжектират през вътреставната капсула с HGP-CK2.1; 4 седмици след инжектирането мишките се умъртвяват и бедрените им кости се анализират за дефекти на хрущяла.
Резултати
Имунохистохимичният анализ на хрущяла демонстрира цялостно възстановяване на АС в сравнение с фалшиви мишки. Имунофлуоресцентният анализ разкрива производството на колаген тип IX заедно с колаген тип II в АС на мишки, инжектирани с HGP-CK2.1. Мишките, инжектирани с буфериран с фосфат физиологичен разтвор (PBS) и само HGP, имат по-голямо производство на колаген тип X и остеокалцин, за разлика от онези, инжектирани с HGP-CK2.1, което показва повишена хипертрофия на хондроцитите.
Заключения
Нашите резултати показват, че бавното освобождаване HGP-CK2.1 води до възстановяване на хрущяла без индуциране на хипертрофия на хондроцитите. Пептидът СК2.1 може да бъде мощен инструмент за разбиране на сигналните пътища, допринасящи за възстановителния процес, а също така може да се използва като потенциално терапевтично средство за лечение на дегенеративни хрущялни заболявания като OA.
Заден план
Ставният хрущял (AC) е вискоеластична съединителна тъкан, която покрива ставните краища на бедрената кост и е от съществено значение за свободното движение на ставите. Състои се от хондроцити, които са отговорни за производството на извънклетъчен матрикс (ECM) в тази тъкан. Тази ECM мрежа поддържа носещите свойства за механично компресиране през фугата [1]. Остеоартритът (OA) е метаболитно заболяване на хрущяла, засягащо 21,7 милиона души всяка година и е единадесетият с най-голям принос за увреждане и струва над 28,5 милиарда долара годишно [2–4]. При ОА АС претърпява прогресивна загуба на ECM, засилена хипертрофия на хондроцитите и загуба на хондроцитна апоптоза [5]. Хондрогенният ECM е съставен от протеогликани, като агрекани, и колагени, включително тип II, тип IX и тип XI, които образуват омрежена мрежа за регулиране на неговите биологични свойства [6]. По-важното е, че АС е аваскуларна тъкан и има слаб регенеративен капацитет на тъканите. Освен това ОА се придружава от ремоделиране и склероза на субхондралната кост и образуване на остеофити [7].
Сред много растежни фактори, които влияят върху прогресията на ОА, костните морфогенетични протеини (BMPs), като BMP2, значително ускоряват общата загуба на AC [8]. Интересното е, че BMP2 е мощен растежен фактор с много плейотропни функции, включително образуване на AC [9, 10]. Известно е също, че BMP2 индуцира хипертрофия на хондроцитите, последвана от калциране на хрущяла [10]. Следователно BMP2 може да не е ценен като терапевтично средство за възстановяване на хрущяла при дегенеративни заболявания като ОА.
Методи
Всички 10-седмични мъжки мишки C57BL/6 J са получени от лабораторията Джаксън (Bar Harbor, ME, САЩ) и поддържани при конвенционални условия на отглеждане. Протоколът за животните е одобрен от IACUC в университета в Делауеър. Мъжки мишки на възраст 10 седмици (н = 6/група) са разделени в четири групи: HGP-CK2.1-, HGP- и PBS-инжектирани групи, и мишки, подложени на фалшива експлоатация.
Хирургична дестабилизация на медиалния менискус
Дизайн на пептиди
Пептидите са проектирани от нашата група, както е описано по-рано [11]. При търсене на прозит, включващо модели с голяма вероятност за поява на BMPRIa, се получават възможни сайтове за фосфорилиране на СК2, разположени в аминокиселини 466-469 (SYED). Пептидите са проектирани със сигналната последователност на хомедомена на Antennapedia за клетъчно поемане и са включени в едно от тези места за свързване: CK2.1 (SYED). Пептидите включват няколко аминокиселинни остатъка, фланкиращи всяка страна [15].
Получаване на CG2.1-конюгирани HGP
Ин витро освобождаване на СК2.1
HGP-CK2.1 (2 mg) се диспергира в PBS (0.5 ml) при постоянно въртене при 37 ° С. В предварително определени времеви моменти супернатантата се събира чрез центрофугиране (3000 rpm за 5 минути) и освобождаващата среда се допълва с равно количество пресен PBS. Освободеният пептид в PBS се определя количествено чрез UV-Vis спектрофотометър при 280 nm. Кумулативното освобождаване се изчислява като общото количество CK2.1 пептид, освободен в средата за определено време спрямо първоначалното зареждане.
Клетъчна култура
C3H10T1/2 клетки са закупени от American Type Culture Collection (CCL-26) (Manassas, VA, USA) и еднослойните култури се поддържат в колби T-75, отглеждани в модифицираната среда на Dulbecco на Eagle (DMEM; Mediatech, Manassas, VA, USA) допълнен с 10% (v/v) фетален говежди серум (FBS; Gemini Bioproducts, West Sacramento, CA, USA), 0.5% (v/v) l-глутамин (Mediatech) и 1% (v/v) пеницилин/стрептомицин (100 IU/ml пеницилин, 100 μg/ml стрептомицин; Fisher Scientific, Питсбърг, Пенсилвания, САЩ). Културите се инкубират при 37 ° C и 5% CO2 във въздуха, а клетките се пасажират при 90% сливане с 0,05% (v/v) трипсин-EDTA (Gemini Bioproducts).
Алцианско синьо оцветяване
C3H10T1/2 клетки се посяват при 1 × 10 7 клетки/ml и се посяват като 10-μl микромасова култура в 1,9 cm 2 24-гнездова плака (Nunc, Rocskilde, Дания). Клетките се допълват с DMEM с 10% (v/v) FBS и се инкубират при 37 ° С и 5% CO2. След това клетките бяха стимулирани с рекомбинантен BMP2 (40 nM; GenScript, Piscataway, NJ, USA) или HGP-CK2.1 (5 nM или 10 nM или 30 nM или 50 nM/ден концентрация на освобождаване).
Седем дни след стимулация, културите се фиксират, използвайки 10% (v/v) неутрално буфериран формалин (рН 7.4), смесен с 0.05% тегл./Об. Цетилпиридиниев хлорид в продължение на 20 минути при стайна температура. Клетките се изплакват три пъти с 3% (v/v) ледена оцетна киселина (рН 1.0) и се оцветяват, използвайки 0.5% (w/v) Alcian blue 8-GX оцветяване (Life line, Walkersville, MD, USA) за една нощ. След оцветяването културите се изплакват с 3% (v/v) ледена оцетна киселина (рН 1.0) и се изсушават на въздух. Оцветените култури бяха разгледани под обърнат светлинен микроскоп (Nikon, TMS-f) с 20-кратно увеличение и събраните изображения бяха анализирани и количествено определени със софтуера ImageJ (NIH, Bethesda, САЩ) [18].
Хистологично точкуване
Две седмици след последните вътреставни инжекции, мишките бяха умъртвени и дисектираните бедрени кости бяха фиксирани в 10% (v/v) неутрален буфериран формалин (Sigma Aldrich, Сейнт Луис, МО, САЩ) и декалцифицирани за 5 дни в 5% (v/v) мравчена киселина в 10% (w/v) натриев цитрат (Sigma Aldrich). Проби от бедрената кост (н = 6/група) са вложени парафин и са разделени на дебелина 6 μm. Секционираните проби от слайдове бяха оцветени с помощта на Safranin O и бързо зелено оцветяване [19, 20]. Точкуването се извършва в четири отделения на коляното, като се използва модифицирана полуколичествена скала за оценка, както е описано по-рано [14]. Точкуващият анализ, използван в това проучване, е: резултат 0 = нормален хрущял, резултат 0.5 = загуба на оцветяване на сафранин О с нормална ставна повърхност, резултат 1 = малки фибрилации или грапава ставна повърхност и резултат 2 = фибрилации, простиращи се в повърхностната ламина. За всяко анализирано коляно, 12 слайда, представляващи цялата става, бяха заслепени и отбелязани от двама независими наблюдатели.
Имунооцветяване
Секционирани проби от бедрената кост (н = 6/група) (предварително обработени в ксилол за 10 минути, за да се изчисти парафинът) се инкубират с тестикуларна хиалуронидаза в продължение на 30 минути, за да се изложат колагенови епитопи. Пробите бяха маркирани имунофлуоресцентно в продължение на 1 час при стайна температура или с заешки поликлонален IgG колаген тип II (10 μg/ml; ab34712; Abcam, Великобритания), последвано от Alexa 488 магарешки анти заешки IgG (2 μg/ml; Invitrogen, Eugene, OR, САЩ) или заешки поликлонален колаген IX (10 μg/ml; Abcam), последван от Alexa 647 кози анти-заешки IgG (2 μg/ml; Invitrogen) или заешки (Rb) pAb колаген X (10 μg/ml; ab58632; Abcam ), последвано от Alexa fluor 488 магарешко анти-заешко (2 μg/ml; Invitrogen) или заешко поликлонално IgG остеокалцин (10 μg/ml; Santa Cruz Biotechnology, CA, USA), последвано от Alexa fluor 488 магарешко анти-заешко (2 μg/ml; Invitrogen). Антителата се разреждат в 3% (w/v) говежди серумен албумин (BSA). Ядреното петно бисбензимид (Sigma Aldrich; Hoechst багрило № 33258, разтворено в H2O) се прилага за 5 минути и покривни стъкла се монтират върху пързалки с помощта на Airvol, както е описано по-горе [21, 22]. Правени са изображения (н = 8 раздела изображения/проба) на Zeiss 780 confocal с 20 × обектив (0.75NA, Beam Splitter (MBS) 458/514/561/633, 5% лазерен изход и (MBS) 405, 2% лазерен изход) . Изображенията са количествено определени с помощта на ImageJ (NIH, Bethesda).
Статистически анализ на данните
Всички представени данни бяха анализирани с помощта на дисперсионен анализ с един фактор (ANOVA), последван от пост-хок тест на Tukey-Kramer. Всички експерименти бяха повторени три или повече пъти и нормализирани за контрол. Лентите за грешки представляват стандартна грешка на средната стойност (SEM), където * означава статистическа значимост при стр
Резултати
HGP освобождават CK2.1 контролирано
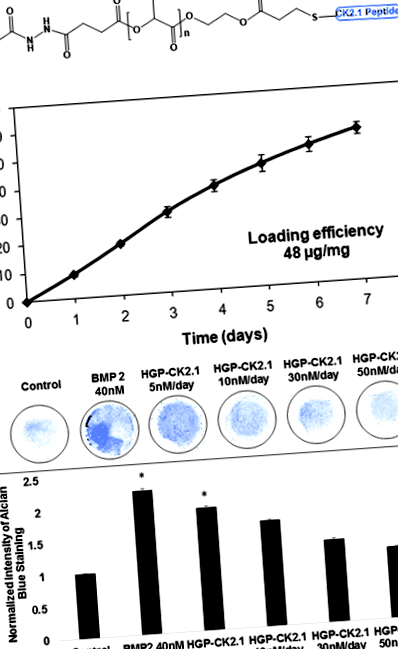
CK2.1 беше ковалентно конюгиран към HGP чрез добавяне на Майкъл, използвайки цистеин-маркиран пептид и акрилирани HGP (Фиг. 1а). Приблизително 48 μg CK2.1 се конюгира с 1 mg HGP. Пептидът се освобождава (фиг. 1б) от HGP със скорост от +9,4 тегл.%/Ден от ден 0 до ден 4 и +5,3 тегл.%/Ден от ден 4 до ден 7. На ден 7, когато експериментът беше при прекратяване, общо 54,6 тегл.% от първоначално натоварения пептид се освобождава от частиците.
След това използвахме C3H10T1/2 мезенхимни прогениторни клетки в култури с микромаса, за да тестваме хондрогенната сила на бавно освобождаващия HGP-CK2.1. Нашето предишно проучване демонстрира положителна хондрогенна активност сред клетки C3H10T1/2 в микромасови култури, стимулирани с CK2.1 при концентрации, вариращи от CK2.1 при 100 nM (най-ниска) до 500 nM (най-висока) [13]. Следователно, C3H10T1/2 клетъчни култури от микромаса се стимулират с концентрации на HGP-CK2.1, изчислени на базата на обща концентрация на CK2.1 от 50 nM или 100 nM или 300 nM или 500 nM. Освобождаването на CK2.1 от HGP обаче се отбелязва въз основа на кумулативното освобождаване на общото количество CK2.1, освободено от първоначалното зареждане. Коригираната стойност на освобождаване на HGP-CK2.1 (+ 9.4%/ден) на следните концентрации е (50 nM) 5 nM/ден, (100 nM) 10 nM/ден, (300 nM) 30 nM/ден и ( 500 nM) 50 nM/ден (фиг. 1в). Еднократното третиране на HGP-CK2.1 в продължение на 7 дни при дадените концентрации върху култури с микромаса C3H10T1/2 демонстрира най-добрата хондрогенна активност при концентрация 5 nM/ден, както е показано при използване на Alcian синьо оцветяване.
Вътреставните инжекции на HGP-CK2.1 възстановяват хрущялната хомеостаза при DMM мишки
Хирургичната дестабилизация на модела на медиалния менискус е техника, която позволява формирането на AC лезия в носещите тежести области на медиалното плато на тибията и медиалните кондили [14]. Това най-добре отразява развитието, подобно на ОА, при увреждане на хрущяла, което го прави идеалният модел за нашето изследване при мишки. Дестабилизацията на медиалния менискус е извършена върху мъжки мишки C57BL/6 J (н = 6/група) на възраст 10 седмици, за да предизвика OA-подобни промени. На 6 седмици след операцията на мишките се инжектира PBS, 6 μM HGP-CK2.1 (коригирано въз основа на общото количество пептид CK2.1, освободен спрямо първоначалното натоварване), или HGP самостоятелно интраартикуларно веднъж на всеки Две седмици. Концентрацията на HGP-CK2.1 при 6 μM е избрана въз основа на данните за натоварване с пептиди, които показват освобождаване на CK2.1 на база 500 nM на ден. Тези проби от бедрената кост на мишките бяха обработени и оценени за увреждане на хрущяла, използвайки модифициран полуколичествен анализ на Mankins [20]. Хистологичното точкуване и анализ показват, че мишките, инжектирани с HGP-CK2.1, имат най-малко увреждане на ОА и по-голямо възстановяване на хрущяла в сравнение с тези, инжектирани само с HGP или PBS, в сравнение с фалшиво оперираната група (Фигура 2). Трябва да се отбележи, че мишките, инжектирани само с PBS, имат най-голям резултат за увреждане, както се вижда от по-дълбоки пукнатини и загуба на съдържание на протеогликан.
Инжектираните с HGP-CK2.1 DMM мишки имат повишена експресия на колаген тип II и тип IX
Хистологичният анализ демонстрира, че инжектираните с HGP-CK2.1 DMM мишки показват най-доброто възстановяване на хрущяла в сравнение с мишките, инжектирани с HGP или PBS. За да идентифицираме ECM състава на новорегенерирания хрущял, ние имунооцветихме хрущяла на DMM коленните проби за колаген тип II и тип IX. Анализът на DMM колена, инжектирани с HGP-CK2.1, показва производството на колаген тип II, което е последователно в сравнение с мишки, инжектирани с HGP или PBS. Въпреки това, инжектираните с HGP-CK2.1 проби демонстрират повишени нива на колаген тип IX в сравнение с мишки, инжектирани с HGP или PBS (Фиг. 3). Тази констатация за повишени нива на колаген тип IX в АС е в съответствие с нашата докладвана по-рано работа in vivo [13].
HGP-CK2.1 индуцирана експресия на колаген тип II и колаген тип IX в AC. DMM мишки, инжектирани с PBS или HGP-CK2.1 или HGP, и мишки, подложени на фалшива употреба, бяха имунооцветени за колаген тип II (червен) и тип IX (пурпурен) и Hoechst (син) се използва за оцветяване на ядрото на пребиваващата клетка и местоположението. HGP-CK2.1 инжектирани мишки демонстрираха високи нива на колаген тип IX в сравнение с контролни мишки, инжектирани с HGP или PBS. Мащабни ленти = 100 μm. AC ставния хрущял, HGP хидрогелни частици, MF медиална бедрена кост, MC мозъчна кухина, PBS буфериран с фосфат физиологичен разтвор, настолен компютър пателарна кухина, ШАМ фалшиво задвижван
Повишена експресия на колаген тип X и експресия на остеокалцин при HGP- и PBS-инжектирани мишки, но не и при HGP-CK2.1-инжектирани мишки
HGP-инжектираните мишки показват умерена регенерация на хрущяла в сравнение с PBS, докато се наблюдава значително увеличение на колаген тип X в HGP-инжектирани проби, подобно на това на PBS-инжектирани мишки. Въпреки това, инжектираните с HGP-CK2.1 проби показват ниска експресия на колаген тип X в областите на възстановяване на матрикс на хрущяла (Фиг. 4). Тази констатация е докладвана по-рано в нашата работа in vivo [13]. В допълнение, пробите мишки HGP-CK2.1 DMM не демонстрират експресия на остеокалцин, както се наблюдава при проби от мишки, инжектирани с PBS (Фиг. 5).
DMM мишки, инжектирани с PBS и HGP индуцирана експресия на колаген тип X в ставния хрущял, но HGP-CK2.1 не. DMM мишките, инжектирани с PBS или HGP-CK2.1 (6 μM) или HGP, и мишки, подложени на фалшива употреба, бяха имунооцветени за колаген тип X (зелено) и Hoechst (син) се използва за определяне на ядрото на пребиваващата клетка и местоположението. Имунооцветяването показва повишена експресия на колаген тип X в AC на PBS- и HGP-инжектирани мишки, но не и HGP-CK2.1-инжектирани мишки. Мащабни ленти = 100 μm. AC ставния хрущял, HGP хидрогелни частици, MF медиална бедрена кост, MC мозъчна кухина, PBS буфериран с фосфат физиологичен разтвор, настолен компютър пателарна кухина, ШАМ фалшиво задвижван
DMM мишките, инжектирани с PBS, показват повишена експресия на остеокалцин, но не и тези, инжектирани с HGP-CK2.1. DMM мишки, инжектирани с PBS или HGP-CK2.1 (6 μM) или HGP, и мишки, подложени на фалшива употреба, бяха имунооцветени за остеокалцин (зелено) и Hoechst (син) се използва за определяне на ядрото на пребиваващата клетка и местоположението. Имунооцветяването показва повишена експресия на остеокалцин в AC на PBS инжектирани мишки, но не и HGP-CK2.1 инжектирани мишки. Мащабни ленти = 100 μm. AC ставния хрущял, HGP хидрогелни частици, MF медиална бедрена кост, MC мозъчна кухина, PBS буфериран с фосфат физиологичен разтвор, настолен компютър пателарна кухина, ШАМ фалшиво задвижван
Дискусия
ОА се характеризира с бавна прогресивна дегенерация на хрущялната тъкан. Това включва нарушаване на структурна и механична цялост, организирана около протеогликани и колагеновата рамка на фибриларните структури на колаген тип II, тип IX и тип XI [7]. Хирургичната дестабилизация на медиалния менискус при животните служи като модел на ОА [14]. Поради това използвахме DMM хирургия, за да индуцираме OA-подобно увреждане на AC. Въпреки това, докато моделите на нестабилност като DMM демонстрират значително увреждане на AC, трябва да се отбележи, че вътрешните клетъчни механизми, подобни на ОА, може да не възпроизвеждат естествената поява на заболяването по време на стареенето на ставите. Тези животински модели с ОА са склонни да развиват податливост към необичайно биомеханично натоварване след травма на ставите, включително регенеративни промени като реконструкция на субхондрална кост или образуване на остеофити [14]. Въпреки това, DMM моделът осигурява най-добра възпроизводимост и прогресивно разграждане на AC, емулиращ OA условията [14]. Поради тази причина в това проучване е използван DMM моделът. Освен това, за да сведем до минимум броя на вътреставните инжекции на пептида CK2.1, използвахме система с контролирано освобождаване на локализираното място на нараняване.
Заключения
ОА е идиопатично дегенеративно заболяване на хрущяла. В момента няма лекарства, които могат да възстановят изгубения хрущял. Използвайки сигналните пътища за фактора на растеж, изследователите се опитват да се справят с този проблем. Въпреки това, растежните фактори като BMP имат плейотропен характер и са известни с това, че подобряват диференциацията на хондроцитите и хипертрофията на хондроцитите. Проектирахме нов пептид, CK2.1, който активира BMPRIa в отсъствието на лиганда [31, 32]. Нашето предишно проучване демонстрира ефикасността на CK2.1-индуцирана хондрогенеза in vitro и растеж на хрущяла in vivo [13]. В това проучване демонстрираме ефикасността на CK2.1 за възстановяване на хрущяла в модел на мишка с ОА, който е сравним с фалшиво оперирани мишки без индуциране на хондроцитна хипертрофия. Тези резултати са в съответствие с предишното ни проучване [13]. Следователно имаме уникалната възможност да разберем сигналните пътища, които допринасят за образуването на хрущял и възстановяването на хрущяла. Този пептид, CK2.1, може също да бъде използван за бъдещо терапевтично развитие при лечение на дегенеративни заболявания на хрущяла.
- Хипокампалните неврони на невронални апоптозни инхибиторни протеини 1 (NAIP1) изтрити мишки показват
- Топ 5 протеинови прахове за мъже 2020 Актуализация
- Рецептор за повишаване на теглото, свързан с антипсихотично лекарство - новини от неврологията
- Weight Gainer Protein - Научете повече за Gainer Protein - Купете Weight Gainer Protein - Nutrition Express
- Кои са най-добрите евтини източници на протеин Вземете най-много пари за нашите пари с нашите топ 15