Резюме
Дефекти на предсърдната преграда (ASD) са често срещан вроден сърдечен дефект. По-голямата част от пациентите с ASD често следват неусложнен ход на събитията. Въпреки това, част от пациентите с ASD могат да имат своето състояние, усложнено от белодробна хипертония (PH), с последващо значително въздействие върху управлението, заболеваемостта и смъртността. Наличието на PH влияе върху годността за затваряне на дефекти. В този преглед ние описваме различните видове ASD, класификацията на PH, свързана с вродено сърдечно заболяване (CHD), когато затварянето на ASD е противопоказано и управлението на пациенти, които развиват белодробна артериална хипертония (PAH), включително най-екстремната форма, Eisenmenger синдром (ES).
Въведение
Дефектите на предсърдната преграда (ASD) са най-често срещаното вродено сърдечно заболяване (ИБС) след бикуспидална аортна клапа. Те представляват приблизително 13% от пациентите с ИБС (1). Има превес на жените със съотношение мъже към жени 1: 2. Повечето случаи обикновено са спорадични, въпреки че в някои случаи са замесени генетични мутации, особено в присъствието на други вродени дефекти и/или синдроми (2). Клиничната последица от тези дефекти е свързана с анатомичното местоположение, размера и свързаните сърдечни аномалии, когато има такива. За по-голямата част от пациентите с най-проста анатомия на ASD клиничното протичане често е доброкачествено, свързано с голяма вероятност за оцеляване до зряла възраст (3). В днешно време, с напредъка в пренаталния скрининг и феталната ехокардиография, ранната диагностика на живота позволява навременна намеса.
Въпреки това остават част от пациентите, които се представят за първи път в зрял живот. Когато се диагностицира в зряла възраст, ASD може да се представи като случайна находка. Въпреки това, част от пациентите имат симптоми като задух поради обемно претоварване на дясната камера (RV), дясна сърдечна недостатъчност, аритмии, парадоксална емболия и от време на време белодробна хипертония (PH).
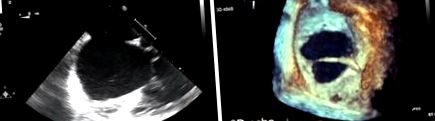
Най-често срещаният диагностичен инструмент е трансторакалната ехокардиография (ТТЕ), която очертава вида на дефекта, размера и състоянието на претоварване на дясната камера/обем. 3D реконструкция на ехокардиография се препоръчва при оценка на ASD, тъй като размерът може да бъде подценен при 2D трансторакална (TTE) или транзоезофагеална ехокардиография (TOE) (Фигура 1). Освен това се използват допълнителни неинвазивни образи, като сърдечно-съдов магнитен резонанс (CMR) или компютърна томография (CT), за да се изключат други често асоциирани сърдечни аномалии, като аномален белодробен венозен дренаж, за оценка на неочакван дефект на синусовия веноз, който не се вижда на TTE или множество ASD (4).
Оценка на размера на дефекта на предсърдната преграда. (А) Показва 2D трансоезофагеален ехокардиографски образ на вторичен ASD. (B) Показва 3D транзоезофагеален ехокардиографски образ на същия дефект, демонстриращ с по-голяма точност размера на дефекта и нишката, пресичаща дефекта, които не се виждат добре на 2D изображението.
ASD venosus ASD понякога се диагностицира за първи път при посещение за CMR за оценка на PH (5,6). В случаите, които пораждат подозрение за PH, било то при ехокардиография или клинично, е необходима катетеризация на дясно сърце, която да насочва по-нататъшното управление и намерението за затваряне на дефекти, ако е необходимо (7,8). Ако се установи белодробна артериална хипертония (PAH), пациентите може вече да не са подходящи за затваряне на дефекти и следователно трябва да следват алтернативна линия на управление, посочена в дискусиите, която следва (9,10).
Видове ASD
Анатомично „истинската“ предсърдна преграда е fossa ovalis, която покрива foramen ovale, докато останалата тъкан, разделяща предсърдията, е съставена от сгъване на предсърдната стена. Постоянен дефект на всяко ниво, в fossa ovalis или по остатъчните предсърдни стени, е известен като ASD, което води до директна комуникация между двете предсърдни камери, което позволява шунтиране на кръвта в двете посоки или дори двупосочно в някои обстоятелства (11).
На ембриологичния етап от живота fossa ovalis и по този начин предсърдното отделяне започва приблизително на петата гестационна седмица. Две прегради участват в затварянето на отвора на предсърдно ниво. Първо, septum primum възниква от горната част на общото предсърдие и нараства каудално, като в крайна сметка затваря отвора на „ostium primum“ между предсърдията. На второ място, септундът на преградата, който възниква от дясната предсърдна страна на преградата притум, се развива и покрива втория отвор, ostium secundum. Дефектите в fossa ovalis се класифицират като ASD от вторичен тип. Тези дефекти представляват над 70% от всички ASD. Могат да възникнат по-големи ASD от вторичен тип и да се простират отвъд ръбовете на fossa ovalis, в предсърдните стени, към долната или горната куха вена (SVC). По-голямата част от ASD на вторичен тип са изолирани и рядко се свързват с аномални белодробни венозни връзки (12).
По време на вътрематочното развитие преградата не покрива изцяло предсърдията, оставяйки foramen ovale патент и покрита само от лявата страна от преградата primum. При раждането, когато белите дробове се разширяват, намалявайки белодробното съдово съпротивление (PVR), има последващо покачване на системното съдово съпротивление, което води до обръщане на градиента на предсърдно ниво и по този начин септум примумът се задържа срещу септунда на преградата, като впоследствие се затваря предсърдният шънт. Ако този процес не се случи при раждането, резултатът е патентен форамен овал (PFO), с приблизителна честота от 25% до 30% при възрастни. Повечето пациенти са безсимптомни, въпреки че потенциално PFOs могат да бъдат замесени в различни клинични прояви, най-важното криптогенни инсулти (13).
Първични ASD се развиват, когато примумната преграда, докато расте каудално, не се слее с ендокардиалните възглавници, разположени между предсърдията и вентрикулите. Резултатът е дефект в основата на предсърдната преграда, който обикновено е голям. Общоприето е, че този тип лезия е част от атриовентрикуларен септален дефект (AVSD), почти винаги свързан с аномалии на атриовентрикуларните клапи и допринася или за частичен (само предсърден компонент), или за пълен (предсърден и вентрикуларен компонент) AVSD. Този тип дефект представлява приблизително 15% до 20% от ASD и има по-неблагоприятни дългосрочни резултати от ASD от вторичен тип (11).
Могат да се появят и дефекти по предсърдната стена, но извън ръбовете на fossa ovalis. ASD venosus тип ASD, по-нисък или по-горен, възниква, когато има неуспех на вмъкването на предсърдната стена непосредствено под отвора на SVC или долната (IVC) куха вена, съответно. Тези дефекти представляват 5% до 10% от предсърдната комуникация и почти винаги са свързани с частична аномална белодробна венозна връзка. Дефектите на долния синусов веноз са по-редки до по-добри и е по-вероятно да бъдат свързани с шунтиране отдясно наляво и цианоза, отколкото предишните (14).
Дефектите на синусовия веноз са свързани с аномално белодробно венозно връщане към SVC в случай на превъзходен дефект на синусовия веноз и на IVC в случай на дефект на долен синусов веноз.
Коронарният синус е крайният съд на венозния дренаж на сърцето, разположен отзад между лявото предсърдие и вентрикула, оттичащ се в дясното предсърдие. Дефект на коронарния синус, иначе известен като непокрит коронарен синус, възниква, когато част или цялата обща стена между коронарния синус и лявото предсърдие отсъства. Този дефект е рядък и представлява по-малко от 1% от ASD. Често се свързва с персистираща лявостранна горна куха вена или сложни вродени сърдечни дефекти (15).
PH, свързано с вродено сърдечно заболяване (ИБС)
PH е клинично разстройство, предизвикано от голям хетерогенен брой патофизиологични тригери, водещо до повишаване на белодробното артериално налягане, PVR, последваща дясна сърдечна недостатъчност и преждевременна смърт (16).
Хемодинамичната дефиниция на PH е средно белодробно артериално налягане (mPAP) от ≥25 mmHg в покой чрез катетеризация на дясно сърце. По-конкретно, дефиницията на PAH, която описва малка част от пациентите, показващи хемодинамични доказателства за прекапилярен PH, които, заедно с mPAP ≥25 mmHg, имат допълнителното изискване за налягане в белодробния капилярен клин (PCWP) от ≤15 mmHg и PVR от> 3 дървени единици (8).
Честотата на БАХ, свързана с ИБС (PAH-CHD) варира в географско отношение, но консенсусът на регистрите в световен мащаб изчислява, че до 10% от възрастните с ИБС развиват БАХ (17-19).
Патофизиологията при ИБС е резултат от прогресивно съдово ремоделиране от редица механизми в зависимост от основната лезия. При PAH-CHD често това се дължи на дефект с достатъчно голям шунт отляво надясно, за да позволи достатъчно увеличен белодробен кръвен поток, за да задейства патологичен механизъм, при който има повишен стрес при срязване, ендотелна дисфункция, хипертрофия на гладките мускули, пролиферация и прогресивно изкривяване на белодробната васкулатура, като по този начин допринася за развитието на БАХ (Фигура 2). С напредването на заболяването има последващо покачване на PVR и ако при катетеризация на дясното сърце това удовлетворява хемодинамичната дефиниция на PAH, то в повечето случаи заболяването е установено и необратимо (8).
Илюстрира микроструктурните промени на хипертрофията и пролиферацията на гладките мускули, замесени в развитието на белодробно съдово заболяване. (А) Демонстрира нормалната анатомия на белодробна артерия, вградена в белодробния паренхим. (Б) Демонстрира за разлика хипертрофията и фиброзата, водещи до вазоконстрикция.
Крайното в това е, когато значителен шунт отляво надясно продължава да издига PVR, за да достигне системни нива; след това шънтът се обръща в дясно наляво или двупосочен статус, като по този начин води до клинична цианоза и развитие на синдрома на Айзенменгер (ES). Понастоящем разпространението на ES варира от 25% до 50% в кохортата PAH-CHD (18,20,21). Важно е, че с напредъка в антенаталните грижи и феталния скрининг, все повече деца се раждат в подготвена среда, позволяваща оптимално време за хирургическа интервенция или се диагностицират при рутинен неонатален скрининг. Следователно, белодробната васкулатура е защитена от развитие на ES и разпространението намалява (16).
Класификация на PAH-CHD
Класификацията на PH е разработена за първи път през 1998 г., като се категоризират групи, които споделят подобни патологични, хемодинамични характеристики и последващи терапевтични подходи. Настоящата използвана система за класификация е финализирана на петата среща на Световната здравна организация (СЗО) през 2013 г. и се състои от пет групи. Група 1 е ясно обозначена като PAH. PAH-CHD е категоризиран в група 1, споделяйки хемодинамични характеристики, подобни на идиопатична PAH, наследствена PAH, PAH, свързана с други патологии като заболявания на съединителната тъкан, инфекции и индуцирана от лекарства PAH (22). Освен това PAH-CHD се описва допълнително чрез две системи за класификация, едната е система за клинична класификация, а другата е анатомо-патофизиологичната система (Таблица 1).
маса 1
| (I) Клинична класификация |
| Група А |
| Синдром на Айзенменгер |
| Група Б |
| Системно-белодробен шънт |
| Група С |
| ПАУ с малък дефект |
| ASD 1.5), след което PVR 2) се счита за безопасна граница за затваряне на шунта. Ако PVR е> 4,6 WU (PVRi> 8 WU/m 2), не се препоръчва затваряне. Обаче тези, които имат PVR между 2,3–4,6 WU (PVRi 4–8 WU/m 2), са по-малко ясни. Необходимо е да се разглежда за всеки отделен случай. Понякога може да се наложи да се помисли, че никоя интервенция не е по-добра за пациента, въпреки потенцирането на риска от обръщане на шунта навреме в посока отдясно наляво и позволявайки на ES да последва, макар и със значителна заболеваемост и усложнения хронично цианотично състояние, тъй като това има по-добра дългосрочна прогноза, отколкото потенциално погрешно затваряне на шунта и жертване на функцията „облекчаващ клапан“ на ASD (24). Някои стратегии предполагат частично хирургично затваряне или фенестрирано или клапанно перкутанно затваряне, позволяващо разтоварване/декомпресия на дясното предсърдие в случай на прекомерно нарастване на PVR след ремонта (Фигура 3) (28,29). |
2D и 3D трансоезофагеални (A, B, C, D) ехокардиографски изображения и 2D трансторакални четирикамерни изображения (E, F) на пред (A, C, E) и след (B, D, F) ASD затваряне с фенестрирано устройство (B, D, F) при пациент с белодробна хипертония (A; доплеров сигнал) и заболяване на лявата камера. Подобрения в дилатацията на дясната камера след затваряне на ASD се виждат в (F). ASD, дефект на предсърдната преграда.
Опитва се стратегията „лечение и възстановяване“, при която пациентите се лекуват с белодробни вазодилататори и след това се подлагат на затваряне на шунта през интервал след лечението (30). Съществуват обаче относително оскъдни данни за тази стратегия, насочени към пациенти с граничен PVR или благоприятни намаления при тестване на вазореактивност. Засега данните са ограничени до доклади от случаи или серии от случаи, поради което няма ясен консенсус, който да насочва клиницистите (31).
Несърдечни усложнения и управление
Пациентите с ASD, развиващи БАХ, имат клиничен ход и поредица от усложнения, които са променливи и зависят от размера, състоянието на възстановяването и степента на шунтиране при постоянни дефекти. Най-екстремната форма е ES, която се характеризира с многосистемно участие, утаено от хроничната хипоксемия (32). Пациентите изпитват широк спектър от симптоми, особено тези с ES, които включват диспнея, умора, замаяност и главоболие. Пациенти с ES имат по-висока заболеваемост в сравнение с общата популация и пациенти с нецианотична ИБС, макар и с по-дълъг процент на преживяемост в сравнение с другите форми на PAH-CHD (19,33).
Поредица от специфични усложнения и съображения са специфични за пациентите с ES. Те се състоят както от сърдечни, така и от несърдечни усложнения. Въпреки че пациентите с ES могат да оцелеят до шестото десетилетие от живота, те са обременени с високо ниво на заболеваемост и сложности, свързани с тяхната хронична хипоксемия.
Заключения
ASD са по-рядко свързани със значителна PH. Пригодността за затваряне на ASD, когато PVR е между 2,3 и 4,6 WU (PVRi 4-8 WU/m 2) не е ясна и вземането на клинични решения е индивидуализирано. Съображенията включват дали да се намеси с пълно затваряне на дефекти, фенестрирано затваряне или може да се обсъди стратегията „лечение и ремонт“. Когато PH е значим въпреки малък ASD или след своевременен ремонт на ASD, може да се счита за случайно. PH с малък/ремонтиран ASD има по-лоша прогноза от неремонтирания ASD. ES рядко е свързан с ASD, а когато е налице, се свързва с неблагоприятна прогноза в сравнение с посттрикуспидни лезии. Като цяло PAH, свързана с ASD, е свързана с висока заболеваемост и смъртност; пациентите трябва да бъдат наблюдавани отблизо в специализирани третични центрове чрез мултидисциплинарен екипен подход за постигане на оптимални резултати.
Благодарности
Финансиране: SV Babu-Narayan се подкрепя от British Heart Foundation (FS/11/38/28864).
- 5 неща, които сега знаем за белодробната артериална хипертония Джонсън; Джонсън
- Управление и лечение на предсърдно септален дефект (ASD) Клиника в Кливланд
- Видове дефекти на предсърдната септала, симптоми, диагностика, лечения
- 7 Рискови фактори за белодробна хипертония Новини за белодробна хипертония
- Дефект на предсърдната септала - какво трябва да знаете