Rogier L.C. Plas
1 отдел по човешко хранене и здраве, Университет Вагенинген, 6700 EV Wageningen, Холандия[email protected] (M.P.); [email protected] (J.M.); [email protected] (R.F.W.)
Mieke Полша
1 Отдел по хранене и здраве на човека, Университет Вагенинген, 6700 EV Wageningen, Холандия[email protected] (M.P.); [email protected] (J.M.); [email protected] (R.F.W.)
Джойс Фабър
2 Danone Nutricia Research, Nutricia Advanced Medical Nutrition, 3584 CT Утрехт, Холандия; [email protected] (J.F.); [email protected] (M.v.D.); [email protected] (A.v.H.)
Хосеп Аргилес
3 Група за изследване на рака, Departament de Bioquímica i Biologia Molecular, Facultat de Biologia, Universitat de Barcelona, 08193 Барселона, Испания; ude.bu@seligraj
Мириам ван Дейк
2 Danone Nutricia Research, Nutricia Advanced Medical Nutrition, 3584 CT Утрехт, Холандия; [email protected] (J.F.); [email protected] (M.v.D.); [email protected] (A.v.H.)
Алесандро Лавиано
4 Катедра по клинична медицина, Университет La Sapienza, 185 Рим, Италия; [email protected]
Jocelijn Meijerink
1 отдел по човешко хранене и здраве, Университет Вагенинген, 6700 EV Wageningen, Холандия[email protected] (M.P.); [email protected] (J.M.); [email protected] (R.F.W.)
Ренгер Ф. Виткамп
1 Отдел по хранене и здраве на човека, Университет Вагенинген, 6700 EV Wageningen, Холандия[email protected] (M.P.); [email protected] (J.M.); [email protected] (R.F.W.)
Арди ван Хелворт
2 Danone Nutricia Research, Nutricia Advanced Medical Nutrition, 3584 CT Утрехт, Холандия; [email protected] (J.F.); [email protected] (M.v.D.); [email protected] (A.v.H.)
5 NUTRIM училище за хранене и транслационни изследвания в метаболизма, Факултет по здравеопазване, медицина и науки за живота, Университет в Маастрихт, 6229 ER Маастрихт, Холандия
Класке ван Норен
1 отдел по човешко хранене и здраве, Университет Вагенинген, 6700 EV Wageningen, Холандия[email protected] (M.P.); [email protected] (J.M.); [email protected] (R.F.W.)
Свързани данни
Резюме
1. Въведение
Свързана с рак хиперкалциемия се наблюдава при до 30% от пациентите със злокачествени заболявания [1]. Много често това е придружено от повишена костна резорбция [2]. Калцият играе жизненоважна роля в много различни физиологични функции, например при свиването на всички видове мускулни клетки и невроналната сигнализация. При здрави индивиди плазмената концентрация на калций се регулира плътно от взаимодействието на паратиреоидния хормон (PTH), витамин D и калцитонин [2]. При пациенти със злокачествени нарушения калциевият баланс често се нарушава, което се отразява от повишените плазмени нива на калций [1]. Калцият е частично свързан с албумин и неговите плазмени нива се изразяват като коригирани нива на албумин (често срещани в клиничната практика) или като общи нива на Ca 2+ (свободни + свързани). Хиперкалциемията се определя при пациенти като лека за нива между 10,5 и 11,9 mg/dL (2,6–2,9 mmol/L), като умерена между 12 и 13,9 mg/dL (3,0–3,4 mmol/L) и като тежка над 14 mg/dL (3,5 mmol/L) серумен общ Ca 2+ [1,3]. Основната причина за свързаната със злокачествеността хиперкалциемия е дисбаланс в образуването и резорбцията на костите [3].
Най-разпространените клинични симптоми с хиперкалциемия се отнасят до неврологични, психиатрични, стомашно-чревни, сърдечно-съдови и бъбречни аномалии [2,3,4]. Неврологичните и психиатрични симптоми включват умора, летаргия, мускулно-скелетна болка, депресия и дори кома. Намалената подвижност на стомашно-чревния тракт може да причини запек и намален апетит. Сърдечно-съдовите симптоми включват сърдечни аритмии и хипертония. Освен това бъбречната недостатъчност често присъства при хиперкалциемия. Симптомите на хиперкалциемия често се наблюдават при пациенти с рак. Например при пациенти с множествен миелом серумните нива на калций са независим предиктор за качеството на живот, умората и физическото функциониране [5].
Има три предложени механизма, чрез които злокачествените заболявания могат да повлияят на баланса между включването на Са в костта и неговата резорбция [2]. Първият е свързан с повишена деградация на костите от остеокласти, които се активират от фактори, секретирани от метастази или първични тумори в или близо до костта. Вторият механизъм включва повишени нива на възпалителни медиатори като интерлевкин 6 (IL-6), простагландин Е2 (PGE-2) и на PTH-свързан протеин (PTHrP), които директно причиняват повишено разграждане на костите. Трета възможност се основава на връзката със съществуващия първичен хиперпаратиреоидизъм. От тези три предложени механизма, този, включващ PTHrP, секретиран от тумора, се счита за най-известния и отговорен за 80% от всички пациенти, свързани с злокачествено заболяване с хиперкалциемия [4].
2. Резултати
2.1. Ефект на левцин и рибено масло in vivo в експеримент A, B
2.1.1. Нива на калций и тяхната корелация с масата на трупа, масите на органи и мускулната функция на EDL.
Таблица 2
2.1.2. Плазмен PGE-2 и туморен PTHrP
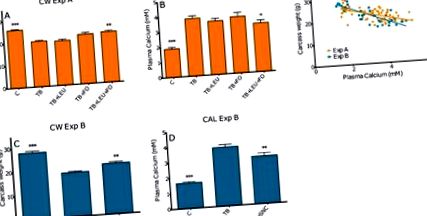
Съобщава се, че възпалителните медиатори като PGE-2 и PTHrP играят потенциална роля за появата на хиперкалциемия. Плазмените нива на PGE-2 са значително увеличени при туберкулоза в сравнение с контролните мишки, както се вижда на фигура 2 Б. Това увеличение е намалено при добавяне на рибено масло или с или без добавен левцин. Плазмените нива Ca 2+ и PGE-2 корелират значително (Pearson r = 0,6062 с p Фигура 2 F. Нивата на PTHrP на тумора са значително по-ниски при туберкулозни животни, които са получавали диети, обогатени с рибено масло и левцин в сравнение с туберкулозни животни без добавки, както се вижда в Фигура 2 C. Туморните нива на PTHrP не корелират с плазмените нива на Ca 2+, но трябва да се отбележи, че не са установени нива на PTHrP при контролните животни, тъй като те нямат тумор.
Ефект на левцин (LEU), рибено масло (FO) и комбинация от левцин и рибено масло върху плазмения PGE-2 (A); корелация между плазмените нива на PGE-2 и плазмените нива на Ca2 + (Pearson r = 0,6062 с p Фигура 3 A, B. Левцинът няма ефект върху производството на PTHrP in vitro, както се вижда на фигура 3 C. Нито един от компонентите не оказва влияние върху жизнеспособността или токсичността в тестваните концентрации, както се вижда на фигура S1. Като се има предвид, че DHA и EPA са установени като най-мощните за намаляване на PTHrP, те са включени в следващите експерименти. За да се тества последователността на находките и да се имитират ефектите на мощните компоненти DHA и EPA върху тумора, тествахме ефектите върху клетки с по-голямо сливане в експеримент D. Ефектът на EPA вече не присъстваше. Ефектът на DHA обаче беше възпроизводим в тези сливащи се клетки с намаления от 32% и 34 % при 50 μM DHA и 100 μM DHA, съответно, както се вижда на Фигура 3 D, E.
Ефект от добавянето на C26 клетки с DHA (A); и CXB (Б.) на нива PGE-2; и ефект от добавянето на CXB (° С) на нива на PTHrP. Данните представляват средна стойност ± SEM. *, ** и *** представляват значителни разлики с контрола на носителя (съответно р 5 клетки в 0,2 ml) са инокулирани подкожно в десния ингвинален фланг на мишките. Контролните (С) животни получиха фалшива инжекция с 0,2 ml HBSS. Животните се претеглят и обезболяват (изофлуран/N2O/O2) на 20-ия ден след инокулация на тумора. Скелетните мускули и вътрешните органи бяха разрязани и претеглени. Масата на трупа се изчислява чрез изваждане на туморната маса от телесната маса. Ex vivo EDL мускулната функция беше измерена при различни честоти, вариращи от 20 до 167 Hz. Тетанусът е достигнат при честоти ≥83 Hz.
3.1.3. Плазма PGE-2 и тумор PTHrP в експеримент А
При животни от експеримент А плазменият PGE-2 се измерва, използвайки търговски анти-PGE-2 заешки поликлонални антитела, базиран на директни ензимни имуноанализи (Oxford Biomedical Research, Oxford, MI, USA), съгласно протокола на производителя. Нивата на PTHrP в тумора на животни в експеримент А са измервани с помощта на количествен комплект за анализ на PTHrP ензимно-свързан имуносорбент (ELISA) (USCN Life Science Inc., Wuhan, Hubei, China) съгласно протокола на производителя. Нивата на PTHrP са изразени като количество на милиграм протеин, както се определя с помощта на протеинов комплект Pierce TM BCA (Thermo Fisher Scientific, Рокфорд, Илинойс, САЩ). За съжаление, количеството съхраняван плазмен материал е недостатъчно за определяне на плазмените нива на PTHrP.
3.1.4. Плазмен калций в експеримент A, B
За да се изследва дали повишаването на нивата на калций е свързано с телесните и органните маси и нивата на PGE-2, общите плазмени нива на Ca 2+ (свободен калций + калций, свързан с албумин) се определят калориметрично в Клинична лаборатория по химическа лаборатория Reinier de Graaf (Delft, Холандия).
3.2. Експерименти ин витро
За да определим възможните основни механизми, създадохме поредица от експерименти in vitro. Първо, тествахме основните компоненти, присъстващи в диетите, използвани при проучвания върху мишки, върху малък брой туморни клетки, както се вижда в експеримент В. Като контрол бяха проведени тестове за жизнеспособност и токсичност, за да се изключат потенциално токсичните ефекти на компонентите в тествани концентрации. Впоследствие продължихме с най-мощните съединения върху по-голям брой клетки, както се вижда в експеримент D, за да тестваме тяхната потентност в ситуации, по-подобни на ситуацията in vivo (т.е. туморът се състои от много голям брой клетки). И накрая, ние изследвахме възможния механизъм на действие на най-мощното съединение, както се вижда в експеримент Е, чрез оценка на възможното участие на COX-2 чрез използване на специфичен COX-2 инхибитор. В експеримент D, E се провеждат само тестове за токсичност.
3.2.1. Култура на миши C26 клетки
Всички in vitro експерименти бяха проведени с използване на миши С26 туморни клетки (American Type Culture Collection; ATCC, Tedington, UK). Клетките се култивират в DMEM с 10% топлинно инактивиран фетален говежди серум при 37 ° С в 5% CO2 овлажнена въздушна атмосфера. За допълване в експеримент C, D, E, клетките се посяват в плоча с 24 ямки. За експеримент С бяха засяти 25 000 клетки, водещи до сливане от 10–20% след 24 часа с достатъчно клетка-клетка. За експеримент D, E бяха засяти 250 000 клетки, водещи до сливане на 80–90% след 24 часа с висока степен на контакт клетка-клетка.
3.2.2. Производство на PTHrP и PGE-2 при добавяне на С26 клетки с DHA, EPA, левцин и CXB
След 24 часа инкубация, културалната среда от всяка ямка се отстранява и клетките С26 се допълват с контролно съединение или носител. Добавянето за 24 часа се извършва с различни концентрации или на докозахексаенова киселина (DHA, 22: 6n-3; Sigma-Aldrich, Sigma-Aldrich Chemie GmbH, Schnelldorf, Германия), ейкозапентаенова киселина (EPA, 20: 5n-3; Sigma-Aldrich Chemie GmbH), левцин (Sigma-Aldrich Chemie GmbH) или целекоксиб (CXB, Sigma-Aldrich Chemie GmbH). Етанолът се използва като разтворител за ω-3 PUFAs (DHA и EPA), DMSO се използва като разтворител за CXB и левцинът се разтваря в PBS. Във всички случаи крайната концентрация на етанол/DMSO никога не надвишава 0,1% v/v. Всички експерименти бяха проведени поне три пъти и всяко условие беше направено в два или три екземпляра. След 24 часа добавяне, супернатантата се отстранява за анализ на PTHrP и PGE-2. Производството на PTHrP в клетъчната супернатанта на С26 се измерва, като се използва търговски наличен ELISA (USCN Life Science Inc., Wuhan, Hubei, China) съгласно протокола на производителя. Производството на PGE-2 беше измерено с помощта на наличен в търговската мрежа моноклонален комплект ELISA (Cayman chemical, Ann Arbor, Michigan, USA).
3.2.3. Жизнеспособност и цитотоксичност
За експеримент С клетъчната жизнеспособност беше измерена с комплект за пролиферация на клетки (XTT) II (Roche, Базел, Швейцария), съгласно протокола на производителя. Клетките, засети в 24 ямкови плаки, се инкубират за 30 до 90 минути със сместа от реагенти XTT. След инкубация, 100 uL супернатант се прехвърля в 96-ямкова плака и абсорбцията се измерва при 450 nm с помощта на ELISA четец за плаки. Като отрицателна контрола, клетките се третират с Triton X100, което води до тотален лизис на клетките.
Цитотоксичността се измерва за всеки експеримент с комплекта за откриване на цитотоксичност (LDH) (Roche, Базел, Швейцария), съгласно протокола на производителя. Този комплект измерва относителното съдържание на LDH, налично в супернатанта, което отразява цитотоксичността. Супернатантът на клетките, засети в 24-гнездова плака, се прехвърля в 96-гнездова плака и се използва за измерване на LDH съдържанието. Абсорбцията се измерва при 492 nm с помощта на ELISA четец за плаки. Като положителен контрол, клетките се инкубират с Triton X100, което води до тотален лизис на клетките. Резултатите за жизнеспособност и цитотоксичност са докладвани на фигури S1 и S2.
3.3. Статистика
Всички данни са изразени като средна стойност ± SEM. Статистическите анализи бяха извършени с помощта на GraphPad Prism 5 (GraphPad Software Inc., La Jolla, Калифорния, САЩ). В експеримент А бяха използвани различни партиди животни. Следователно за всички параметри беше дефинирано, че е разрешено комбинирането на данните, което означава, че не е налице взаимодействие между групи и експерименти. За всички експерименти in vivo бяха направени сравнения, използвайки дисперсионен анализ (ANOVA) с тест за множествено сравнение на Dunnett с тумороносната група без хранителна добавка като справка. Разликите се считат за значими при р-стойност 2+ нива, корелирани отрицателно с масата на трупа и няколко органи. В допълнение, нивата на Ca 2+ положително корелират с плазмените нива на PGE-2. Освен това, хранителната комбинация намалява повишените плазмени нива на PGE-2 и нивата на PTHrP в туморната тъкан.
В литературата са докладвани само няколко проучвания за връзката между рибеното масло или основните му компоненти EPA и DHA и свързаната с тумори хиперкалциемия. В проучване от 1984 г. мишки, носещи простагландин, продуциращ HSDM1 фибросарком, са получили рибено масло с мехен с високо съдържание на EPA (EPA: DHA съотношение 2,4: 1). Тази намеса предизвика намаляване на плазмените нива на Ca 2+ при мишки, носещи тумор [16]. Тъй като хиперкалциемията е свързана с костната минерална плътност и намаляването на костната минерална плътност е добре позната характеристика на модела C26, ние също проучихме литературата относно съобщените връзки между лечението с рибено масло и минералната плътност на костите. Въпреки това, систематичен преглед на ω3 мастни киселини и остеопороза стига до заключението, че е трудно да се направят ясни заключения поради малкия брой проучвания и скромния размер на пробите [17]. При оцелелите от рак на гърдата се съобщава, че високи дози EPA и DHA намаляват костната резорбция [18]. Освен това е установено, че рибеното масло предотвратява метастази в рака на гърдата в костите и остеолитичните лезии в модел на ксенографт на човешка мишка [19].
В нашето проучване намалените нива на Ca 2+ се наблюдават само когато се комбинират левцин и рибено масло. Интересното е, че това предполага, че левцинът може да има допълнителен благоприятен ефект, но само в присъствието на рибено масло. Съобщава се, че левцинът влияе върху инсулиновата чувствителност на тъканите и увеличава освобождаването на инсулин [20]. Освен това изглежда, че инсулинът има антифосфатурен ефект [21]. Съобщава се, че in vivo приложението на PTH индуцира спад в тубулната реабсорбция на фосфат, което е обърнато чрез наслагване на евгликемична хиперинсулинемия във физиологичния диапазон [21]. Следователно ефектът на левцина върху хиперкалциемията може да се обясни с повишено освобождаване на инсулин, което води до повишена бъбречна абсорбция на фосфат.
Отрицателните корелации между теглото на трупа и нивата на калций и тези между мускулното тегло и калция показват, че кахексията и хиперкалциемията могат да бъдат свързани в нашия модел. Трудно е обаче да се посочи до каква степен те са свързани. По отношение на мускулната функция обаче е възможно да се коригира мускулната маса. Открихме висока обратна корелация между мускулната функция и хиперкалциемията за максимална сила, скорост на свиване и скорост на релаксация. Тази корелация остава след корекция за мускулна маса, макар и с по-ниски R стойности, което показва, че изглежда има независимо от масата съединение във връзката между нивата на калций и загубата на мускулна функция като част от синдрома на кахексията.
Предишни проучвания съобщават, че хиперкалциемията в модела С26 се медиира от IL-6 и PTHrP [31]. Ние осъзнаваме ограниченията на това проучване, тъй като не успяхме да измерим нито PTHrP, нито IL-6 в плазмата. От литературата знаем, че същият SNC е в състояние да намали плазмените нива на IL-6 в модела C26 [24]. Освен това, нашите резултати показаха, че хранителната комбинация от рибено масло и левцин намалява нивата на PTHrP в тумора. Смята се, че повишаването на PTHrP при злокачествено заболяване се медиира от повишаване на активността на COX-2 [8]. Следователно, силните положителни корелации на нивата на Ca 2+ с PGE-2, основен медииран от COX-2 медиатор на възпалението, може да предполагат, че PTHrP също участва в индуцирането на хиперкалциемия. За да проверим тази хипотеза, извършихме поредица от експерименти in vitro.
Здравето на костите и калциевата хомеостаза са важни фактори, засегнати от злокачествеността. В това проучване показахме, че индуцираната от тумор хиперкалциемия е силно корелирана с няколко резултата, свързани с кахексията. Ние също така показахме, че хранителна интервенция с високо съдържание на левцин и рибено масло може да намали вредното въздействие на тумора върху калциевата хомеостаза в модел на мишка C26 с тумор. Това е от клинично значение, тъй като калциевата хомеостаза може да окаже голямо влияние върху ежедневието на пациентите. В проучване на 686 пациенти с множествен миелом, серумните нива на калций са свързани с оценките за качество на живот (QOL), загуба на апетит, гадене/повръщане, физическо функциониране (p (356K, pdf)
- 12 най-добри храни с витамин А - богати на витамин А храни, които да добавите към вашата диета
- 5 най-добри риби за ядене на палео диета Риби за палео диета
- Богата на креатин диета забавя заболяването в SCA3 мишки SCAsource
- 5 ниски живачни риби, които се вписват плавно в почти всяка диета. Добре
- Богата на фитоестроген диета увеличава енергийните разходи и намалява затлъстяването при мишки с