Резюме
Събирането на микроорганизми, които живеят в съжителство в или върху тялото на гостоприемника, се нарича микробиота. При хората такова съжителство се наблюдава най-вече в червата, главно в дебелото черво. Чревният микробиом се придобива от околната среда и се модифицира най-вече чрез диетата. Има предварителни данни, които показват, че чревната микробия може пряко да повлияе на патогенетичните болестни процеси при сърдечна недостатъчност (СН). СН води до оток на стените на червата и регионална хипоксия, причинявайки промяна в микробната флора на червата, което може да инициира или увековечи определен патогенетичен процес при СН. Структурният компонент на самата микробиота, като липополизахариди или веществата, произведени от бактериите, като триметиламин N-оксид, е замесен в патогенезата на СН. Този процес се нарича „ос на сърцето-червата“ при СН. Манипулирането на чревната микробия или насочването на продукти от микробията може да се превърне в възможности за лечение на СН в бъдеще.
„Всички заболявания започват в червата.“
- Хипократ (460–370 г. пр. Н. Е.)
През последните години много изследователи описаха връзката между чревната микробиота и много заболявания, включително сърдечни заболявания, хипертония, диабет и затлъстяване. [1,2] Диетата е един от основните фактори, които влияят върху модела на чревната микробиота. [3 ] Тази статия разглежда как чревната микробиота влияе върху сърдечната недостатъчност.
Какво представлява човешкият чревен микробиом?
Събирането на микроорганизми, които съществуват едновременно в или върху тялото на гостоприемника, се нарича микробиота. [1] Има повече от 2000 вида коменсални организми (предимно бактерии), които съществуват едновременно с човешкото тяло, огромното мнозинство в червата. Здравият възрастен човек има приблизително 100 трилиона бактерии в червата, най-вече в дебелото черво. [1,4]
Чревният микробиом се придобива от околната среда, не е генетично придобит и червата обикновено са стерилни в утробата. Например плодът придобива различна микробиота по време на цезарово сечение и по време на вагинално раждане. [5] Впоследствие плодът придобива различни видове микробиоми в зависимост от диетата и средата, на която е изложен. [6,7]
Човешкият микробиом е доминиран от пет фила: Bacteroidetes, Firmicutes, Actinobacteria, Proteobacteria и Cerrucomicrobia. [1,8] Обикновено чревната микробиота е стабилна в индивида и семейството. В здравите черва анаеробните групи Bacteroidetes и Firmicutes допринасят за над 90% от общия брой бактериални видове. [8]
Какво решава модела на чревния микробиом на индивида?
Специфичните модели на чревната микробиота се наричат ентеротипове. [9] Нежелана промяна в чревния микробиом се нарича дисбиоза. [10] Един от най-важните фактори, който влияе върху ентеротипа, е дългосрочната диета на индивида. Например диетите с високо съдържание на животински протеини и мазнини ще покажат високи нива на Bacteroides и ниски нива на Prevotella (също част от рода Bacteroidetes). [11] Напротив, диетите с високо съдържание на въглехидрати и ниско съдържание на животински протеини и мазнини ще имат ниски нива на Bacteroides и високи нива на Prevotella. Друг пример за микробното взаимодействие между храната и червата се среща при японците. Червата им съдържат Bacteroides plebeius, който произвежда ензим, който подпомага храносмилането на водорасли. [12]
Други фактори, които оказват влияние върху микробния модел на червата, различни от диетата, са промените в околната среда, хигиената, употребата на антибиотици и болестните състояния. [1,6]
Как чревната микробиота влияе върху домакина
Чревният микробиом има много функции. [13] Една от функциите му е защитна функция чрез изместване на патогени, съревнование на хранителни вещества и рецептори и производство на антимикробни фактори. [1] Чревната микробиота отделя и някои витамини.
Една от най-важните функции на чревния микробиом е метаболитната, тъй като спомага за храносмилането на хранителните компоненти. Например, чревните бактерии участват в разграждането на захарите (например гликани, които са сложни захари, които не могат да се разцепват от никакви човешки ензими) чрез гликозид хидролаза. Чревната микробиота участва в храносмилателния процес на човека по два основни катаболни пътя - захаролитичен или протеолитичен. [14] И двата пътя водят до производството на късоверижни мастни киселини (SCFA). Вторият катаболен път също произвежда токсични молекули като амоняк, различни амини, тиоли, феноли и индоли, които се изчистват от бъбреците, но ще се натрупват, ако има бъбречна дисфункция. [1,14,15]
Разумно е да се разглежда микробиомът като „орган“, който тежи приблизително 1-2 кг, въпреки че е без отчетлива структура. Микробиомът непрекъснато произвежда съединения, някои от които се абсорбират и са биологично активни. По този начин той може да се разглежда като ендокринен орган, произвеждащ биологично активни образувания, които се дифузират в кръвния поток и действат на отдалечени места.
Чревната микробиота се отделя от lamina propria с един слой чревен епител. Чревният епител използва различни механизми за ограничаване на коменсалните бактерии до чревния лумен и за предотвратяване на егресията на тези микробиоти в подлежащата тъкан. [16] Чревната микробиота от своя страна се е развила, за да избегне имунната система на гостоприемника и да заобиколи антимикробния отговор на гостоприемника. [16]
Чревният бариерен механизъм играе двойна роля - той предпазва от инвазия на микроорганизми и абсорбция на бактериални токсини, но също така позволява усвояването на основни продукти, електролити и хранителни вещества. [17]
Чревната микробиота произвежда много вещества, които могат да проникнат в кръвта и впоследствие да повлияят на патобиологичните процеси. Пропускливостта на тези вещества зависи от функционалната и структурна цялост на лигавичната бариера. Потенциалните разрушители на бариерите включват хипоперфузия на червата, инфекции, токсини, лекарства и други фактори на начина на живот. [17] Понякога това може да бъде структурен компонент на самата микробиота, като липополизахариди (LPS) или пептидогликани, които взаимодействат с повърхностните клетки на лигавицата на гостоприемника чрез рецептори за разпознаване на модели. [1,18]
В допълнение, молекулите, произведени от микробни организми, също могат да получат достъп, за да предизвикат различни ефекти. Някои идентифицирани пътища включват път на триметиламин N-оксид (TMAO), път SCFA и път на жлъчните киселини. [1] Предшественикът на TMAO е l-карнитин или холин, който присъства в хранителни вещества като червено месо. Ако човек има висок прием на червено месо, производството на TMAO се увеличава, което е свързано с патогенезата на сърдечните заболявания. [2]
Как изследваме чревния микробиом?
Не е лесно да се изследва чревния микробиом, защото съдържа милиони бактерии и хиляди видове. Присъстват и гъбички и вируси, които могат да създадат трудности, тъй като техният генетичен материал пречи на идентифицирането на въпросния бактериален геном. Друг проблем с изучаването на чревния микробен геном е, че микробната общност е различна в различните региони на червата, а също и защото геномът се променя често поради хоризонтален трансфер на гени. [19]
Традиционният метод е културата, но е досаден и отнема много време. Бактериалното геномно секвениране е следващият най-подходящ метод. Един популярен метод е анализ на ампликон на ген на 16S рибозомна РНК (rRNA). Метагеномното секвениране, друг метод, който набира популярност, обикновено е по-скъп, но предлага повишена разделителна способност, позволявайки по-специфична таксономична и функционална класификация. [20] Wang et al. обясни това като: „16S рДНК последователност се опитва да разкрие„ кой е там? “в дадена микробна общност, докато метагеномното секвениране на пушка може да се използва, за да отговори на допълнителния въпрос„ какво могат да направят? “. [21]
Асоциация на чревната микробиота със сърдечни заболявания
Има много скорошни публикации за връзката между чревната микробиота и сърдечните заболявания, особено сърдечна недостатъчност. [22–26] Промените в чревната микробиота могат да доведат до развитието на рискови фактори за атеросклеротични съдови заболявания и пряко да повлияят на патогенетичните болестни процеси като остри коронарни синдроми и сърдечна недостатъчност. [27]
Затлъстяването е един пример. Нейната патология е свързана с промени в относителното изобилие на два доминиращи бактериални отдела, Bacteroidetes и Firmicutes. [28] Показано е, че пациентите със затлъстяване показват висок брой Firmicutes. Установено е също така, че затлъстелият микробиом има повишен капацитет за събиране на енергия от храната и че затлъстялата „черта“ е преносима: колонизацията на мишки без микроби със затлъстела микробиота води до значително по-голямо увеличение на общите телесни мазнини отколкото колонизация с постна микробиота, със същата диета. [29]
Освен това е установено, че хипертонията и диабетът имат асоциации със специфични микробни модели на червата и изследователите са открили определени връзки в патогенезата на тези заболявания и бактериалните взаимодействия. [22,30,31]
В проучване, сравняващо пациенти с ишемична болест на сърцето (ИБС) с тези, които не са установили, е установено, че при пациенти с ИБС делът на вида Bacteroidetes е по-нисък, с по-висок дял на Firmicutes. [32] Установено е, че повишените нива на TMAO са свързани с повишен риск от инцидентни големи неблагоприятни сърдечно-съдови събития (MACEs) в кохорта от 4007 пациенти, подложени на коронарна ангиография, проследявани в продължение на 3 години. [33] В друго проучване, кохорта от клиника в Кливланд от 530 пациенти, които се явяват в спешното отделение с болки в гърдите, показват повишени нива на TMAO в плазмата при представяне, които са независимо свързани с риска от MACE. [34] Известно е, че съотношението Bacteroidetes: Firmicutes се променя при всички хронични заболявания и следователно може да не е надежден идентификатор на определено заболяване.
Повишените нива на ТМАО са свързани с активирането на ендотелните и гладкомускулните клетки, образуването на пяна и миокардната и бъбречната фиброза. [2] В неотдавнашен систематичен преглед и мета-анализ (16 публикации, 19 256 пациенти), повишените концентрации на TMAO и неговите прекурсори са свързани с повишен риск от MACE и смъртност от всички причини, независимо от традиционните рискови фактори. [35] Друг мета-анализ и систематичен преглед на 26 167 пациенти също показват положителна дозозависима връзка между плазмените нива на TMAO и повишения сърдечно-съдов риск и смъртност. [36]
Асоциация на микробиотата със сърдечна недостатъчност
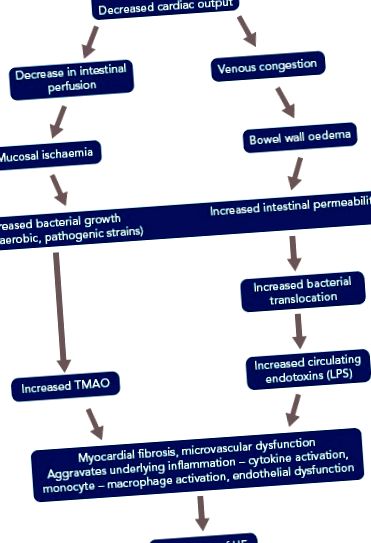
Чревната микробиота също е замесена в патогенезата на сърдечната недостатъчност (СН). При СН, поради намалената фракция на изтласкване, има намаляване на чревния кръвен поток и ниско доставяне на кислород. Това предразполага червата към растежа на патогенни видове анаеробни бактерии. [37] Пациентите с хронична СН също развиват оток на стените на червата поради венозна конгестия, която възпрепятства абсорбционната функция на червата и позволява бактериален свръхрастеж в слузния слой, съседен на апикалната повърхност на лигавицата на дебелото черво [36]. Повишена чревна пропускливост, оценена чрез теста за захарна целобиоза, също се съобщава при пациенти с СН и тази повишена пропускливост корелира с дясното предсърдно налягане и нивата на С-реактивен протеин. [38,39]
Тези бактерии произвеждат много вредни вещества, включително TMAO и ендотоксин (LPS), което предразполага или води до влошаване на СН. Тези открития доведоха до хипотезата за оста на сърцето и червата на СН (Фигура 1). [40,41] Установени са по-високи концентрации на LPS при пациенти с декомпенсиран СН, което корелира с повишеното ниво на оток на чревната стена, както е обсъдено по-рано. LPS намалява след „повторна компенсация“. Според Sandek et al., Това предполага причинно-следствена връзка между едематозната чревна стена, епителната дисфункция и транслоциращия LPS. [42]
СН = сърдечна недостатъчност; LPS = липополизахариди; TMAO = триметиламин N-оксид.
Високи нива на TMAO се откриват при пациенти с СН, които прогнозират по-висока дългосрочна смъртност, дори след адаптиране към традиционните рискови фактори и кардиореналните индекси. [41] Установено е, че TMAO е прогностичен фактор при пациенти със СН и по-високите нива предсказват лоша прогноза при 1-годишно проследяване. Комбинация от TMAO и традиционния маркер N-терминален про-мозъчен натриуретичен пептид са в състояние да предоставят допълнителна прогностична информация. [43]
Защо нивата на TMAO се повишават до такава степен в HF? Промените в бактериалния състав, както беше обсъдено по-рано, изглежда са основният двигател на нивата на ТМАО. [25] Бъбречното увреждане и променящите се хранителни режими също могат да допринесат. [25] Как TMAO влияе върху патобиологията на СН не е ясно. Предложените теории включват стимулиране на цитокини като фактор на туморна некроза-алфа, който може да влоши миокардната фиброза, микроваскуларна дисфункция в сърцето, независимо от нейните проатеросклеротични ефекти, неврохормонални нарушения и т.н., но все още нямаме ясен отговор. [25] ]
Можем ли да манипулираме чревния микробиом за лечение на болести?
Има някои изследвания за манипулация на чревния микробиом, които ни дават надежда за лечение на свързани заболявания. Манипулацията може да бъде постигната по много начини. Можем да променим диетата, за да променим вида на микробиотата, да насочим химикалите, произведени от чревната микробиота, или директно да променим микробната флора чрез добавяне на пробиотици.
Ако намалим червеното месо в диетата, намаляваме приема на холин и лецитин и по този начин намаляваме TMAO, което има положително въздействие върху риска от сърдечни заболявания. Например, преминаването към средиземноморска диета е доказано, че намалява маркерите на СН. Друг метод е да се прилагат неабсорбируеми антибиотици, които убиват специфична микробиота и по този начин променят цялостния микробен модел.
Пробиотиците са друг метод, който може да промени микробния модел на червата. Пробиотиците са живи полезни бактерии (бифидобактерии, лактобацили, стрептококи и непатогенни щамове на Escherichia coli), които могат да бъдат погълнати, за да създадат подходящ чревен микробен баланс. Има проучвания с използване на Saccharomyces boulardii при СН, които са показали полза. Положителните ефекти на пробиотиците обаче се отнасят само за ограничена група микробни видове и съществуват потенциални опасности, включително възможността тези микробиоти да бъдат превърнати в опортюнистични патогени при имунокомпрометирани индивиди. [44]
Текущото проучване Gut-Heart е рандомизирало 150 пациенти със стабилна СН и фракция на изтласкване на лявата камера Tang WH, Kitai T, Hazen SL. Чревна микробиота в сърдечно-съдовото здраве и заболявания. Circ Res. 2017; 120: 1183–96. doi: 10.1161/CIRCRESAHA.117.309715. [PMC безплатна статия] [PubMed] [CrossRef] [Google Scholar]
- Диетата и храненето влияят върху микробиома в лигавицата на дебелото черво; Новини-Медицински
- Диета и профилактика на исхемична болест на сърцето - транслационен подход - изглед в пълен текст
- Диетата на Елизабет Тейлър от 80-те не беше за хората със слаби сърца
- Пийте на сърцето си Топ 10 напитки, за да поддържате сърцето си здраво - Диета - Сърдечни заболявания
- Пиенето на две или повече газирани напитки на ден увеличава риска от проучване на инфаркта