Резюме
Цели/хипотеза
Ефикасността на диета с ниско съдържание на протеини (LPD) при диабетна нефропатия е противоречива. Ние имахме за цел да изследваме ренопротективните ефекти на LPD и основния молекулен механизъм в модел на плъх от диабет тип 2 и затлъстяване.
Методи
Диабетни мъжки Wistar мазни (фа/фа) плъхове (WFR) се лекуват със стандартна диета (23,84% протеин) или LPD (5,77% протеин) в продължение на 20 седмици от 24-седмична възраст. Изследвахме ефекта на LPD върху бъбречната функция, фиброзата, увреждането на тубуларните клетки, възпалението, митохондриалната морфология на проксималните тубуларни клетки (PTCs), апоптозата, автофагията и активирането на мишена на бозайници от рапамицин комплекс 1 (mTORC1).
Резултати
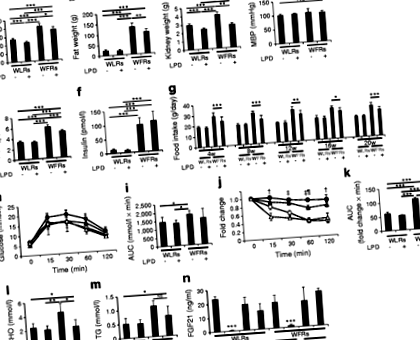
Бъбречното тегло, албуминурия, екскреция на свързващ протеин от мастни киселини от урината в черния дроб, нива на плазмен цистатин С и промени в бъбречната хистология, включително фиброза, тубулни клетъчни увреждания и възпаление, се влошават при WFR в сравнение с недиабетни плъхове Wistar (WLRs) ). Фрагментираните и подуващи се митохондрии, натрупани в PTCs и апоптозата се засилват в бъбреците на WFR. Имунохистохимичното оцветяване на p62 и p-S6 рибозомния протеин (p-S6RP) в тубулните лезии на WFR е увеличено в сравнение с WLR. Интервенцията на LPD ясно подобрява увреждането, както се вижда от оценката на бъбречната функция и хистологията, особено тубулоинтерстициалното увреждане на бъбреците с диабет. В допълнение, 5.77% LPD, но не и 11.46% LPD, значително потискат нивата на p-S6RP и повишават свързаните с микротубули нива на 3-II белтъчна лека верига в бъбречната кора. Интервенцията на LPD частично намалява нивата на HbA1c в WFR и не се наблюдават разлики в средния BP сред никоя от групите.
Заключения/тълкуване
Диета с много ниско съдържание на протеини подобри напредналите диабетни бъбречни увреждания, включително тубулоинтерстициални увреждания, чрез възстановяване на автофагията чрез потискане на пътя на mTORC1.
Въведение
Методи
Материали
За подробности относно материалите, моля, вижте методите за електронни допълнителни материали (ESM).
Експериментални животни
Мъжки и женски Wistar постно (фа/ +) плъхове (WLR) са предоставени от Биологичния институт на фармацевтичната компания Takeda (Осака, Япония) [28] и се поддържат в Медицинския университет в Каназава. Използвани са мъжки WFR за диабет и WLR, които не са съобразени с възрастта. На 24-седмична възраст плъховете бяха разделени на четири групи: (1) WLR, хранени със стандартна диета (STD); (2) WLR, захранвани с LPD; (3) WFR, захранвани със STD; и (4) WFR, захранвани с LPD. STD съдържа 23,84% протеин, 16,80% мазнини, 59,36% въглехидрати и 14,85 kJ/g енергия. LPD съдържа 5,77% протеин, 16,48% мазнини, 77,75% въглехидрати и 14,81 kJ/g енергия. Диетичната интервенция се извършва в продължение на 20 седмици. Също така използвахме чау, съдържащ 11,46% протеин, 16,58% мазнини, 71,97% въглехидрати и 14,81 kJ/g енергия за някои експерименти, а някои WFRs бяха хранени с 30% ограничена калории чау по време на експерименталния период.
Изследователският център за наука за живота на животните към Медицинския университет в Каназава одобри всички експерименти и всички експерименти бяха извършени в съответствие със съответните насоки и регламенти (за повече подробности вижте Методите на ESM.).
Биохимични измервания
Нивата на HbA1c бяха измерени с помощта на анализатор DCA 2000 (Siemens Medical Solutions Diagnostics, Токио, Япония) в края на експеримента. Тест за интраперитонеален глюкозен толеранс (IPGTT) и интраперитонеален инсулинов толеранс (IPITT) бяха направени на 20 седмица от интервенцията, както беше описано по-рано [29]. Уринарен албумин и свързващ протеин от мастна киселина от черния тип (L-FABP), плазмени нива на цистатин С, инсулин и фибробластен растежен фактор 21 (FGF21) бяха измерени с помощта на ELISA комплекти (вж. ESM методи).
Морфологичен анализ и имунохистохимия, Western blot анализ и PCR в реално време
Бъбречните секции бяха оцветени с трихром (MT)/периодична киселина – Шиф (PAS) на Masson и бе извършено имунохистохимично оцветяване с използване на антитела срещу CD68 (1:50), молекула на бъбречно увреждане-1 (KIM-1) (1: 100 ), p62 (1: 100) и p-S6 рибозомен протеин (S6RP) (1: 100), както е описано по-рано [28, 30, 31]. (За повече подробности за морфологичния и имунохистохимичния анализ вж. ESM методи.) Уестърн блотинг се извършва с използване на антитела към разцепена каспаза-3 (1: 1000), β-актин (1: 1000), p-S6RP (1: 1000), S6RP (1: 1000), p-Akt (1: 1000), Akt (1: 1000) и свързана с микротубули протеинова лека верига 3 (LC3) -I/II (1: 1000). Изолирането на обща РНК от бъбречната кора, синтез на cDNA и количествена PCR в реално време бяха извършени, както беше описано по-рано [28]. Сондите TaqMan за колаген тип III, CD68, IL-6, TNF-a, моноцитен хемотактичен протеин 1 (MCP-1) и тол-подобен рецептор 2 (TLR2) са закупени от Thermo Fisher Scientific (Waltham, MA, USA). Аналитичните данни бяха коригирани до нивата на експресия на 18S иРНК като вътрешен контрол.
Трансмисионна електронна микроскопия
Митохондриалната морфология и фрагментираните митохондрии в проксималните тубуларни клетки (PTC) са наблюдавани с помощта на трансмисионна електронна микроскопия, както е описано по-рано [28, 32]. (За повече подробности относно електронно-микроскопичната митохондриална морфология вижте ESM методи.)
Мониторинг на автофагозоми в бъбречни проксимални тубуларни клетки с помощта на трансгенни мишки LC3 – зелен флуоресцентен протеин
Мъжки мишки LC3-зелен флуоресцентен протеин (GFP) (C57BL/6 фон) са получени от Riken BioResource Center (Ibaraki, Япония). Дванадесет седмични мишки са били хранени със STD или диета с високо съдържание на мазнини (HFD) в продължение на 4 седмици; след това подмножество на HFD-хранени мишки бяха превключени на LPD за 2 дни. След 48 часа гладуване определихме автофагията в PTC, както беше описано по-рано [33].
Статистически анализ
Данните са изразени като средни стойности ± SD. ANOVA, последван от тест за множество сравнения на Tukey, беше използван, за да се определи значимостта на двойни разлики между три или повече групи и Student’s т тестът е използван за несдвоени сравнения. A стр стойност на
Резултати
Характеристики на експерименталните плъхове
Промени в екскрецията на албумин в урината и L-FABP и плазмен цистатин С
На 24-седмична възраст съотношенията на албумин в урината/креатинин и L-FABP/креатинин вече са по-високи при WFR, отколкото при WLR (Фиг. 2а, b). Нивата на екскреция на уринен албумин и L-FABP в WFR са значително повишени в сравнение с WLR след 20-седмична намеса на LPD (Фиг. 2а, b). LPD ясно намалява нивата на екскреция на албумин в урината и L-FABP в WFR, но ограничението на калориите с 30% няма същия ефект (фиг. 2а, б). Освен това, стойностите на екскрецията на L-FABP в урината бяха значително подобрени след 20-седмичната интервенция на LPD в сравнение със стойностите при 24-седмични WFR. Стойностите на екскрецията на албумин в урината обаче след намесата на LPD остават на почти същите нива като тези, наблюдавани при 24-седмични WFR. След интервенцията плазмените нива на цистатин С също са значително по-високи при WFR, отколкото при WLR, а намесата на LPD възстановява тези нива в WFR (фиг. 2в).
Промени в бъбречната фиброза и увреждане на тубуларните клетки
Представителни снимки на цели бъбреци и микромикрографии на оцветени с МТ бъбречни секции от плъхове на 24 седмици показват бъбречна хипертрофия при WFR (фиг. 3а). Показано е, че бъбречната фиброза, наблюдавана при оцветяване с МТ, и експресията на иРНК на тип III колаген са по-високи в бъбреците на WFRs в сравнение с WLRs по това време (Фиг. 3b – e). Резултатите от увреждане на тубуларните клетки, оценени чрез PAS оцветяване и KIM-1 имунохистохимично оцветяване и експресия на иРНК, също вече са значително по-високи при WFR, отколкото при WLR (Фиг. 3b, f – h). След 20-седмичната интервенция на LPD, бъбреците на WFR са значително по-големи от тези на WLR (фиг. 4а), а бъбречната фиброза и увреждането на тубуларните клетки постоянно се увеличават в бъбреците на WFR в сравнение с WLR (фиг. 4b – h). Интервенцията на LPD ясно подобри всички тези напреднали бъбречни наранявания при WFR.
Промени в възпалението в бъбреците
Резултати от имунохистохимично оцветяване на CD68 в тубулоинтерстициални лезии и експресия на иРНК, свързани с възпаление гени, включително Cd68, Mcp1 (също известен като Ccl2), Tnfa (също известен като Tnf) и Tlr2 в бъбречната кора вече са значително по-високи в WFRs в сравнение с WLRs в 24-седмични плъхове (Фиг. 5a-f). След експерименталния период от 20 седмици, бъбречно възпаление, както е показано от CD68 имунохистохимично оцветяване и експресия на иРНК на Cd68, Mcp1, Tnfa, Tlr2 и Il6, постоянно се влошава в бъбречната кора на WFR в сравнение с WLR (фиг. 5g – m). Въпреки това, намесата на LPD почти напълно отменя бъбречното възпаление при WFR.
Промени в митохондриалната морфология в PTC, гломерулна базална мембрана и подоцити и апоптоза в бъбреците
Митохондриалната морфология е променена в PTCs на WFR: наблюдавани са фрагментирани митохондрии, митохондриално подуване и увеличен брой PTC без удължени митохондрии (Фиг. 6а, б). LPD подобрява промените в митохондриалната морфология и се наблюдават автофагозоми при WFR, хранени с LPD (фиг. 6а). Дебелината на гломерулната базална мембрана беше значително увеличена при WFR, а в гломерулите на WFR се наблюдава отпадане на процеса на подоцитното стъпало. Промените в гломерулната базална мембрана и процеса на подоцитното стъпало при WFR са коригирани чрез лечение с LPD (Фиг. 6в). Освен това, апоптозата, определена от разцепеното съдържание на каспаза 3, се увеличава в бъбречната кора на WFR и LPD подобрява апоптозата при WFR (Фиг. 6г, д).
Промени в автофагията и активирането на mTORC1 пътя в бъбреците
Имунохистохимичното оцветяване за p62 е значително подобрено както при тубулни лезии, така и при гломерулни подоцити на WFR, а LPD подобрява интензивността на p62 оцветяване в бъбреците на WFR (фиг. 7а, б).
Имунохистохимичното оцветяване за p-S6RP (молекула надолу по веригата на mTORC1) също се увеличава както в тубулните лезии, така и в гломерулните подоцити на WFR, а LPD намалява оцветяването до ниво, подобно на това, наблюдавано при WLR (фиг. 7а, в). Нивата на p-S6RP са били увеличени в бъбречната кора на WFR в сравнение с WLR, но са били значително намалени след превключване на диетата от STD на 5,77% LPD само за 2 седмици (фиг. 7г, д). В допълнение, няма разлика в нивата на p-Akt протеин между STF- и LPD-захранвани WFR (Фиг. 7d, f). Нивата на LC3-II също са значително увеличени от LPD, което показва, че LPD индуцира автофагия в бъбречната кора (Фиг. 7d, g). Въпреки това, 11,46% LPD не предизвиква потискане на p-S6RP или увеличаване на нивата на LC3-II в бъбреците (фиг. 7h – j).
В допълнение, мишките, хранени с HFD в продължение на 4 седмици, показват намаляване на 48-часовата автофагия, причинена от глад при PTC, в сравнение с мишки, хранени със STD. Въпреки това, при тези мишки преминаването от HFD към LPD за 2 дни възстанови предизвиканата от глад автофагия в PTC. По този начин, LPD индуцираната автофагия в PTCs на LC3-GFP трансгенни мишки (Фиг. 7k).
Дискусия
В това проучване демонстрирахме, че диетичната интервенция с LPD драстично подобрява напредналите бъбречни увреждания, предизвикани от диабет, чрез възстановяване на автофагията чрез потискане на mTORC1.
LPD може да повлияе на метаболизма, тъй като представлява диета с високо съдържание на въглехидрати в сравнение със STD. Неотдавнашни проучвания при мишки обаче показват, че ad libitum високо въглехидратни LPD подобряват метаболизма на глюкозата и липидите и дълголетието [39]. В настоящото проучване телесното тегло, теглото на мазнините, нивата на HbA1c и общия холестерол бяха намалени в WFR, хранени с LPD, в сравнение с WFR, хранени със STD. Освен това, повишените нива на FGF21 могат да бъдат свързани с метаболитно подобрение, предизвикано от LPD. Laeger et al демонстрират, че серумните нива на FGF21 специфично се повишават при излагане на LPD, независимо от общия прием на калории, както при гризачи, така и при хора [40]. FGF21 оказва благоприятно въздействие върху енергийния метаболизъм, като увеличаване на усвояването на глюкоза в мастната тъкан и намаляване на телесното тегло чрез увеличен разход на енергия [41]. Въпреки че не са наблюдавани разлики в нивата на FGF21 на гладно сред четирите групи, нивата на FGF21 на гладно както в WLR, така и в WFR, хранени с LPD, не са намалени; обаче те бяха намалени в WLR и WFR, захранвани със STD. По този начин ние предлагаме както намаляването на приема на храна, така и непрекъснатите високи нива на FGF21 да бъдат свързани с понижаване на нивата на кръвната глюкоза и телесното и мастното тегло при WFR.
В заключение, това проучване ясно показва, че VLPD е полезна диетична терапия за подобряване на напреднала диабетна нефропатия чрез възстановяване на автофагията чрез потискане на пътя mTORC1 при животински модел на диабет тип 2 и затлъстяване. Някои пациенти с напреднала диабетна нефропатия бързо преминават към терминален стадий на бъбречно заболяване, въпреки че са получили адекватно многофакторно лечение. Следователно, VLPD без недохранване трябва допълнително да се разглежда като клинично значимо средство за потискане на спада в бъбречната функция по време на напреднала диабетна нефропатия. Възможно е обаче да има някои проблеми, свързани с дългосрочната употреба на VLPD при пациенти, включително саркопения, немощ или загуба на протеинова енергия, както и проблеми, свързани с придържането към VLPD. Все още е неизвестно кои аминокиселини трябва да бъдат ограничени за най-голяма повторна защита. Следователно са необходими допълнителни проучвания за разрешаване на тези точки и за разработване на по-полезни диетични протоколи или заместители на VLPD за напреднали стадии на диабетна нефропатия.
- Диета, богата на рибено масло и левцин, подобрява хиперкалциемията при индуцирани от тумор кахектични мишки
- Остри ефекти от диета с много ниско съдържание на протеини върху нивата на FGF23 Рандомизирано проучване Американско общество на
- Примерно меню за диета на Аткинс - Примерно меню за въвеждане на диети за Аткинс
- 3-дневен план за диабетно хранене за започване на кето диета с ниско съдържание на въглехидрати
- Сърдечна метаболитна модулация при нисковъглехидратна нискобелтъчна кетогенна диета при диабетични плъхове