Резюме
Заден план
Целта на това проучване е да се изследват ефектите от диета с ниско съдържание на протеини (LPD), започвайки от ранна възраст върху диабетичния статус и бъбречното увреждане при модел на плъх от диабет тип 2 и затлъстяване.
Методи
Диабетни мъжки Wistar мазни (фа/фа) плъхове (WFR) са хранени със стандартна диета (23,84% протеин) или LPD (5,77% протеин) в продължение на 24 седмици, започвайки на 6-седмична възраст. Изследвахме ефектите на LPD върху общото телесно тегло (BW); тегло на мазнините (FW); мускулно тегло на долните крайници (MW); няколко измервания на диабетичния статус, включително нива на глюкоза на гладно/произволно, HOMA-IR и IPITT; и бъбречни наранявания, включително бъбречна хипертрофия, албуминурия и хистологични промени. В допълнение, автофагията и активирането на mTORC1 бяха оценени в диабетната бъбречна кора. Освен това бяха оценени плазмените нива на адипонектин FGF21 и високомолекулни (HMW), както и нивата на експресия на UCP1 в кафява мастна тъкан (BAT).
Резултати
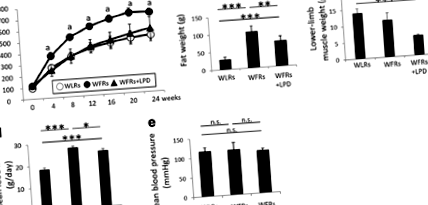
Увеличенията на BW и FW в WFR бяха значително намалени от LPD и LPD доведе до значително намаляване на MW на долните крайници в WFR. LPD потиска повишаването на нивата на глюкоза в WFR чрез подобряване на инсулиновата резистентност. LPD също повишава плазмените FGF21 и HMW адипонектин на WFR, както и експресията на UCP1 в НДНТ на животните. Бъбречна хипертрофия, албуминурия, бъбречни хистологични промени и повишена експресия на p62 и фосфо-S6 рибозомния протеин (p-S6RP) са наблюдавани при WFRs в сравнение със стойностите от WLR. LPD явно предотвратява увреждането на бъбреците с диабет.
Заключения
LPD предотврати прогресирането на диабетичния статус; този ефект може да е бил свързан с намаляване на FW и повишаване на плазмените FGF21 и HMW адипонектин, както и експресия на UCP1 в НДНТ, което води до потискане на диабетната нефропатия. Въпреки това, MW е намален при плъхове от консумацията на LPD от ранна възраст; следователно са необходими допълнителни проучвания за разрешаване на хранителния въпрос на LPD при намаляването на MW.
Заден план
Броят на пациентите с диабет тип 2 се увеличава в световен мащаб. Диабетът тип 2 е тясно свързан със затлъстяването и неотдавнашното нарастване на разпространението на диабет тип 2 в световен мащаб до голяма степен отразява нарастването на затлъстяването. Диабетните съдови усложнения включват микроангиопатия, като ретинопатия, невропатия и нефропатия, както и макроангиопатия, базирана на атеросклероза. Сред тези диабетни съдови усложнения диабетната нефропатия се развива при 40% от пациентите с диабет и остава водеща причина за терминална бъбречна болест (ESRD) [1]. В допълнение, степента на заболеваемост от сърдечно-съдови заболявания (ССЗ) при пациенти с диабетна нефропатия е висока, което допринася за смъртността. Съществува порочен кръг между хронично бъбречно заболяване (ХБН), включително диабетна нефропатия и ССЗ [2], тъй като такива пациенти страдат не само от диабет, но и от затлъстяване, дислипидемия, хипертония и други състояния, които са признати за често срещани рискови фактори, свързани с прогресия на ХБН и ССЗ. Ето защо се препоръчва многофакторно лечение за контрол на множеството рискови фактори и поддържане на сърдечно-бъбречното метаболитно здраве за профилактика както на диабетна нефропатия, така и на ССЗ [3,4,5].
Методи
Експериментални животни
Биохимични измервания
Нивата на HbA1c бяха измерени с помощта на анализатор DCA 2000 (Siemens Medical Solutions Diagnostics, Токио, Япония) в края на експеримента. Уринарният албумин, плазменият инсулин, FGF21 и адипонектинът с високо молекулно тегло (HMW) бяха измерени с помощта на комплекти ELISA (пикочен албумин: NEPHRAT II, Exocell, Inc., Филаделфия, Пенсилвания, САЩ; плазмен инсулин: Morinaga Institute of Biological Science, Inc ., Kanagawa, Япония; плазмен адипонектин: SHIBAYAGI Co., Ltd., Gunma, Япония). Общият холестерол в плазмата (T-CHO) и триглицеридите (TG) се измерват с помощта на комплект Pureauto S TG-N (Sekisui Medical, Токио, Япония) и комплект за H-тест за холестерол от L-тип (Wako Pure Chemical Industries, Osaka, Japan ). Креатининът в урината (Cr) е измерен чрез ензимни методи. Формулата за оценка на модела на хомеостаза на HOMA-IR беше (плазмена глюкоза на гладно × плазмен инсулин на гладно)/405.
IPGTT и IPITT
IPGTT и IPITT бяха извършени след 24 седмици интервенция, както беше описано по-рано [16]. Накратко, за тестове за толерантност към глюкоза, плъховете са гладували в продължение на една нощ в продължение на 16 часа, последвано от интраперитонеална инжекция с глюкоза (1 g/kg телесно тегло). Кръвната глюкоза се измерва с помощта на опашната кръв, събрана на 0, 15, 30, 60 и 120 минути след инжектирането. За тестове за инсулинова толерантност плъховете се инжектират интраперитонеално с редовен човешки инсулин (Novolin R; Novo Nordisk, Clayton, NC) при 0,75 U/kg телесно тегло след 6-часов пост и кръвната глюкоза се измерва 0, 15, 30 и 60 минути по-късно.
Морфологичен анализ
Бъбречните секции бяха оцветени с трихром на Masson’s (MT). За полуколичествената оценка на фиброзата на бъбреците чрез оцветяване с МТ в 10 произволно избрани гломерули или тубуло-интерстициални области на плъх, процентите на областите, оцветени за фиброза, се класифицират, както следва: 0, 0 до 5% оцветяване; 1,5 до 25%; 2, 25 до 50%; 3, 50 до 75%; и 4,> 75% [16].
PCR в реално време
Изолирането на обща РНК от бъбречната кора или кафява мастна тъкан (BAT), синтез на cDNA и количествена PCR в реално време се извършват, както е описано по-горе [16]. Сонди TaqMan за колаген тип 3 (Col3) (Идентификатор на продукта: Rn01437681), Cd68 (Rn01495634), интерлевкин-6 (Il6) (Rn01410330), CC мотив хемокинов лиганд 2 (Ccl2) (Rn00580555), Toll-like4 рецептор 4 (Tlr) ) (Rn00569848), молекула на бъбречно увреждане-1 (Kim-1) (RN00597703) и разединяващ протеин1 (Ucp1) (Rn00562126) са закупени от Thermo Fisher Scientific (Waltham, MA, USA) [16]. Аналитичните данни бяха нормализирани до нивата на експресия на mRNA от 18 s (Rn03928990) като вътрешен контрол.
Уестърн блотинг
Уестърн блотинг се извършва с използване на антитела срещу p62 (1: 1000), β-актин (1: 1000), фосфо-S6 рибозомен протеин (S6RP) (1: 1000) и S6RP (1: 1000), както е описано по-рано [16 ]. Анти-p62 антитялото е получено от Медицински и Биологични Лаборатории (Нагоя, Япония). Анти-β-актин, анти-фосфо-S6RP и анти-S6RP антитела са получени от Cell Signaling Technology (Danvers, MA, USA). Anti-UCP1 антитяло е закупено от Abcam (Кеймбридж, Масачузетс, САЩ).
Статистически анализ
Данните са изразени като средно ± стандартно отклонение (SD). ANOVA, последван от тест за множество сравнения на Tukey, беше използван за определяне на значимостта на разликите между три или повече групи и Student’s т-тестът е използван за несдвоени сравнения. A стр стойност на
Резултати
LPD намалява метаболитните нарушения при плъхове с диабет и затлъстяване
Плазмените нива на адипонектин FGF21 и HMW и експресията на иРНК на UCP1 в НДНТ са повишени в WFR, захранвани с LPD
Концентрациите на адипонектин в плазмата FGF21 и HMW бяха измерени след 16-часово бързо и при произволно избрани времена след хранене (започващи в 10:00 AM) след 24-седмичната диетична интервенция. Не се наблюдават разлики в нивата на FGF21 на гладно сред трите групи плъхове (Фиг. 3а). Въпреки че плазмените нива на FGF21 са значително намалени след прием на храна в WLR и WFR, хранени със STD, тези промени в FGF21 след прием на храна не са наблюдавани в WFR, хранени с LPD (Фиг. 3а). В допълнение, плазмените нива на адипонектин HMW след 16-часовото гладуване са значително по-ниски при WFR, отколкото при WLR. При WFR, хранени с LPD, плазмените нива на адипонектин HMW показват значително по-голямо увеличение от тези на WLR или WFR, хранени със STD (фиг. 3b). За разлика от това не са наблюдавани разлики в нивата на плазмения HMW адипонектин в произволно избрани времена сред 3-те групи плъхове (Фиг. 3b). Тези данни предполагат, че LPD допринася за повишаване на плазмения FGF21 и HMW адипонектин. Освен това, както експресията на mRNA на Ucp1, така и експресията на протеин на UCP1 са значително увеличени в НДНТ на WFR, третирани с LPD, в сравнение с тази на WFR, хранени със STD (Фиг. 3c-e).
Промени в бъбречната морфология, екскреция на албумин в урината и бъбречно увреждане
Дискусия
В това проучване ние демонстрирахме, че LPD, прилаган от ранна възраст, предотвратява повишаването на нивата на глюкозата и подобрява инсулиновата резистентност и дислипидемия при животински модел на диабет тип 2 и затлъстяване, плъхове Wistar мазнини. Тези подобрения в диабетичния статус могат да бъдат свързани с повишена плазмена експресия на FGF21, HMW адипонектин и UCP1 в НДНТ на WFR. В допълнение, прилагането на LPD от ранна възраст предотврати прогресирането на диабетни бъбречни наранявания, включително гломерулни и тубуло-интерстициални увреждания. Освен това LPD доведе до намаляване на теглото както на мазнините, така и на мускулите при WFR.
В допълнение към подобряването на системните метаболитни промени, включително метаболизма на глюкозата, предишни доклади демонстрират, че FGF21 предпазва от индуцирани от диабет бъбречни увреждания чрез антифибротични, противовъзпалителни и антиоксидативни стресови ефекти при db/db мишки и при мишки с диета- индуцирано затлъстяване и диабет тип 2 [43, 44]. Следователно, нашите данни също показват, че LPD може да предпази от диабетна нефропатия както индиректно, така и директно чрез индукция на FGF21.
Заключения
LPD, приложен от най-ранна възраст, предотвратява прогресирането на диабетичния статус и увеличаването на теглото на мазнините, което може да е свързано с повишен плазмен FGF21 и HMW адипонектин, както и свръхекспресия на UCP1 в НДНТ, което води до потискане на диабетно увреждане на бъбреците в WFR. Въпреки това, механизмът, чрез който LPD потиска честотата на диабет, не е напълно изяснен. Освен това може да има някои проблеми, свързани с дългосрочен LPD, включително недохранване или саркопения. Следователно са необходими допълнителни проучвания за разрешаване на тези точки и за разработване на по-полезни диетични протоколи или заместители на LPD за метаболитно здраве и повторна защита.
- Благоприятен ефект от елементарната диетична терапия с ниско съдържание на мазнини върху болката при хроничен панкреатит
- Асоциация между социално-икономическия статус и качеството на диетата при мексиканските мъже и жени
- 12 основи за създаване на диетична диета за ежедневието
- Полезни бактерии Как да добавите кисело зеле към вашата диета
- Анална евакуация на газове и микробиота на дебелото черво при пациенти с ефект на метеоризъм при диета Gut