Субекти
Резюме
Предистория/цели:
Няма съобщения за проспективно проучване на дългосрочните ефекти на стомашната резекция върху стомашно-чревните хормонални промени при пациенти с нормално телесно тегло. Целта на това проучване е да се оцени 1-годишният ефект на субтоталната гастректомия върху нивата на грелин и пептид YY (PYY) 3−36.
Предмети/методи:
Осемнадесет пациенти с ранен рак на стомаха са претърпели субтотална гастректомия с реконструкция на Billroth I. Оценихме апетита, приема на храна, състава на тялото и нивата на грелин и PYY3–36 преди операцията и 1 година след операцията.
Резултати:
Няма значителна разлика в предоперативния дневен прием на храна и 1 година след субтоталната гастректомия. Загуба на тегло настъпила при всички изследвани субекти; 11,7% (н= 2), 55,5% (н= 10) и 33,3% (н= 6) от пациентите са загубили съответно 10% от предоперативното си телесно тегло. Индексът на телесна маса, обиколката на талията и телесните мазнини значително намаляват 1 година след субтоталната гастректомия. Няма значителни разлики в скалата за визуален аналог на апетита преди операцията и 1 година след субтоталната гастректомия. Плазмената концентрация на грелин е намаляла значително (P= 0,006), докато PYY3−36 не показва значителна промяна 1 година след субтоталната гастректомия.
Заключения:
Нивата на грелин и телесните мазнини намаляват значително, докато нивата на PYY3−36, както и апетитът и приема на храна не се променят значително 1 година след субтоталната гастректомия с нормално телесно тегло. Тези открития предполагат, че намаленият грелин може да допринесе пряко за намаляване на телесните мазнини.
Въведение
Грелинът, 28-аминокиселинен пептид с n-октаноилиране, необходимо за биологичната му активност, се произвежда главно от стомаха и допринася за 70% от циркулиращата концентрация на грелин (Jeon et al., 2004). Доказано е, че грелинът индуцира не само освобождаването на растежен хормон от хипофизната жлеза, но и повишава апетита и стимулира наддаването на тегло (Wren et al., 2000) Пептидът YY (PYY) 1–36 се освобождава в циркулацията от L-тип ендокринни клетки на дисталното черво (Adrian et al., 1985). След освобождаване, биологично активен PYY3–36 се образува чрез разцепване на N-крайните остатъци от дипептидил пептидаза IV (le Roux and Bloom, 2005). В допълнение към различни потискащи функции в стомашно-чревния тракт, PYY3–36 индуцира физиологична постпрандиална ситост чрез контрарегулация на освобождаването на грелин чрез Y2-рецептора в хипоталамуса (McGowan and Bloom, 2004).
Съобщава се, че стомашно-чревните хормони, като грелин и PYY3–36, играят важна роля при определянето на приема на храна и телесното тегло (Wren et al., 2000; McGowan and Bloom, 2004). Въпреки това, малко се знае за дългосрочните ефекти на стомашната резекция върху тези пептиди. Според предишни проучвания отстраняването на целия стомах при хора намалява плазмената концентрация на грелин с 65%, 1–8 години след операцията (Ariyasu, 2001); гастректомия на ръкавите също намалява плазменото ниво на грелин и увеличава PYY3–36 при пациенти със затлъстяване (Karamanakos et al., 2008). Трябва да се отбележи, че тези открития отразяват ретроспективно кохортно проучване, при което са сравнени пациенти, които са били подложени на резекция на стомаха и здрави контроли или пациенти, подложени на бариатрична хирургия за намаляване на теглото при пациенти със затлъстяване Не са докладвани проспективни проучвания на дългосрочните ефекти на стомашната резекция върху стомашно-чревните хормонални промени при пациенти с нормално телесно тегло. Следователно, ние оценихме проспективно промените в концентрациите на грелин и PYY3–36 предоперативно и 1 година след резекция на стомаха при пациенти с ранен рак на стомаха, претърпели субтотална гастректомия.
Методи
Пациентите с ранен рак на стомаха, които са претърпели субтотална гастректомия в Националната университетска болница в Пусан между януари 2004 г. и декември 2005 г., включват изследваните субекти. Ранният рак на стомаха се определя от Японското изследователско дружество за рак на стомаха като рак, при който туморните клетки нахлуват само в лигавичните и субмукозните слоеве (Японска асоциация за рак на стомаха, 1998).
Субтоталната гастректомия се определя като хирургично отстраняване на дисталните две трети от стомаха; методът на възстановяване на храносмилателната приемственост е гастродуоденостомия на Billroth I. Пациентите с ендокринни заболявания, като захарен диабет, заболяване на щитовидната жлеза и хипофиза, бяха изключени от това проучване, както и пациентите с тумори с диаметър> 2 cm. Писмено информирано съгласие е получено от всеки субект преди записване в това проучване. Изследването е одобрено от институционалния преглед на Института за медицински изследвания към Националния университет в Пусан и е извършено в съответствие с Декларацията от Хелзинкските принципи.
Всички изследвани субекти бяха оценени за прием на храна, телесен състав, апетит и стомашно-чревни хормони (грелин и PYY3-36) преди операцията и 1 година след операцията. Средният период на проследяване е 12,1 месеца (s.d., 2,3 месеца). От 21 пациенти 3 (14,3%) са загубени за проследяване по време на периода на изследване. Изследвани са осемнадесет пациенти с рак на стомаха (Таблица 1). Не е установена обаче значителна разлика между пациентите с включване и изключване по отношение на техните базови характеристики.
Резултати
Демографски данни
18-те изследвани субекта са имали средна възраст 56 години, с диапазон от 28–74 години. Средният индекс на телесна маса е 23,8 kg/m 2, с диапазон от 18,9-28,2 kg/m 2. По-голямата част от субектите (83,3%) са мъже (Таблица 1).
Оценка на приема на храна
Средният дневен хранителен прием е показан в Таблица 2. Не съществуват значителни разлики в дневния общ прием на калории, протеини, мазнини и въглехидрати предоперативно и 1 година след субтотална гастректомия (Таблица 2).
Оценка на телесния състав
Загуба на тегло се наблюдава при всички изследвани субекти след субтотална гастректомия. От изследваните субекти 11,7% (н= 2), 55,5% (н= 10) и 33,3% (н= 6) загубили 10% от предоперативното си телесно тегло, съответно 1 година след операцията. Индексът на телесна маса, обиколката на талията и процентът на телесните мазнини, измерени чрез двуенергийна рентгенова абсорбциометрия, намаляват до 90,4 ± 5,0, 89,7 ± 5,7 и 76,2 ± 9,7% след 1 година субтотална гастректомия, но масата без мазнини не да доведе до статистически значима промяна след операция (Таблица 2).
Оценка на апетита
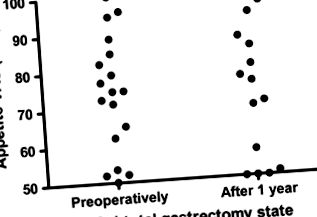
Нямаше значителни разлики в оценките на VAS за апетит предоперативно и 1 година след субтотална гастректомия (Таблица 2 и Фигура 1).
Сравнение на апетита преди операцията и 1 година след субтоталната гастректомия.
Оценка на нивата на грелин и PYY3−36
Общото плазмено ниво достигна минимум от 42,8% на 1 час след резекция на стомаха и постепенно се увеличи до 85,8% до следоперативния ден 7. Накрая обаче общото плазмено ниво на грелин намаля значително (от 113,0 ± 46,1 на 65,2 ± 26,6 pg/ml; P= 0,006) 1 година след субтотална гастректомия (Фигура 2). Концентрацията на PYY3-36 намалява до 78,9% на следоперативния ден 7, но не води до статистически значима промяна в рамките на 1 година след субтоталната гастректомия (Фигура 2).
Промени в концентрациите на грелин и PYY3-36 (а и б; средно със s.d.) предоперативно и 1 година след субтотална гастректомия (б; сдвоени т-тест). POD, следоперативен ден.
Дискусия
Стомашната резекция е хирургично отстраняване на част или целия стомах и обикновено се извършва при лечение на рак на стомаха или неразрешими пептични язви. Пациентите, подложени на стомашна резекция, често губят телесно тегло. Намаленият калориен прием и малабсорбцията се считат за най-важните фактори, допринасящи за загуба на тегло след стомашна резекция (Braga et al., 1988). Тъй като грелинът се произвежда главно от стомаха, загубата на тегло след резекция на стомаха може да бъде придружена от нарушено производство на грелин. По този начин промените в стомашно-чревния пептид също могат да бъдат свързани с загуба на тегло след стомашна резекция. Не са докладвани обаче проспективни проучвания на дългосрочните ефекти на стомашната резекция върху стомашно-чревните хормонални промени при пациенти с нормално телесно тегло.
В това проучване няма значителни разлики в дневния прием на общо калории, протеини, мазнини и въглехидрати предоперативно и 1 година след субтотална гастректомия (Таблица 2). Може да се очаква, че след пълна гастректомия загубата на стомашен резервоар намалява приема на калории, което е основна причина за загуба на тегло (Liedman et al., 1996). След субтотална гастректомия обаче не е установена значителна разлика в приема на храна предоперативно и 1 година след операцията. Това може да се дължи на частично възстановяване на резервоарната функция на остатъчния стомах и повишената честота на приема на храна.
Съобщава се, че загубата на тегло обикновено настъпва рано, особено през първите 6 месеца след операцията, въпреки че данните за промените в телесния състав след субтоталната гастректомия са ограничени (Liedman et al., 1997). Нашето проучване показа, че телесното тегло, индексът на телесна маса, обиколката на талията и процентът на телесните мазнини намаляват 1 година след субтоталната гастректомия, докато масата без мазнини не се променя (Таблица 2). Тези открития показват, че намалените телесни мазнини са най-важният фактор, допринасящ за загубата на тегло след гастректомия. Намаляването на телесните мазнини води до загуба на тегло и намален индекс на телесна маса след субтотална гастректомия. В проучване за промени в телесния състав след гастректомия се съобщава, че приблизително 90% от загубата на тегло се причинява от намалените телесни мазнини (Liedman et al., 1997). Причината, поради която намаляването на телесните мазнини е най-чувствителна сред отделите от телесния състав след гастректомия, е неизвестна.
Стомахът е основното място за производство на грелин, което допринася за 70% от нивата на грелин при хората (Jeon et al., 2004). Поради това предположихме, че нивата на грелин ще намалят след гастректомия, което води до загуба на апетит и телесно тегло. Въпреки това, противно на нашите очаквания, преди и 1 година след субтоталната гастректомия не са настъпили значителни разлики в оценките на VAS апетита (Фигура 1). Основният механизъм е неизвестен, но контролът на апетита и ситостта се медиира от сложно взаимодействие на невроендокринните сигнални пътища, включващи голямо разнообразие от пептидни хормони и невропептиди, включително грелин и PYY3−36 (Romijn et al., 2008) Въпреки че стимулиращата апетита плазма концентрациите на грелин намаляват след гастректомия, апетитът не би бил променен поради компенсация на други хормони, участващи в контрола на апетита и приема на храна. Положителните емоции за преодоляване на рака при пациенти с рак на стомаха, които са претърпели гастректомия, могат да повлияят положително на субективните VAS апетитни оценки 1 година след операцията (Boström et al., 2003).
Нашето проучване има някои ограничения, включително относително малкия размер на изследваната проба и факта, че не е направен опит за измерване на ацилиран и деацилиран грелин. Другите ограничения са липсата на данни за нивата на физическа активност, които също могат да повлияят на промените в телесното тегло и грелина, въпреки че помолихме пациентите да поддържат нивата на физическа активност през целия период на изследване. Имайки предвид тези ограничения, са необходими допълнителни изследвания, за да се потвърдят тези констатации.
В обобщение показахме, че плазмената концентрация на грелин намалява 1 година след субтоталната гастректомия при пациенти с ранен стомашен рак с нормално телесно тегло. Въпреки това, плазмената концентрация на PYY3−36, както и апетитът и приема на храна, не показват значителна промяна 1 година след субтоталната гастректомия. Тези открития предполагат, че намаленият грелин може да допринесе пряко за намаляване на телесните мазнини.
Препратки
Adrian TE, Ferri GL, Bacarese-Hamilton AJ (1985). Човешко разпространение и освобождаване на предполагаемия нов чревен хормон, пептид YY. Гастроентерология 89, 1070–1077.
Ариясу Н (2001). Стомахът е основен източник на циркулиращ грелин и състоянието на хранене определя нивата на имунореактивност на плазмения грелин при хората. J Clin Endocrinol Metab 86, 4753–4758.
Boström B, Sandh M, Lundberg D, Fridlund B (2003). Сравнение на болката и свързаното със здравето качество на живот между две групи пациенти с рак с различни средни нива на болка. J Clin Nurs 12, 726–735.
Braga M, Zuliani W, Foppa L, Di Carlo V, Cristallo M (1988). Прием на храна и хранителен статус след пълна гастректомия: резултати от хранително проследяване. Br J Surg 75, 477–480.
Dornonville de la Cour C, Lindqvist A, Egecioglu E, Tung YC, Surve V, Ohlsson C и др. (2005). Лечението с грелин обръща намаляването на наддаването на тегло и телесните мазнини при гастриктомирани мишки. Червата 54, 907–913.
Doucet E, Pomerleau M, Harper ME (2004). Общият грелин на гладно и след хранене остава непроменен след краткосрочно ограничаване на енергията. J Clin Endocrinol Metab 89, 1727–1732.
Flint A, Raben A, Blundell JE, Astrup A (2000). Възпроизводимост, мощност и валидност на визуални аналогови скали при оценка на усещанията за апетит при проучвания с едно тестово хранене. Int J Obes Relat Metab Disord 24, 38–48.
Frayn KN (1983). Изчисляване на степента на окисляване на субстрата in vivo от газообразен обмен. J Appl Physiol 55, 628–634.
Going S (1993). Откриване на малки промени в телесния състав чрез двуенергийна рентгенова абсорбциометрия. Am J Clin Nutr 57, 845–850.
Японска асоциация за рак на стомаха (1998). Японска класификация на стомашния карцином - 2-ро издание на английски. Рак на стомаха 1, 10–24.
Jeon TY, Lee S, Kim HH, Kim YJ, Son HC, Kim DH и др. (2004). Промени в плазмената концентрация на грелин веднага след гастректомия при пациенти с ранен рак на стомаха. J Clin Endocrinol Metab 89, 5392–5396.
Karamanakos SN, Vagenas K, Kalfarentzos F, Alexandrides TK (2008). Загуба на тегло, потискане на апетита и промени в нивата на грелин и пептид-YY на гладно и след хранене след гастриктомия на стомашен байпас и ръкав на Roux-en-Y: проспективно, двойно сляпо проучване. Ан Сург 247, 401–407.
le Roux CW, Bloom SR (2005). Пептид YY, апетит и прием на храна. Proc Nutr Soc 64, 213–216.
Lee S, Jin Kim Y, Yong Jeon T, Hoi Kim H, Woo Oh S, Park Y и др. (2006). Затлъстяването е единственият независим фактор, свързан с диагностицирана с ултразвук безалкохолна мастна чернодробна болест: изследване на случай на контрол в напречно сечение. Scand J Gastroenterol 41, 566–572.
Liedman B, Andersson H, Bosaeus I, Hugosson I, Lundell L (1997). Промени в телесния състав след гастректомия: резултати от контролирано, проспективно клинично изпитване. Свят J Surg 21., 416–420.
Liedman B, Andersson H, Berglund B, Bosaeus I, Hugosson I, Olbe L и др. (1996). Прием на храна след гастректомия за стомашен карцином: ролята на стомашен резервоар. Br J Surg 83, 1138–1143.
McGowan BM, Bloom SR (2004). Пептид YY и контрол на апетита. Curr Opin Pharmacol 4, 583–588.
Romijn JA, Corssmit EP, Havekes LM, Pijl H (2008). Оста на червата и мозъка. Curr Opin Clin Nutr Metab Care 11., 518–521.
Тейлър RW, Keil D, Gold EJ, Уилямс SM, Goulding A (1998). Индекс на телесна маса, обиколка на талията и съотношение между талията и ханша като индекси на общото и регионалното затлъстяване при жените: оценка с помощта на кривите на работните характеристики на приемника. Am J Clin Nutr 67, 44–49.
Tschöp M, Smiley DL, Heiman ML (2000). Грелин предизвиква затлъстяване при гризачи. Природата 407, 908–913.
Wren AM, Small CJ, Ward HL, Murphy KG, Dakin CL, Taheri S и др. (2000). Новият хипоталамусен пептид грелин стимулира приема на храна и секрецията на растежен хормон. Ендокринология 141, 4325–4328.
Благодарности
Тази работа беше подкрепена от Грант на Медицински изследователски институт (2005-01) от Националния университет в Пусан, Пусан, Корея.
Информация за автора
Принадлежности
Отделение по хирургия, Национална университетска болница Пусан, Пусан, Южна Корея
Клиника по семейна медицина, Национален университет в Пусан Болница Янгсан, Янгсан, Южна Корея
S Lee & D W Jeong
Отдел за медицинско образование, Медицински факултет на Националния университет в Пусан, Янгсан, Южна Корея
Институт за медицински изследвания, Медицински факултет на Националния университет в Пусан, Янгсан, Южна Корея
Катедра по лабораторна медицина, Национална университетска болница Пусан, Пусан, Южна Корея
Катедра по семейна медицина, Национална университетска болница Пусан, Пусан, Южна Корея
Y J Kim, J G Lee & Y J Kim
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
- Дългосрочният прием на високопротеинова диета влияе върху телесния фенотип, метаболизма и плазмените хормони в
- Дългосрочният прием на високопротеинова диета влияе върху телесния фенотип, метаболизма и плазмените хормони в
- Дългосрочният хранителен прием на семена от чиа е свързан с повишено съдържание на костни минерали и
- План за хранене ЗА ЦЯЛАТА година; Вземете СЪХРАНЕНИЕ НА ХРАНИТЕ СЪСТАВЕНО едновременно! Подготвени домакини
- Влияние на бабите и дядовците върху диетичния прием на техните 2–12-годишни внуци Систематично