Колинс Камунде
Департамент по биомедицински науки, Атлантически ветеринарен колеж, Университет на остров Принс Едуард, PE, Канада
Ravinder Sappal
Департамент по биомедицински науки, Атлантически ветеринарен колеж, Университет на остров Принс Едуард, PE, Канада
Тарек Мостафа Мелеги
Департамент по биомедицински науки, Атлантически ветеринарен колеж, Университет на остров Принс Едуард, PE, Канада
Свързани данни
Резюме
Въведение
Тъй като при високи нива на включване морските водорасли са показали, че влошават ефективността на растежа на рибите и ефективността на фуражите [4,14–17], определянето на нивата на включване, които подобряват ефективността на растежа на рибите и/или здравословното състояние, остава основният фокус на повечето проучвания. Такива знания биха могли да позволят заместването на скъпи съставки на рибни фуражи като рибно брашно и/или смесване на малки количества морски водорасли или техните екстракти с готови водни храни, за да се възползват от свързаните с растежа полезни ефекти. Въпреки това, променливостта в биохимичния състав и противоречивите ефекти от добавянето на водорасли сред рибите налага да се тестват ефектите от добавянето на специфични водорасли върху специфични видове риби. По-специално, сьомгите са най-важните аквакултурни риби и използват най-големи количества рибно брашно и рибено масло в аквахрани [29]; по този начин демонстрирането на роля на морските водорасли в храненето на сьомга би имало големи последици за аквакултурите.
Материали и методи
Етични съображения
Проучването и всички експериментални процедури, на които са били подложени рибите, са одобрени от Комитета за грижа за животните на остров Принц Едуард (протокол № 16–026) в съответствие с насоките на Канадския съвет за грижа за животните.
Експериментални диети
Анализ на състава на храните и водораслите
Анализът на състава на експерименталните диети и водорасли е направен в PEI Analytical Laboratory (https://www.princeedwardisland.ca/en/information/agriculture-and-fisheries/pei-analytical-laboratories-peial). Лабораторията, управлявана от провинциалното правителство на остров Принц Едуард, е акредитирана по международния стандарт за общите изисквания за компетентност на лабораториите за изпитване и/или калибриране (ISO/IEC 17025: 2005) от Канада. Описанията на използваните аналитични методи са дадени в таблица S1.
Проба за хранене и вземане на проби
Изпитването за хранене е проведено във водната база на Атлантическия ветеринарен колеж. Смолците от атлантическа сьомга (първоначално средно тегло: 77 g) са получени от Northern Harvest, Cardigan, PE и се поддържат в резервоар от 1200 L, снабден с течаща аерирана кладенец с вода, съдържаща (mg/L): Na 47,1, Cl 137,3, Са 58,8, Mg 27,6, твърдост 260 (като CaCO3). РН и температура на водата са съответно 7,5–8,0 и 10,5–11 ° C (номинални 11 ± 1 o C). Смолтите се привикват към тези лабораторни условия в продължение на 1 месец и се хранят с 2% мокро телесно тегло дневно с 3.0 mm EWOS трансфер за сьомги.
Изолиране на чернодробни митохондрии и измерване на митохондриалното дишане
Измервания на активността на каталазата и SOD и общия глутатион в митохондриите
Каталазата беше измерена с помощта на Purpald (4-амино-3-хидразино-5-меркапто-1,2,4-триазол) въз основа на [35], както наскоро описахме за рибни митохондрии [36]. Накратко каталазата реагира с метанол в присъствието на водороден пероксид, образувайки формалдехид, който при свързване с Purpald преминава от безцветен в лилав. Тази промяна на цвета, която е пряко пропорционална на активността на каталазата, беше измерена чрез проследяване на абсорбцията при 540 nm (SpectraMax Plus 384, Molecular Devices, LLC, Sunnyvale, CA).
За SOD е открит супероксиден анион радикал (O2 • -), генериран от ксантин оксидаза-хипоксантин система, като се използва водоразтворим тетразолий, WST-1 (натриева сол на 4- [3- (4йодофенил) -2- (4-нитрофенил) -2Н-5-тетразолио] -1,3-бензен дисулфонат) съгласно [37], както е описано наскоро за рибни митохондрии [36]. Тук WST-1 произвежда водоразтворима боя при редукция на O2 • - и скоростта на редукция на WST-1 е линейна спрямо ксантиноксидазната активност и се инхибира от SOD. Намаляването на намаляването на WST-1 се измерва чрез проследяване на абсорбцията при 440 nm (SpectraMax Plus 384) и показва активността на SOD.
И накрая, общите нива на глутатион бяха измерени съгласно [38], както наскоро беше описано за рибни митохондрии [36]. Изследването включва ензимно рециклиране с използване на глутатион редуктаза и 5-5'-дитиобис [2-нитробензоена киселина] (DTNB), което води до образуването на жълт хромофор, 5-тионитробензоена киселина (TNB), чиято абсорбция се измерва при 412 nm (SpectraMax Плюс 384). Концентрациите на глутатион в неизвестни проби са получени чрез сравняване на тяхната абсорбция спрямо стандартната крива на глутатион.
Общ плазмен антиоксидантен капацитет
Общият плазмен антиоксидантен капацитет беше измерен с помощта на търговски комплект (Cayman Chemical, Ann Arbor, MI) в съответствие с инструкциите на производителя. Накратко, способността на плазмените проби да инхибират окисляването на 2,2′-азино-ди- [3-етилбензтиазолин сулфонат] ® (ABTS ®) до ABTS ® • + чрез метмиоглобин беше измерена чрез спектрофотометрично наблюдение на ABTS ® • + при 750 нм (Spectramax Plus 384). В този анализ антиоксидантите в пробата намаляват абсорбцията при 750 nm до степен, пропорционална на тяхната концентрация.
Биологични и хранителни показатели
Изчислени са следните индекси:
Ежедневен прием на храна (% g • g -1) = (дозирана храна - непоядена храна)/тегло на рибата × 100.
Повишаване на теглото = крайно тегло на рибата - първоначално тегло на рибата.
CF: фактор на състоянието (g • cm -1) = наддаване на тегло/стандартна дължина на рибата 3 × 100.
HSI: хепатосоматичен индекс (% g • g -1) = чернодробно тегло/телесно тегло на риба × 100.
VSI: висцерозоматичен индекс (% g • g -1) = тегло на вътрешностите/телесно тегло на рибата × 100.
SGR: специфичен темп на растеж (% телесно тегло ден -1) = (lnw2 - lnw1) × 100/T, където w1 и w2 са съответно начално и крайно тегло, ln е естественият логаритъм и T храненето дни.
FCR: коефициент на преобразуване на фуража (g • g -1) = общ прием на сух фураж/общо наддаване на тегло.
PER: съотношение на белтъчна ефективност (g • g -1) = наддаване на тегло/прием на суров протеин.
Статистически анализ
Данните първо бяха тествани за допускания за нормалност на разпределението (Колмогоров-Смирнов) и хомоскедастичност (тест на Levene’s) и беше установено, че всички с изключение на данните VSI съответстват. За да се разкрие дали данните варират между трите повторения на всяка експериментална група, ефектът на резервоара (повторение) е тестван и е установено, че не е значителен. Следователно, (i) данните за консумацията на храна, ефективността на растежа и антиоксидантния статус са представени на еднопосочен дисперсионен анализ (ANOVA) с „добавка на водорасли“ като независима променлива (ii), данните за митохондриалното дишане са представени на двупосочен ANOVA с „добавки с морски водорасли“ и „Температура“ като независими променливи и (iii), VSI данни бяха анализирани с тест на Kruskal-Wallis (непараметричен еднопосочен ANOVA). Statistica 13.3 (TIBCO Software, Palo Alto, CA, USA) беше използвана за всички анализи. Имайте предвид, че процентните данни са били преобразувани в арксин преди статистическия анализ. Тестът за най-малко значима разлика (LSD) е използван за post hoc сравнение на средните стойности, когато основните ефекти на ANOVA са значителни. Нивото на значимост за всички анализи е определено в p Таблица 1). Освен това, в сравнение с контролния фураж със сьомга, морските водорасли съдържаха по-ниски нива на ключови минерали (фосфор, мед и цинк) и по-високи нива на неутрални детергентни влакна (NDF), пепел и NaCl. Добавянето на водорасли към търговски фураж със сьомга предизвиква леки промени в дела на другите диетични съставки (Таблици (Таблици 1 и и 2). 2). Забележително е, че суровият протеин (основа на сухо вещество, Таблица 1) е намалял от 57,6% (контролен) до 52,7 (10% водорасли) и от 54,7 до 48,9% (като захранена основа, Таблица 2) в контролната и 10% хранителна добавка с водорасли, съответно. За да се приложат тези стойности в контекста на хранителните нужди, нивата на суров протеин във фуражите за различните възрастови класове на атлантическата сьомга варират от 42-50%, а 45% за младите [39]. По същия начин леко намалените нива на фосфор, мед и цинк в хранителните добавки с водорасли надвишават съответните минимални хранителни изисквания за различни етапи на живот/класове по размер на атлантическата сьомга [39]. Въз основа на тези констатации е вероятно по-високите нива на включване (> 10%) от тези водорасли да намалят нивата на основните съставки до нива под минималните им изисквания.
маса 1
| Суров протеин (%) | 57,55 | 55,98 | 55.24 | 52,72 | 12.37 |
| NDF (%) | 12.27 | 15.08 | 12.04 | 18.27 | 42.13 |
| Калций (%) | 3.09 | 3.06 | 3.04 | 3.08 | 2.77 |
| Фосфор (%) | 1.96 | 2.04 | 1.88 | 1.76 | 0,14 |
| Магнезий (%) | 0,23 | 0,25 | 0,26 | 0,29 | 0,74 |
| Калий (%) | 0,90 | 0,93 | 0,97 | 1.04 | 1.86 |
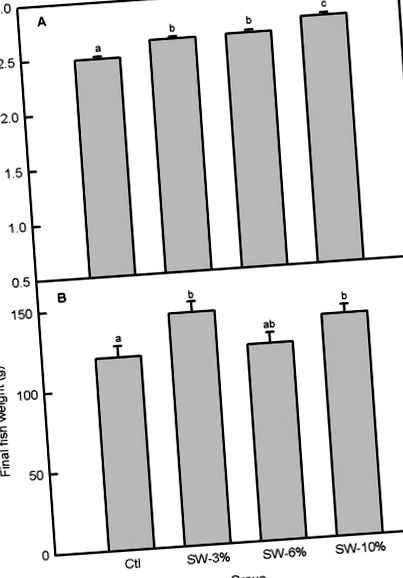
| Мед (ppm) | 11.98 | 10.20 | 9,73 | 10.81 | Фигура 1А) е значителна (F3,356 = 22,6, p Фигура 1A), теглото на рибата в резервоар варира с добавки с водорасли (F3,92 = 3,56, p = 0,02), като рибите се поддържат в храна, допълнена с 3 и 10% водорасли, значително по-високи финални телесни тегла от контролните (фиг. 1В). По-високите крайни тегла на рибата спрямо контрола за 3 и 10% добавени с водорасли риби са свързани с по-висок% наддаване на тегло (F3,8 = 5,36, p = 0,03), по-висок дневен прираст на тегло (F3,92 = 4,06, p = 0,05) и по-висок SGR (F3,92 = 5,35, p = 0,03) (Фиг. 2A – 2C). Въпреки че добавките с водорасли като цяло не променят значително FCR (F3,8 = 3,14, p = 0,08) (Фиг. 3А), групата с 3% добавка има по-добър FCR от групата с 6% добавка въз основа на независим t-тест на Student (сравнение не е показано). Освен това PER е значително променен от добавките с водорасли (F3,8 = 4,23, p = 0,04) (Фигура 3B) и е по-висок в групите с 3 и 10% спрямо групата с 6%. |
(А) Ежедневен прием на храна. (Б) Крайно тегло на рибата. Ctl: контрол (0% водорасли), SW-3%: 3% водорасли, SW-6%: 6% водорасли, SW-10%: 10% водорасли. Лентите с различни букви са значително различни (еднопосочен ANOVA, LSD тест, p Фиг. 4А). K, изчислено от крайните тегла и стандартните дължини, остава непроменено (F3,92 = 0,91, p = 0,44; Фиг. 4В). Измерването на други морфометрични показатели разкрива, че добавянето на водорасли не променя дълбочината на тялото, HSI и VSI, но увеличава теглото и дължината на цялата черва и червата за 3 и 10% нива на добавки спрямо контролата (Таблица 3).
HSI: хепатосоматичен индекс; VSI: висцерозоматичен индекс; SW: водорасли. Стойностите в един ред с различни букви са значително различни (еднопосочен ANOVA, LSD тест, p Фиг. 5A) е бил силно значим (F3,20 = 18,7, p Фиг. 5B) и общ SOD (F3,20 = 7,6, p = 0,001; Фиг. 5C), както и нивото на общия глутатион (F3,20 = 4.03, p = 0.02; Фиг. 5D). По-специално, активността на каталазата и общото съдържание на глутатион са значително по-високи от контрола за 6 и 10% добавки с водорасли, докато активността на SOD е по-висока от контрола за всичките три нива на добавки с водорасли.
Добавките с водорасли намаляват температурната реакция на митохондриалното дишане
След това оценихме ефекта от добавянето на водорасли върху дишането на митохондриите и неговата реакция на остро повишаване на температурата (11 → 20 o C) in vitro за честотите на дишане, поддържани от CI-III. Открихме, че температурата (F1,40 = 50,4, p Фиг. 6А). Забележително е, че CI-поддържаната степен 3 на дишане показва по-малка реакция на повишаване на температурата при риби, хранени с 10% водорасли, спрямо контролата. По същия начин, температурата (F1,40 = 42,4, p Фигура 6B). Тук CI състояние 4 дишане показва по-малки реакции на повишаване на температурата за 6 и 10% нива на водорасли добавки. За разлика от ясните промени в честотата на дишане в състояние 3 и 4, температурата (F1,40 = 0,06, p = 0,81) и добавките с водорасли (F3,40 = 2,55, p = 0,07) не променят CI RCR (Фигура 6C), нито е бил терминът на взаимодействие значителен (F3,40 = 1,29, p = 0,41).
(А) Състояние 3 дишане. (Б) Състояние 4 дишане. (С) RCR. Ctl: контрол (0% водорасли), SW-3%: 3% водорасли, SW-6%: 6% водорасли, SW-10%: 10% водорасли. Баровете с различни букви са значително различни (ANOVA, p Фиг. 7А). Забележително е, че хранителните добавки с 10% водорасли намаляват температурната реакция на дишането CII състояние 3 спрямо контрола. Изненадващо, честотата на дишане в състояние на CII 3, измерена при 11 и 20 o C, не се различава статистически една от друга. Освен това установихме, че температурата (F1,40 = 62,1, p Фиг. 7B). Тук наложеното от температурата увеличение на честотата на дишане в състояние 4 е по-ниско за 10% добавки с водорасли спрямо контрола. И накрая, CII RCR (Фигура 7C) беше значително променен от добавките с водорасли (F3,40 = 3,43, p = 0,03), но не и от температурата (F1,40 = 0,19, p = 0,67) и взаимодействието на двата фактора не беше значително (F3,40 = 0,04, p = 0,99).
(А) Състояние 3 дишане. (Б) Състояние 4 дишане. (С) RCR. Ctl: контрол (0% водорасли), SW-3%: 3% водорасли, SW-6%: 6% водорасли, SW-10%: 10% водорасли. Баровете с различни букви са значително различни (ANOVA, p Фиг. 8А). Важното е, че поддържаната от CIII скорост на дишане състояние 3 показва по-малък отговор на повишаване на температурата при риби, хранени с 10% водорасли, спрямо контролата. Също така, скоростта на дишане в състояние CIII 4 е значително променена от температурата (F1,40 = 119, p Фигура 8B). Подобно на CI и II, степента на дишане CIII състояние 4 показва по-малък отговор на повишаване на температурата за 10% нива на добавки с водорасли. Въпреки това, CIII RCR (Фигура 8C) не се променя значително от температурата (F1,40 = 0,03, p = 0,86) и добавките с водорасли (F3,40 = 1,26, p = 0,3), нито взаимодействието на двата фактора (F3, 40 = 0,30, p = 0,83).
(А) Състояние 3 дишане. (Б). Състояние 4 дишане. (С) RCR. Ctl: контрол (0% водорасли), SW-3%: 3% водорасли, SW-6%: 6% водорасли, SW-10%: 10% водорасли. Баровете с различни букви са значително различни (ANOVA, p (Таблици 1 1 и и 2). 2). Независимо от това, съдържанието на протеини за всички диети, допълнени с водорасли, бяха в оптималния диапазон за хранене на атлантическата сьомга [39]. Като цяло, макар да изглежда, че до 10% включване на AquaArom стимулира растежа на атлантическата сьомга, за по-категорично заключение относно ефективността на растежа ще е необходимо по-дълго изпитание за хранене. Освен това бъдещите проучвания трябва да изследват механизмите и компонентите, които са в основата на ефектите на AquaArom за повишаване на растежа.
Заключения
Като цяло, нашето проучване показва, че добавянето на AquaArom към търговска храна със сьомга увеличава приема на храна и подобрява ефективността на растежа, подобрява капацитета на плазмените антиоксиданти и облекчава ефекта от повишаването на температурата върху митохондриалното дишане. Лекият спад на суровите протеини и минерали в резултат на добавянето на до 10% AquaArom към aquafeed изглежда няма неблагоприятни последици върху атлантическата сьомга. По този начин смесването на брашно от кафяви морски водорасли с търговски водни храни (и потенциално фуражи за други селскостопански животни) може да предложи икономически ефективен начин за овладяване на полезните ефекти на водораслите в животновъдството.
- Диетичен дивидент Намаляването на приема на храна при мишки намалява растежа на техните поликистозни бъбреци
- Антенатално диетично обучение и добавки относно приема на енергия и протеини по време на бременност до
- Изследване на напречно сечение на прием на група храни и С-реактивен протеин сред деца
- Аюрведа за растежа на косата 5 храни и билки, които могат да увеличат обема на косата - NDTV храна
- Кафявият ориз може да ускори отслабването точно като 30 минути бърза разходка - NDTV храна