Юсуке Сакагучи
1 Отдел за цялостно изследване на бъбречните заболявания, Медицински факултет на университета в Осака, 2-2, Ямада-ока, Суита 565-0871, Япония; pj.ca.u-akaso.dem.dik@aetamah
Takayuki Hamano
1 Катедра за цялостно изследване на бъбречните заболявания, Медицински факултет на университета в Осака, 2-2, Ямада-ока, Суита 565-0871, Япония; pj.ca.u-akaso.dem.dik@aetamah
Йошитака Исака
2 Катедра по нефрология, Медицински факултет на университета в Осака, 2-2, Ямада-ока, Суита 565-0871, Япония; pj.ca.u-akaso.dem.dik@akasi
Резюме
1. Въведение
Магнезият е основен минерал за човешкото здраве и действа като кофактор за над 500 ензимни реакции в организма. Диетичният прием на магнезий в развитите страни е намалял през последните десетилетия поради увеличената консумация на диети с ниско съдържание на магнезий, като преработени храни и бързи храни; в резултат на това повече от половината от населението на САЩ не отговаря на очакваното средно изискване за хранителен прием на магнезий [1]. Мета-анализите на епидемиологични проучвания в общата популация свързват по-ниския прием на магнезий с храната с повишен риск от сърдечно-съдови заболявания [2,3,4] и метаболитен синдром [5,6,7]. В допълнение, двойно-слепи рандомизирани контролирани проучвания демонстрират, че добавките с магнезий подобряват контрола на кръвното налягане [8], инсулиновата чувствителност [9] и ендотелната функция [10,11]. Последователно редица експериментални проучвания показват, че магнезият е защитен срещу увреждане на ендотелните клетки и оксидативен стрес [12].
Въпреки тези доказателства, които предполагат магнезий като защитен минерал за сърдечно-съдовата система, този двувалентен катион е получил малко внимание в областта на хроничните бъбречни заболявания (ХБН). Състоянието с нисък магнезий обаче може също да бъде неблагоприятно за пациенти с ХБН, тъй като е свързано с възпаление, атеросклероза и интрадиализна хипотония сред пациенти, подложени на хемодиализа [13,14]. По-важното е, че предвид огромното въздействие на нерегулирания минерален и костен метаболизъм върху сърдечно-съдовия риск при пациенти с ХБН, където калцият, фосфатът и паратиреоидният хормон се считат за централни играчи, магнезият може също да изпълнява уникална функция. Например, известно е, че магнезият инхибира кристализацията на калциев фосфат. Магнезият може също така да потиска секрецията на паратиреоиден хормон, като въздейства върху калциево-чувствителните рецептори на паращитовидните жлези [15,16]. В този преглед ще обобщим последните постижения в изследванията на магнезия при ХБН с особен акцент върху съдовата калцификация и фосфатната токсичност.
2. Калцификация на магнезия и съдовете
2.1. Клинични изследвания
Spiegel и сътр. съобщават, че добавките с магнезий за пациенти на хемодиализа могат да бъдат полезни за потискане на прогресията на калцификацията на коронарните артерии в малко мащабно неконтролирано проучване [29]. Наскоро Tzanakis et al. проведе пилотно интервенционно проучване на 59 пациенти на хемодиализа, които бяха произволно назначени на 12-месечно лечение или на магнезиево-съдържащи фосфатни свързващи вещества (магнезиев карбонат/калциев ацетат), или на съдържащи калций фосфатни свързващи вещества (калциев ацетат) [30]. След това двете групи бяха сравнени по отношение на прогресията на артериалното калциране. В края на проучването пациентите в групата, съдържаща магнезий фосфатно свързващо вещество, са по-склонни да покажат регресия на артериалното калциране, отколкото тези в групата, съдържаща калций, съдържащи фосфатни свързващи вещества. Докато това проучване предлага обещаващ терапевтичен ефект на свързващите вещества с магнезий върху съдовата калцификация, размерът на пробата е относително малък и методологията за оценка на съдовата калцификация може да бъде проблематична по отношение на точността и възпроизводимостта. Необходими са по-нататъшни мащабни опити с по-валидирана мярка за калцификация (напр. Оценка на калцификация на коронарните артерии).
2.2. Експериментални изследвания
3. Магнезий и клинични резултати при ХБН
3.1. Магнезиеви и сърдечно-съдови резултати при ХБН
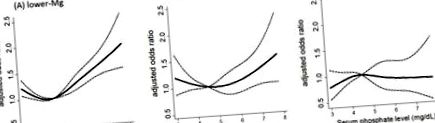
Като се имат предвид доказателствата in vitro, показващи мощния защитен ефект на магнезия срещу фосфатно-индуцирана съдова калцификация, може да се предположи, че влиянието на магнезия върху сърдечно-съдовия риск се проявява особено при пациенти с високи нива на фосфати. В действителност има значително взаимодействие между серумните нива на магнезий и фосфат върху риска от сърдечно-съдова смъртност при пациенти на хемодиализа; рискът, свързан с хиперфосфатемия, се влошава при тези с по-ниски серумни нива на магнезий, докато рискът е значително намален при тези с по-високи серумни нива на магнезий [58] (Фигура 1). Този резултат предлага нова терапевтична концепция, че повишаването на нивата на магнезий може да намали сърдечно-съдовия риск, произтичащ от хиперфосфатемия.
Взаимодействие между серумните нива на магнезий и фосфат върху риска от сърдечно-съдова смърт сред пациенти, подложени на хемодиализа. Коригирано съотношение на шансовете за сърдечно-съдова смъртност при пациенти със серумни нива на магнезий от (A) 2 [78]. Въпреки че се постулират няколко основни механизма, възможно е магнезият да смекчи особено бъбречното увреждане, причинено от претоварване с фосфати. Това схващане се подкрепя от ретроспективно кохортно проучване на 311 пациенти без диабет с ХБН със средно проследяване от 44 месеца, което показва, че пациентите с по-нисък серумен магнезий - по-висок серумен фосфат са били с 2,07 пъти по-висок риск за бъбрек в краен стадий заболяване в сравнение с тези с по-висок серумен магнезий - по-висок серумен фосфат, чиито рискове са еквивалентни на пациенти с по-ниски серумни нива на фосфат [79]. Последователно, експеримент in vitro разкрива, че проксималната тубулна клетъчна травма, причинена от висок фосфат, е отслабена чрез увеличаване на средната концентрация на магнезий, отчасти чрез възстановяване на митохондриалния мембранен потенциал [79]. Тези данни показват, че концепцията за магнезий като инхибитор на фосфатната токсичност може да бъде приложима не само за сърдечно-съдовия риск, но и за риска от прогресия на ХБН.
4. Нисък хранителен прием на магнезий при пациенти на хемодиализа
4.1. Причини за дефицит на магнезий
Съдържанието на магнезий в организма се регулира плътно чрез организирано взаимодействие между червата, бъбреците и костите [80]. Следователно дефицитът на магнезий се дължи главно на (1) нисък прием на магнезий; (2) намалена стомашно-чревна абсорбция; и (3) засилено отделяне на урина.
(1) Нисък прием на магнезий
Магнезият се съдържа в изобилие в зелени листни зеленчуци, водорасли, боб, бобови растения и ядки. Преработените храни и бързите храни са бедни на магнезий. Въпреки че тежкият дефицит на магнезий поради ниския прием на магнезий с храната е необичаен, с изключение на пациентите, които поддържат парентерално хранене с дефицит на магнезий, лекият дефицит става преобладаващ, тъй като консумацията на преработени храни и бързи храни се увеличава, особено в развитите страни [1].
(2) Намалена стомашно-чревна абсорбция
Чревната абсорбция на магнезий се осъществява главно в йеюнума, илеума и дебелото черво както чрез активен трансцелуларен транспорт, така и чрез пасивна парацелуларна дифузия. Когато приемът на магнезий е нисък, активният транспортен път чрез TRPM6 става доминиращ. Загубата на функционални мутации на TRPM6 е причина за автозомно-рецесивна фамилна хипомагнезиемия с вторична хипокалциемия. Напоследък стана широко признато, че използването на инхибитори на протонната помпа индуцира хипомагнезиемия дори при пациенти на хемодиализа [81]; основният механизъм се предполага да е нарушение на абсорбцията на магнезий в дебелото черво, вероятно чрез индуцирано от PPI повишаване на луминалното рН, което инактивира TRPM6.
(3) Подобрено отделяне на урина
Около 70% от магнезия в плазмата се филтрира от гломерулите. Филтрираният магнезий се реабсорбира в проксималните тубули (10% –25%), контура на Henle (50% –70%) и дисталните извити тубули (
10%), където се извършва фина настройка на общата реабсорбция на магнезий чрез TRPM6. Фракционната екскреция на магнезий (FEMg) може да бъде едва 0,5%. От друга страна, FEMg от повече от 4% при наличие на хипомагнезиемия се счита за загуба на магнезий в бъбреците. В допълнение към генетичните нарушения има много клинични фактори, които причиняват бъбречно загуба на магнезий. Сред тях най-честата причина е индуцираната от лекарства хипомагнезиемия (напр. Диуретици, инхибитори на калциневрин, цисплатин, аминогликозиди и инхибитори на рецептора на епидермалния растежен фактор (цетуксимаб) и др.). Инсулиновата резистентност е друга важна причина за загубата на магнезий от бъбреците и изглежда, че полученият дефицит на магнезий влошава метаболизма на глюкозата [82].
4.2. Дисбаланс между магнезий и фосфат при пациенти на хемодиализа
Тъй като екскрецията на магнезий с урина е пренебрежимо малка при пациентите на хемодиализа, серумните нива на магнезий при тези пациенти се определят до голяма степен от приема на магнезий в храната, както и от концентрациите на диализат магнезий. При същата диализатна концентрация на магнезий, серумните нива на магнезий са добре корелирани с диетичното количество магнезий [83]. Luis et al. съобщава, че дневният прием на магнезий при пациенти на хемодиализа е много нисък и само 2% от пациентите консумират магнезий над минималното изискване [84]. Това вероятно е така, защото богатите на магнезий храни са богати и на калий, който трябва да бъде ограничен за пациенти с краен стадий на бъбречно заболяване. По-важното е, че преработените храни имат недостиг на магнезий, тъй като обработката на храни причинява значителна загуба на магнезий. В същото време тези храни съдържат голямо количество неорганичен фосфат като хранителни добавки. Следователно се очаква преработените храни не само да намалят консумацията на магнезий, но също така да повишат тази на фосфата, предизвиквайки състоянието „високо фосфат-ниско магнезий“. Бъдещите проучвания трябва да изследват влиянието на хранителния дисбаланс на магнезий и фосфат върху сърдечно-съдовия риск при пациенти на диализа.
5. Как да повишим магнезиевия статус на диализните пациенти?
Има няколко начина за повишаване на серумните нива на магнезий при пациенти, получаващи хемодиализа. Макар че би било нереалистично в клиничната практика пациентите на диализа да увеличат приема на магнезий с храната, тъй като трябва да ограничат калия, добавките с магнезий могат да увеличат нивата на магнезий в серума, без това да повлияе нивата на калий. В тази връзка, свързващите вещества, съдържащи магнезий, са полезни и могат да коригират ниското състояние на магнезий-високо ниво на фосфат. Съобщава се, че съдържащото магнезий фосфатно свързващо вещество потиска съдовото калциране по-ефективно от други видове свързващи вещества при животински модел на ХБН [85], както и при пациенти на хемодиализа [30]. В допълнение, този вид свързващо вещество има няколко предимства, като евтино и има по-малко стомашно-чревни странични ефекти [86]. Трябва ли допълнително да се проучи дали съдържащото магнезий свързващо вещество превъзхожда другите видове свързващи вещества по отношение на твърдите резултати.
Друг бърз и сигурен метод за контрол на нивата на магнезий е промяната на диализираните концентрации на магнезий. По-специално, диализатните концентрации на магнезий могат да повлияят на интрадиализната хемодинамика, тъй като магнезият влияе пряко върху сърдечната контрактилитет и съдовия тонус. Съобщава се, че употребата на диализат с ниско съдържание на магнезий и ниско съдържание на калций увеличава появата на интрадиализна хипотония и намалява сърдечните отделения [14]. Следователно, по-високият магнезиев диализат може да бъде полезен за пациенти на диализа не само чрез увеличаване на серумните нива на магнезий, но и чрез стабилизиране на интрадиализната хемодинамика.
6. Заключения
В настоящата клинична практика на пациенти на диализа, основната възможност за лечение на хиперфосфатемия е да се намали фосфатното натоварване чрез диетично управление и използването на фосфатни свързващи вещества, както и да се отстрани фосфатът чрез диализна терапия. Въпреки интегративния подход на тези терапевтични възможности обаче проблемите, свързани с хиперфосфатемията, не са напълно разрешени през последните десетилетия поради лошото придържане към лечението, страничните ефекти на лекарствата и хранителните недостатъци, присъщи на диетичните ограничения. Може да се наложи да признаем, че настоящата стратегия за намаляване на фосфатното натоварване достига граница и да разработим допълнителен начин за облекчаване на вредните ефекти на фосфатите. Въпреки че са необходими по-убедителни данни, за да се оправдае употребата на магнезий като „лекарство за фосфатна токсичност“ в клиничната практика, струва си да се провери дали корекцията на нискомагнезиевия статус подобрява прогнозата на пациентите с хиперфосфатемия. В същото време е важно да се изясни до каква степен серумните нива на магнезий могат да бъдат безопасно повишени, тъй като прекомерно високите серумни нива на магнезий също могат да бъдат вредни [47]. Очевидно са необходими допълнителни усилия за установяване на клиничното значение на магнезия сред пациентите с ХБН.
Конфликт на интереси
Авторите не декларират конфликт на интереси.
- Контекстуална бедност, хранене и хронична бъбречна болест
- Диетични фактори и хронични бъбречни заболявания Бъбречни новини
- Диетичният излишък на фосфор е рисков фактор при хронични костни, бъбречни и сърдечно-съдови заболявания
- Диети за пациенти с хронична бъбречна болест, все още си струва да се предписва Американското общество на
- Хранене правилно с хронична бъбречна болест