Резюме
Заден план
Екскрецията на Ca 2+ в урината се увеличава с NaCl с храната. Индуцираната от NaCl калциурия може да бъде свързана с хипертония, образуване на камъни в урината и остеопороза, но нейният механизъм и дългосрочните ефекти не са напълно изяснени. Това проучване изследва промени в експресията на бъбречни транспортери на Ca 2+, канали и клаудини при натоварване със сол, за да се разбере по-добре механизмът на индуцирана от солта загуба на Ca 2+ в урината.
Методи
Осемседмични плъхове Wistar-Kyoto са били хранени с 0,3% или 8% NaCl диета в продължение на 8 седмици. Бъбречни кортикални експресии на Na +/Ca 2+ обменник 1 (NCX1), Ca 2+ помпа (PCMA1b), Ca 2+ канал (TRPV5), калбиндин-D28k и клаудини (CLDN-2, -7, -8, - 16 и -19) са анализирани чрез количествена PCR, Western blot и/или имунохистохимия.
Резултати
Фракционната екскреция на Ca 2+ се е увеличила 6,0 пъти при диета с високо съдържание на сол. Бъбречният кортикален клаудин-2 протеин намалява с приблизително 20% при намалено имунологично оцветяване на тъканни участъци. Изразите на Claudin-16 и -19 не бяха променени. Експресиите на TRPV5 на бъбречната кора, калбиндин-D28k и NCX1 са се увеличили съответно 1,6, 1,5 и 1,2 пъти.
Заключения
Хроничната диета с високо съдържание на сол намалява белтъка клаудин-2 и увеличава бъбречните TRPV5, калбиндин-D28k и NCX1. Известно е, че зареждането със сол намалява проксималната тубулна реабсорбция както на Na +, така и на Ca 2+. Намаляването на експресията на клаудин-2 протеин може да бъде отчасти отговорно за намалената реабсорбция на Са 2+ в този сегмент. Съгласуваното регулиране на по-дистални транспортиращи се Са 2+ молекули може да бъде физиологичен отговор за ограничаване на загубата на Са 2+, въпреки че степента на компенсация не изглежда адекватна, за да доведе екскрецията на Са 2+ в урината до тази на нормалната диетична група.
Заден план
Екскрецията на Ca 2+ с урината се увеличава при поглъщане на натриев хлорид (NaCl) [1]. Тази индуцирана от NaCl калциурия може да доведе до остеопороза при нисък прием на калций [2, 3] и също така е свързана с образуването на камъни в урината [1] и хипертонията [4]. Предполага се, че увеличаването на отделянето на Ca 2+ с урината се дължи на индуцирано от солта разширяване на обема [5] и/или конкуренция между натриеви и калциеви йони в бъбречните каналчета [6]. Точният механизъм за повишаване на Ca 2+ в урината, предизвикана от NaCl, не е напълно изяснен. Освен това не е ясно дали дългосрочното натоварване със сол оказва някакво влияние върху експресирането на молекули на Са 2+ в бъбреците.
По-голямата част от Ca 2+ в про-урината се реабсорбира в проксималния канал и дебелата възходяща верига на Henle чрез пасивно, парацелуларно движение. Трансепителната пропускливост Ca 2+ е висока в тези сегменти, а ограничаващата скоростта бариера е плътната връзка. Известно е, че клаудините и други протеини с плътно свързване са важни при определянето на характеристиките на пропускливостта на различни епители [7]. Например, бъбречната експресия на клаудин 2 е ограничена до проксималния нефрон [8] и се смята, че клаудин 2 образува катионни пори с висока проводимост [9]. Разпределението и функциите на тези протеини с плътно свързване стават известни, но информацията за тяхното регулиране, особено в бъбреците, тепърва се появява.
За разлика от това, регулираната трансцелуларна реабсорбция на Ca 2+ се появява предимно в дисталния канал. В дисталния нефрон Ca 2+ в про-урината навлиза в цитозола на тубулните клетки през Ca 2+ канал, главно TRPV5 [10]. Транспортът на вътреклетъчен Са 2+ до базолатералната страна се улеснява от Са2+-свързващ протеин, наречен калбиндин-D28k [10, 11], и Са 2+ излиза от клетката от базолатералната страна чрез Na +/Ca 2+ обменник 1 (NCX1) и помпа Ca 2+ (PMCA1b) [12, 13]. NCX1 контратранспортира 3 Na + за Ca 2+, но ролята на NCX1 в индуцирана от NaCl калциурия не е проучена.
Промените в експресията на протеини с плътно свързване и трансцелуларни транспортери на Ca 2+ могат отчасти да обяснят загубата на калций в урината при натоварване със сол или да дадат улики за дългосрочните ефекти от поглъщането на NaCl с храната. Следователно, ние изследвахме промените в експресията на бъбречните транспортни молекули на Ca 2+ при плъхове с хронична диета с високо съдържание на NaCl.
Методи
Експеримент с животни
Всички експериментални процедури са одобрени от Комитета по животни на Медицинския университет в Фукушима. Осемседмични плъхове Wistar-Kyoto (Japan SLC Inc., Сендай, Япония) са били хранени или с 0,3%, или с 8% NaCl чау (Oriental Yeast Co., Tokyo, Japan) в продължение на 8 седмици с чешмяна вода ad libitum. Неанестезираното систолично кръвно налягане беше измерено по метода на опашката (Анализатор на кръвното налягане модел BP-98A; Softron, Токио, Япония). Бяха направени десет измервания и осреднени на плъх на ден. Урината се събира редовно, като се използват метаболитни клетки. В края на проучването, под интраперитонеална пентобарбитална анестезия, се взема кръв от коремната аорта и се събират бъбреци за анализи.
Биохимичен анализ
Биохимичните анализи бяха извършени от SRL Inc. (Токио, Япония), като се използва креатиназа-саркозин-оксидаза-POD метод за креатинин, електроден метод за Na, K и Cl, метод на арсеназо III за Ca, директен анализ на молибдат за неорганичен фосфат (P) и ксилидилов син метод за Mg. Серумните концентрации на 1,25-дихидроксивитамин D3 бяха измерени чрез радиоимуноанализ, използвайки метода на двете антитела.
Количествена RT-PCR в реално време
Имуноблотинг
Имуноблотирането на бъбречни кортикални протеини се извършва по същия начин, както се съобщава по-рано [17]. Използваните антитела са моноклонални анти-плъхови NCX1 антитела (Abcam), поликлонални анти-клаудин 2 антитела (Life Technologies, Карлсбад, Калифорния) и поликлонални анти-TRPV5, анти-NHE3 и анти-GAPDH антитела (Santa Cruz Biotechnology). Лентите се визуализират чрез ECL или ECL плюс реагенти (Amersham) и се определят количествено чрез денситометрия, използвайки софтуера ImageJ.
Имунохистохимия
Секции от парафинови блокове на плъхове бяха направени с дебелина 2 μm. Бъбречните секции на плъхове, хранени с диета с нормално и високо съдържание на сол, бяха поставени върху едно стъкло за сравнение. След депарафинизация и блокиране, резените бяха третирани с анти-клаудин 2 антитяло (Life Technologies, Carlsbad, CA), анти-заешко вторично антитяло и DAB, използвайки VECTASTAIN-ABC комплект (Vector laboratories, Burlingame, CA). Слайдовете бяха оцветени с хематоксилин и еозин.
Анализ на данни
Всички стойности са изразени като средни стойности ± SE. Статистическите сравнения бяха извършени от Student's т-тест или ANOVA, когато е подходящо. P стойности
Резултати
Серумните електролити са подобни при плъховете, хранени с нормално и високо съдържание на сол
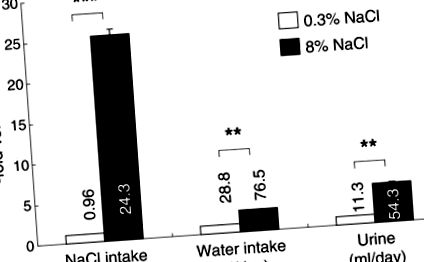
Приемът на храна е сходен между групите (групи с нормална сол спрямо групи с висока сол, 18,8 ± 0,9 срещу 17,8 ± 0,5 g/ден, ns, n = 15/група), въпреки че групата с високо съдържание на сол тежи малко по-малко от нормално- солна група в края на проучването (369 ± 5 срещу 354 ± 4 g, P Фигура 1
Екскрецията на калций в урината е значително увеличена при плъховете с високо съдържание на сол
В края на проучването, концентрацията на калций в урината (фигура 2А) и ежедневната екскреция на калций в урината (фигура 2Б) при плъхове на диета с високо съдържание на сол са били по-високи от тези в групата с нормална сол и фракционна екскреция на Ca на натоварената със сол плъхове е 6 пъти повече от контролните плъхове (Фигура 3). Фракционната екскреция на Mg също се увеличава с натоварване със сол, въпреки че увеличението е по-малко от това на фракционната екскреция на Са (Фигура 3).
Бъбречният клаудин-2 протеин намалява, но клаудин-7, -8, -16 или -19 иРНК не се променя при хронично натоварване със сол
Клаудин-2 образува парацелуларна катионна пора в проксималния канал. Плъхове, хранени с 8% NaCl в продължение на 8 седмици, показват повишена бъбречна кортикална клаудин-2 иРНК (Фигура 4А), но натоварването със сол значително намалява протеиновата експресия на клаудин-2 с около 20% (Фигура 4В). Може да има регулация на клаудин-2 след транскрипция. Проведено е имунохистохимично оцветяване на бъбречната кора за клаудин-2, за да се изследва допълнително промяната в експресията. Въпреки че чрез субективно наблюдение, оцветяването на бъбречната кортикална клаудин-2 също предполага намаляване на натоварването със сол (Фигура 4C и 4D). В проксималните тубули NHE3, експресиран главно в апикалната мембрана, е необходим за реабсорбция на калций, като осигурява движещата сила за парацелуларен транспорт на калций [18]. Неочаквано това проучване установи, че нивото на бъбречния кортикален NHE3 протеин на натоварени със сол плъхове е значително повишено в сравнение с това на плъхове на нормална диета (100 ± 20 срещу 292 ± 38%, n = 9-11, P Фигура 4
Клаудин-16 и -19 се изразяват главно в дебелия възходящ крайник [19], а мутациите на клаудин-16 [20] и -19 [21] водят до загуба на Mg 2+ и Ca 2+ в бъбреците. В това проучване не се наблюдава значителна промяна в бъбречния клаудин-16 или -19 при натоварване със сол (Фигура 5А и 5В).
Експресии на Claudin-16, -19, -7 и -8 в бъбречната кора на плъхове, хранени с 0,3% или 8% NaCl в продължение на 8 седмици. Целевите нива на иРНК или протеин бяха нормализирани спрямо GAPDH и изразени като относителни количества. Натоварването със сол в продължение на 8 седмици не променя значително клаудин-16 (5А), -19 (5В), -7 (5С), или −8 (5 Д) иРНК. п = 13-15 за 5А и 5В, и п = 9-10 за 5С и 5 Д.
Клаудин-7 и -8 се намират от дисталния извит тубул до вътрешния медуларен събирателен канал [22]. Смята се, че Claudin-8 действа като парацелуларна катионна бариера [23], като инхибира обратния поток на Ca 2+, който е реабсорбиран чрез трансцелуларни механизми. Клаудин-7 обикновено се приема като анионна бариера. Не се наблюдава значителна промяна в експресията на иРНК на клаудин-7 или клаудин-8 (Фигура 5С и 5D).
Високосолената диета, увеличена дистално, трансцелуларно Са 2+ транспортиращи молекули, TRPV5, калбиндин-D 28 , и NCX1.
Експресията на TRPV5 Ca 2+ в бъбречната кора се увеличава с диета с високо съдържание на сол, както по отношение на иРНК (Фигура 6А), така и на нива на протеини (Фигура 6В). TRPV5 е апикалният Ca 2+ механизъм за влизане и вратарят на дисталния тръбен Ca 2+ транспорт [24]. В допълнение, бъбречната кортикална иРНК на калбиндин-D28k, вътреклетъчна транспортна молекула Ca 2+ [11], също се е увеличила с около 48% (Фигура 6С). NCX1 и PMCA1b са базолатералните механизми за екструзия на Ca 2+ в този сегмент [25]. Бъбречната кортикална NCX1 тРНК и нивата на протеини се повишават в групата с високо съдържание на сол съответно с около 20% и 26% (Фигура 6D и Е). За разлика от това, бъбречната корова експресия на PMCA1b не е променена от диета с високо съдържание на сол (Фигура 6F).
Моделиране на функцията NCX1
Симулирано Е NCX , [Na + ] i и [Ca 2+ ] i , приемайки [Na + ] o = 140 mM и [Ca 2+ ] o = 1 mM. Съкращения; ENCX: равновесен потенциал на NCX1, [Na +] i: вътреклетъчна концентрация на Na +, [Ca 2+] i: вътреклетъчна концентрация на Ca 2+, [Na +] o: извънклетъчна (базолатерална) концентрация Na + и [Ca 2+] o: извънклетъчна (базолатерална) концентрация на Ca 2+. Пунктираният кръг показва симулирания физиологичен [Ca 2+] i, с [Na +] i при 17,5 mM и ENCX при -70 mV. Плътният кръг показва симулирания [Ca 2+] i със натоварване със сол, като [Na +] i се приема при 22 mM и ENCX при -70 mV.
Хроничното натоварване със сол намалява серумната концентрация на 1,25-дихидроксивитамин D3
За да се изследва механизмът на регулиране на TRPV5, калбиндин-D28k и NCX1 със натоварване със сол, се измерват серумни концентрации на 1,25-дихидроксивитамин D3 [1,25 (OH) 2D]. Известно е, че 1,25 (OH) 2D повишава регулирането на бъбречните TRPV5, калбиндин-D28k и NCX1 [35]. Въпреки това, плъхове, хранени с 8% NaCl диета в продължение на 8 седмици, показват значително намалена серумна концентрация от 1,25 (OH) 2D (176 ± 19 срещу 129 ± 7 pg/ml, P
Дискусия
Това изследване за първи път изследва ефектите на дългосрочния хранителен натриев хлорид върху бъбречната експресия на молекули на Са 2+ и клаудин. Хроничното натоварване със сол намалява протеиновата експресия на клаудин 2, компонент на проксималния, парацелуларен транспорт на Са 2+. Едновременно с това диетичният NaCl повишава експресията на по-дистални, трансцелуларни машини за реабсорбция на Ca 2+, TRPV5, калбиндин-D28k и NCX1.
Натоварването със сол рязко увеличава отделянето на Ca 2+ с урината заедно с Na + [3, 6]. В това проучване фракционната екскреция на Ca 2+ на натоварени със сол плъхове се е увеличила приблизително 6,0 пъти. Обикновено причината за това явление се дължи на разширението на извънклетъчната течност и/или на намалената реабсорбция както на Na +, така и на Ca 2+ в проксималната тубула [36]. Въпреки че се съобщава, че бъбречният кръвен поток е непроменен или понякога дори намален, когато натоварването със сол е хронично, като например в продължение на 8 седмици [37], от това проучване не може да се изключи приносът на разширяване на обема и/или хиперфилтрация, тъй като креатининовият клирънс има тенденция да се увеличава при натоварените със сол плъхове, макар и незначителни. Тъй като определянето на креатинин при гризачи може да варира в зависимост от използвания метод [38], използването на клирънс на инулин може да бъде благоприятно. Натриурезата под налягане е друг възможен фактор на индуцирана от солта калциурия, тъй като кръвното налягане на натоварени със сол плъхове има тенденция да се увеличава, въпреки че разликата не е статистически значима. Експериментите със сервоконтрол на бъбречната артерия биха били полезни за очертаването им в бъдеще.
Показано е, че в проксималната тубула NHE3 е важен като част от движещата сила за реабсорбция на Ca 2+, медиирайки апикално навлизане на Na + и съответно реабсорбция на вода, за да се получи осмотичен градиент [18]. В нашето проучване, бъбречният NHE3 протеин значително се увеличи с натоварване със сол. Това откритие обаче не е в съответствие с някои предишни проучвания, като това на Frindt и Palmer, които не откриват промяна в луминалната NHE3 с 5% NaCl диета за 1 седмица при плъхове, използващи in situ биотинилиране [42]. Тъй като регулирането на NHE3 се случва на множество нива, включително трафик, взаимодействащи протеини и олигомеризация [43], нивото на протеин може да не е пряко свързано с апикалната активност на NHE3. Ако активността на NHE3 действително се увеличи при плъхове, хранени с висока сол, това може да увеличи налягането за реабсорбция на Ca 2+ в проксималните тубули. Въпреки това, конкуренцията между Na + и Ca 2+ за мястото на свързване на парацелуларен транспорт може да възникне в проксималния канал. Съобщава се, че Ca 2+ инхибира парацелуларната Na + проводимост чрез конкурентно свързване с клаудин-2 [44]. Ако Na + и Ca 2+ споделят свързващо място, обратно, високият Na + може да инхибира проводимостта на клаудин-2 Ca 2+. Тази конкуренция между Na + и Ca 2+ може да играе голяма роля в диетичната NaCl-индуцирана хиперкалциурия.
Дебелият възходящ крайник на веригата на Henle е отговорен за приблизително 20% от реабсорбцията на Ca 2+. Показано е, че Claudin-16 и -19 са важни за парацелуларните Mg 2+ и Ca 2+ в този сегмент. В нашето проучване се наблюдава увеличение на фракционната екскреция на Mg, макар и по-малко от това на Ca. Въпреки това, няма значителна разлика в бъбречната клаудин-16 или -19 иРНК при плъхове на диета с високо съдържание на сол. Разширението на извънклетъчния обем намалява трансепителното напрежение и реабсорбцията на Mg 2+ в TAL [45]. Въпреки че не е пряко откриваемо в нашите експериментални условия, може да е имало някакво увеличаване на обема при плъхове, хранени с високо съдържание на сол, което може да е допринесло за увеличаване на фракционната екскреция на Mg 2+.
Дисталният нефрон е последното и най-регулирано място на реабсорбция на Ca 2+ в урината [46, 47]. Съвместно повишаване на нивата на експресия на TRPV5, калбиндин-D28k и NCX1 се наблюдава при натоварване със сол в това проучване. Клаудин-8, дисталната тубуларна парацелуларна катионна бариера, не се променя при натоварване със сол. Възможно е при натоварване със сол проксималната, парацелуларна реабсорбция на Са 2+ да бъде намалена и да се регулират по-дистални, трансцелуларни транспортни молекули на Са 2+, за да се улесни реабсорбцията на Са 2+ като компенсаторен механизъм. Въпреки това, натоварването със сол може да намали реабсорбцията на Ca 2+ чрез NCX1, както е показано на фигура 7. Следователно, регулирането на дисталните машини за транспортиране на Ca 2+ с хронично натоварване със сол може частично да компенсира загубата на Ca 2+ в урината, макар и с ограничен ефект.
Що се отнася до механизма на регулиране на TRPV5, калбиндин-D28k и NCX1 чрез диетичен NaCl, една от възможностите са ендокринните фактори, които регулират свързани с Ca 2+ молекули, като паратиреоиден хормон [48] и витамин D [49]. Например, 1,25 (OH) 2D е доказано, че увеличава изразите на TRPV5, calbindinD28k и NCX1 [35]. В това проучване обаче серумната концентрация от 1,25 (OH) 2D е значително по-ниска в групата с високо съдържание на сол, отколкото контролната група. Освен ако няма значителна разлика между серумните и интрареналните 1,25 (OH) 2D нива, вероятно е индуцираното от сол трансцелуларно повишаване на Ca 2+-транспортера да се медиира от пътища, различни от 1,25 (OH) 2D.
Слабостта на проучването включва липса на данни за регионална експресия, тъй като в проучването е използвана изрязана бъбречна кора. В бъдеще са необходими експерименти с имунохистологично оцветяване с по-висока разделителна способност и qRT-PCR/Western blot от микродисектирани тъканни проби. Това проучване обаче има за цел да постави основата за по-подробно механистично изследване на ефектите от хронично високо натриев хранителен прием върху експресията на бъбречните транспортери на Са и върху екскрецията на калций в урината.
Заключения
Нашите открития предполагат, че намаляването на бъбречния клаудин-2 протеин чрез натоварване със сол може да увеличи Ca 2+ в тубулната течност, достигаща до дисталния канал, докато съгласуваното регулиране на по-дистални Ca 2+ -обработващи молекули може да ограничи някои от Ca 2+ загуба в урината. Констатациите от нашето проучване могат да имат последици за по-нататъшни изследвания върху патофизиологията на остеопорозата, образуването на камъни в урината и хипертонията, свързани с прекомерен прием на сол.
- Оценка на модификацията на диетата при уравнение за изследване на бъбречната болест при голямо разнообразие
- Cookbook Ghostwriter - On The Renal Diet CaryPress Books
- Ранни ефекти на диетата с високо съдържание на мазнини върху нервно-съдовата функция и фокалната исхемична мозъчна травма американец
- Удълженото ежедневно гладуване отменя вредните ефекти от диетата с високо съдържание на мазнини. Проучването може да предложи без наркотици
- Вредните ефекти на диетичната сода