Свързани данни
Резюме
По-високите протеинови ястия увеличават ситостта и термичния ефект на храненето (TEF) при остри условия, но не е ясно дали тези ефекти остават, след като човек се адаптира към ограничаване на енергията или даден прием на протеин. Това проучване оценява ефектите на преобладаващия източник на протеин (всеяден, говеждо/свинско спрямо вегетарианско лакто-ово, соя/бобови растения) и количеството (10%, 20% или 30% от енергията от протеини) върху апетита, енергийните разходи и кардио-метаболитни индекси по време на ограничаване на енергията (ER) при възрастни с наднормено тегло и затлъстяване. Субектите са разпределени на случаен принцип към един източник на протеин и след това консумират диети с различни количества протеин (по 4 седмици всяка) по начин на рандомизирано кръстосване. Оценките за възприет апетит (свободно живеещи и в лаборатория), TEF и индексите за кардио-метаболизъм на гладно се оценяват в края на всеки 4-седмичен период. Източникът и количеството на протеина не повлияват TEF, глада или желанието за ядене, освен умерено по-високата дневна оценка на пълнотата на композита с 30% срещу 10% протеинова диета (p = 0,03). Докато 20% и 30% протеинови диети намаляват холестерола, триацилглицерола и APO-B срещу 10% протеин (p Ключови думи: диети с високо съдържание на протеини, ситост, термогенеза, метаболитен синдром, загуба на тегло
1. Въведение
Необходим е енергиен дефицит за възрастните с наднормено тегло и затлъстяване, за да отслабнат, а изследванията показват, че намаляването на енергийния прием и запазването на енергията на гладно и след хранене след хранене подкрепят този резултат [1]. Обикновено енергийният дефицит, предизвикан от диета, е свързан с повишен глад или намалена пълнота [2,3,4]. Тъй като протеинът обикновено е признат за най-индуциращия ситост макронутриент [5], а някои остри и краткосрочни проучвания за хранене потвърждават, че по-високият прием на протеини увеличава ситостта и намалява енергийния прием при следващото хранене [6,7], възрастните, които са на диета, могат да бъдете насърчавани да консумирате диети с високо съдържание на протеини.
Важното е, че повечето от тези остри и краткосрочни проучвания за хранене с протеини бяха проведени с помощта на субекти, които консумираха обичайните си самостоятелно избрани, енергийно балансирани диети преди дните на тестване. Също така, съдържанието на протеин в тестовите ястия варира значително в рамките на проучванията и често е извън допустимия диапазон на разпределение на макроелементи (AMDR) от 10% -35% от енергията от протеини [8]. По този начин субектите не се приспособяват към състояние на енергиен дефицит или към съдържанието на протеини в храненията/диетите, които обикновено биха консумирали по време на диета. Съществуват ограничени изследвания за въздействието на количеството протеини в храната върху постпрандиалните и ежедневни апетитни отговори от субекти, привикнали към енергийното и протеиновото съдържание на диетите, с противоречиви открития и методологии, използвани за измерване на възприемания апетит [3,9,10,11,12].
Високият прием на протеини също се предполага, че подпомага загубата на телесна маса, като помага да се запазят енергийните разходи в покой (REE) и да се увеличи термичният ефект на храненето (TEF) по време на период на ограничаване на енергията. Неотдавнашен мета-анализ показа, че диетите с високо съдържание на протеини смекчават загубата на чиста телесна маса по време на загуба на тегло [4], което е ключово за поддържане на енергийния разход в покой [13]. Също така, тъй като протеинът има най-висок TEF сред макронутриентите, смесеното хранене, съдържащо по-висок протеин, трябва да насърчи отрицателен енергиен баланс [10,14,15]. Като цяло, по-високият прием на протеини по време на ограничаване на енергията трябва да подпомага загубата на телесна маса както чрез апетитни, така и чрез енергийни ефекти, но доказателствата, че зависимите от протеини разлики в апетита и термогенезата се наблюдават, когато възрастните се привикнат към диетите, са ограничени.
Предишни проучвания предполагат, че източникът на протеин може също да повлияе на апетитните реакции и енергийните разходи в покой (гладуване и TEF) и потенциално да обясни несъответствията между проучванията. Някои изследвания показват, че източникът на протеин оказва влияние [16,17,18] или не [19,20] върху засищането и/или последващия прием на храна и оказва влияние [19,21] или не [22] върху разхода на енергия в покой.
Целта на това проучване беше да се оценят ефектите от приема на протеини в храната през ADMR с говеждо/свинско или соя/бобови растения като преобладаващ източник на протеини върху ежедневните и постпрандиални апетитни реакции при възрастни с наднормено тегло/затлъстяване, които бяха приспособени към енергийно ограничена диета . Ние предположихме, че увеличаването на приема на протеини ще подобри ежедневната и постпрандиалната ситост, докато преобладаващите протеинови източници няма да повлияят по различен начин на тези параметри. Също така оценихме ефектите от тези протеинови диети върху термогенните реакции на гладно и след хранене, както и индексите на сърдечно-метаболитното здраве (вторични цели).
2. Материали и методи
2.1. Набиране и скрининг
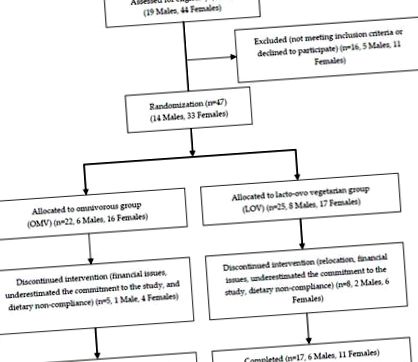
Проучете диаграмата на набиране на персонал.
2.2. Експериментален дизайн
2.2.1. Преглед на дизайна на проучването
След записването субектите завършиха 2 седмици от изходното събиране на данни и бяха разпределени на случаен принцип или към всеядната (OMV, говеждо/свинско като преобладаващ източник на протеин) или към лакто-ово вегетарианска (LOV, соя/бобови растения като преобладаващ източник на протеин) (Фигура 2 А). По време на изходното ниво, кръвните химикали на гладно, кръвното налягане, телесният състав/антропометрията се измерват в два отделни дни, енергийните разходи на гладно в един ден и почасовият апетит в продължение на три дни. След това субектите в групите OMV и LOV завършиха в произволен ред (дизайн на кръстосване) три последователни 4-седмични периода, в които консумираха диета с ограничено потребление на енергия (-750 kcal/ден), варираща в количеството протеин (10%, 20%, 30% от енергийния прием). В края на всеки 4-седмичен период се измерва почасов апетит в дни 25–27; кръвно налягане, телесен състав/антропометрия, апетит на гладно и след хранене, енергиен разход, гликемичен отговор и свободни от плазма аминокиселини (при подгрупа от 10 субекта) са измерени на 28-ия ден (Фигура 2 Б).
Схематично представяне на дизайна на проучването и графика: (A) надлъжен; (Б.) остро проучване в края на всеки 4-седмичен период (ден 28).
2.2.2. Компонент на надлъжното хранене на изследването (три последователни 4-седмични интервала на диетична интервенция)
Спазване на диетата: За да се насърчи спазването, на субектите бяха предоставени порционни количества от избрани храни (особено говеждо/свинско или соеви/бобови продукти) в дни 1–24 от всеки 4-седмичен период и всички храни и напитки в дни 25–27 от всеки период. Субектите са били посъветвани от регистриран диетолог да следват предписаните им менюта, за да постигнат желания прием на макронутриенти и енергия. На субектите беше предоставен списък с хранителни стоки, включващ имена на марки и списък за ежедневно меню с размери на порциите за всяка храна, която трябва да се закупи и консумира. По време на проучването субектите бяха насърчавани да консумират само предписаните и предоставени храни и напитки и да докладват за несъответствие в контролния списък на ежедневното меню.
Телесна маса/състав/антропометрия: Телесната маса на гладно се измерва два пъти седмично, за да се документира ефективността и спазването на енергийно ограничената диета. Телесната маса на гладно (обща маса - маса на халата) беше измерена с точност до 0,01 kg с помощта на цифрова платформа (модел ES200L, Ohaus Corporation, Pine Brook, NJ, USA) и височината на изправяне без обувки беше измерена с точност до 0,1 cm с монтиран на стената стадиометър. Съставът на тялото и обиколката на талията и тазобедрената става бяха измерени на изходно ниво в два отделни дни и на ден 28 от всеки 4-седмичен период. Съставът на тялото се определя в два екземпляра, използвайки система за плетизмография (BodPod, COSMED USA Inc.), която е чувствителна към измерване на малки до умерени промени в телесния състав по време на загуба на тегло [27]. Маслената маса (FM), обезмаслената маса (FFM) и процента FM и FFM се изчисляват от телесния обем, използвайки уравнението на Siri [28]. Обиколката на талията (естествена и пъпна) и тазобедрената става е измерена в два екземпляра с точност до милиметър с помощта на пружинна лента.
Оценка на апетита: На 25–27 дни от всеки 4-седмичен период субектите записват апетита си (ситост, глад и желание за ядене) при събуждане и на час до лягане, използвайки 100-милиметрова квазилогаритмична визуална аналогова скала (т.е. обща маркирана величина мащаб), с дескриптори, вариращи от „едва откриваеми“ до „най-силното усещане, което може да си представим от всякакъв вид“ [29].
Разход на енергия на почивка (REEf): След 10-часово бързо гладуване и почивка в легнало положение за 30 минути, производството на CO2 и консумацията на O2 се измерват чрез индиректна калориметрия с помощта на вентилиран сенник (MedGraphics Cardiopulmonary Diagnostics Systems, Medgraphics Corporation, Сейнт Пол, Минесота, САЩ). Уравнението на Уиър [30] беше използвано за оценка на REEf.
Вземане на кръв: Кръвните проби на гладно се събират от предтекубитална вена, като се използва венепункция в серумни и плазмени сепараторни епруветки, центрофугират се за 15 минути при 4000 об/мин и 4 ° C, аликвотни в 1 ml епруветки за микроцентрифугиране и се съхраняват при -80 ° C до размразени за анализ.
Липидно-липопротеинов профил: Общ холестерол на гладно, HDL холестерол (HDL-C) и триацилглицерол са анализирани от MidAmerica Clinical Laboratories с помощта на фотометричен анализ (Chemistry Immuno Analyzer AU5700, Olympus, Center Valley, PA, USA). LDL холестеролът (LDL-C) се изчислява, като се използва следното уравнение: LDL-C = общ холестерол - HDL-C - триацилглицерол/5 [31]. Аполипопротеин А1 (APO-A1) и аполипопротеин В (APO-B) бяха измерени с помощта на фотометричен анализ (Cobas Integra 400, Roche Diagnostic Systems, Indianapolis, IN, USA).
Анализи на глюкоза и инсулин: Глюкозата в серума е измерена с помощта на фотометричен анализ (Cobas Integra 400; Roche Diagnostic Systems, Indianapolis, IN, USA). Серумният инсулин се измерва с помощта на електрохимилуминесцентен имуноанализ (Elecsys 2010 Analyzer, Roche Diagnostic Systems, Indianapolis, IN, USA). Инсулиновата резистентност (HOMA-IR) се изчислява, като се използва: (глюкоза на гладно (mg/dL) × инсулин на гладно (µU/mL))/405 [32] и β клетъчната функция на панкреаса (HOMA-β,%) се изчислява, като се използва: ( 360 × инсулин на гладно (µU/mL))/(глюкоза на гладно (mg/dL) - 65) [33].
Кръвно налягане на гладно: След почивка в легнало положение в продължение на 30 минути, наклоненото и седнало систолично и диастолично кръвно налягане се измерват в два екземпляра върху недоминиращата ръка с помощта на автоматичен сфигмоманометър.
Бъбречен отговор: Азот на уреята в кръвта на гладно в кръвта на гладно и креатинин са измервани с помощта на фотометричен анализ (Chemistry Immuno Analyzer AU5700; Olympus, Center Valley, PA, USA), извършен от MidAmerica Clinical Laboratories. BUN се използва като сурогатен индикатор за приема на протеини с храната през всеки период [34]. Скоростта на гломерулна филтрация и креатининовият клирънс са оценени за оценка на бъбречната функция. Скоростта на гломерулна филтрация се определя с помощта на уравнението CKD-EPI (Хронична бъбречна епидемиологична колаборация), където Scr е серумен креатинин (mg/dL): κ е 0,7 за жените и 0,9 за мъжете, α е -0,329 за жените и -0,411 за мъжете, min показва минимума на Scr/κ или 1, а max показва максимума на Scr/κ или 1: Скорост на гломерулна филтрация = 141 × min (Scr/κ, 1) α × max (Scr/κ, 1) −1.209 × 0,993 Възраст × 1,018 (ако е жена) × 1,159 (ако е черна) [35]. Скоростта на изчистване на креатинина (mL/min) се определя, като се използва уравнението на Cockcroft-Gault, където Scr е серумен креатинин (mg/dL), BM е телесна маса в kg: скорост на изчистване на креатинина = [(140 - възраст) × BM/(Scr × 72)] × 0,85 (ако е жена) [36].
2.2.3. Остър компонент на хранене на изследването (Ден 28 от всеки 4-седмичен период)
Закуска: На 28-ия ден от всеки 4-седмичен период участниците докладват в клиничната лаборатория след поне 10-часово бързо гладуване. Субектите бяха посъветвани да не консумират никакъв кофеин или да се упражняват умишлено сутрин на тестване. След вземане на кръвни проби на гладно, кръвно налягане, апетит и REEf бяха направени изпитания, субектите консумираха тестово хранене, осигуряващо 25% от дневната им предписана енергия (-750 kcal/дневно ограничение) с количество протеин и източник, съответстващи на специфичната за периода диета. Тестовата храна се състоеше от порции от сандвич за закуска, съдържащ английска кифла, постно говеждо/свинско месо (OMV) или соеви банички за закуска (LOV) и сирене и поднесен с плодове и сок. На всеки субект е дадено 15 минути за завършване на тестовото хранене. Бяха събрани кръвни проби и анкетите за апетит бяха попълнени на минути 15, 25, 60, 85, 120, 180 и 240 след хранене. През това време на субектите не беше позволено да четат, да гледат телевизия, да говорят по мобилен телефон, да работят на компютър или да ядат или пият каквото и да било, освен предвиденото. След приключване на 4-часовия период на тестване, обядът беше изяден на място и бяха осигурени опаковани храни за вечеря.
Разход за енергия след почивка (REEpp): REEpp е измерен на 30–60, 90–120, 150–180, 210–240 минути след хранене, използвайки техниката на индиректна калориметрия, описана по-горе.
Безплазмени аминокиселини: За подпроба от субекти (5F OMV; 1M: 4F LOV) аминокиселините в плазма са количествено определени от Земеделската експериментална станция Химически лаборатории Университет на Мисури-Колумб [37]. Използваните кръвни проби са от време на гладно, 25, 60, 120, 180 и 240 минути след хранене.
2.3. Данни и статистически анализи
2.3.1. Изчисляване на мощността
Поради новостта на настоящите цели на проучването, проучването беше основно засилено да потвърди статистически диференцираните ефекти на количеството протеин върху пълнотата, с достатъчно субекти в отделните групи OMV и LOV. Други параметри, като глад, желание за ядене, енергийни разходи в покой и сърдечно-метаболитни здравни показатели не са взети предвид при определяне размера на груповата извадка. В резултат на това тези резултати от интерес се считат за вторични. Резултати от предишното ни проучване [3] показаха, че жените с наднормено тегло и затлъстяване, които са консумирали диета с по-високо съдържание на протеини (30% от енергията, с 40% от общия протеин от свинско месо) спрямо диета с по-ниско съдържание на протеини (18% от енергията и не консумираните меса ) по време на 12-седмичен период на ограничаване на енергията (–750 kcal/ден) имаше диференциална промяна в степента на пълнота, свързана с храненето, от 18 ± 17 mm (средно ± SEMs, по-голяма пълнота за група с по-високо съдържание на протеини). Въз основа на тези резултати ще са необходими n = 17 субекта от всяка група за откриване на диференциална реакция с 80% мощност при α = 0,05.
- Ефекти от диетите с ограничена енергия, съдържащи повишен протеин върху загуба на тегло, почивка на енергия
- Ефекти от хранителната енергия и съдържанието на протеини и източника на липиди върху ефективността на растежа и трупа
- Прием на фибри, хранителна плътност на енергията и диетичен тип прогноза за 6-месечно отслабване при свободен живот
- Ефекти от различни хранителни протеини и енергийни доставки върху растежа, телесния състав и протеините
- Ефекти от диетичното енергийно ниво и хранителния енергиен източник върху растежа, преобразуването на фуражите и тялото