Субекти
Резюме
Въведение
Черният дроб, в допълнение към мастната тъкан и скелетните мускули, е ключов играч в регулирането на глюкозния и липидния метаболизъм. Затлъстяването и диетата с високо съдържание на мазнини (HFD) са свързани с вътреклетъчното натрупване на липиди. Установено е, че дори краткосрочното HFD хранене при гризачи води до натрупване на чернодробна мазнина и инсулинова резистентност (IRes) 1. Във физиологичното състояние основната роля на инсулина в черния дроб е инхибирането на глюконеогенезата при наличие на високо ниво на глюкоза в плазмата. В състояние на инсулинова резистентност, изходът на глюкоза от черния дроб се увеличава поради чернодробни IRes. Основните фактори, които допринасят за това състояние, са следните: повишена скорост на чернодробна глюконеогенеза и дефекти в стимулирания от инсулин синтез на чернодробен гликоген. Метформин, широко използваното лекарство, сенсибилизиращо инсулина, води до намаляване на производството на чернодробна глюкоза 2,3, но механизмът, по който метформинът инхибира чернодробната глюконеогенеза, все още остава неизвестен.
Целта на предложеното проучване е да се определи дали лечението с метформин може да обърне инсулиновата резистентност, индуцирана от диетично хранене с високо съдържание на мазнини, и да получи по-нататъшно разбиране къде външните ФА са насочени в клетките. Нещо повече, ние се опитахме да изясним коя биоактивна липидна група играе основна роля в индуцирането на чернодробни IRes и на кое ниво липидите влияят върху инсулиновия път в черния дроб.
Резултати
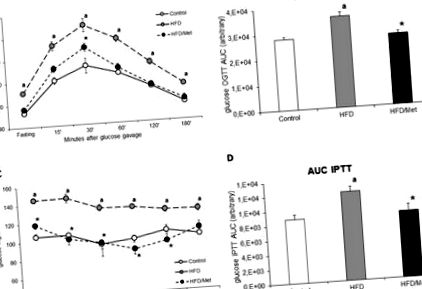
Резултати от теста HOMA-IR, OGTT и IPTT
Животните, хранени с HFD, развиват IR, което се доказва от повишена концентрация на глюкоза в кръвта на гладно, нарушен глюкозен толеранс, намалена инсулинова реакция и повишен HOMA-IR индекс. HOMA-IR индексът се е увеличил в групата с HFD с 46% (p Фигура 1
Плазмени FFA и общ чернодробен TG
Общата плазмена концентрация на FFA се увеличава в групата с HFD с 30% (p Фигура 2
Транспортери на мастни киселини
И в двете групи, хранени с HFD, съдържанието на всички измерени транспортери на мастни киселини (FABPpm, CD36, FATP2) се увеличава в сравнение с контролната група (p Фигура 3
В групата с HFD съдържанието на всички измерени видове DAG е значително по-високо в сравнение с контролната група (p Фигура 4
Влиянието на лечението с HFD и метформин върху инсулиновата сигнална каскада след in-vivo инсулинова стимулация
Състояние на фосфорилиране на IRS1 и AKT
Състоянието на фосфорилиране на IRS1 при HFD животни, измерено от pIRS до общия IRS, е значително по-ниско за Tyr632 и значително по-високо за Ser270, което предполага инхибиране на инсулиновата каскада на нивото на IRS1 протеин. Лечението с метформин нормализира състоянието на фосфорилиране на IRS до нивата, безразлични от контрола, но значително различни в сравнение с HFD животни. Съотношението на pAkt (Ser473) към нефосфорилиран Akt намалява в групата с HFD. Лечението с метформин възстановява фосфорилирането на Akt до контролни стойности. (Фиг. 5).
Експресия на протеин на FoxO1 и PEPCK1
Съотношението на фосфорилирана към нефосфорилирана форма на FoxO1 намалява в групата с HFD в сравнение с контролната група и се връща към контролните стойности при лечение с метформин. Резултатите показват, че лечението с HFD увеличава глюконеогенезата, сигнализираща чрез стимулиращо дефосфорилиране на FoxO1, докато метформинът инхибира чернодробната глюконеогенеза чрез инхибиторно фосфорилиране на FoxO1. Експресията на чернодробен протеин PEPCK1 при животни само с HFD отразява активирането на неговия транскрипционен регулатор FoxO1. Диета с високо съдържание на мазнини, регулирана експресия на протеин PEPCK1 в сравнение с контрола. Въпреки че лечението с метформин значително намалява съдържанието на PEPCK1 спрямо животните само с HFD, то не успя да нормализира този параметър, за да контролира стойностите.
Дискусия
Взети заедно, индуцираните от HFD IR предизвикват чернодробно натрупване както на съдържанието на керамиди, така и на DAG и инхибират инсулиновата сигнализация, докато лечението с метформин подобрява инсулиновата чувствителност, намалява съдържанието на керамид и DAG и увеличава чернодробната инсулинова сигнализация. Благоприятните промени в лечението с метформин са свързани с повишено митохондриално липидно канализиране, както се посочва от повишено съдържание на ацил-карнитин и митохондриални маркери, което е придружено от каскадно активиране на инсулин. Предполагаме, че индуцирането на IRes е кумулативен ефект от натрупването на активни липиди. Освен това в черния дроб инсулиновият сенсибилизиращ ефект на метформин се състои в засилен β-окислителен процес, който предпазва чернодробните клетки от активно липидно натрупване, което би повлияло на инсулиновия път. Освен това отговорихме на въпрос относно произхода на натрупаните липиди и демонстрирахме, че промените в липидите съответстват на de novo синтез.
Материали и методи
Животни и дизайн на изследване
Измервания на липидна конвенция
Западно петно
Следните целеви протеини бяха количествено определени с използване на първични антитела: GOT2 (FABPpm): (Novus Biologicals), CPTI; CD36; ACSVL1; FATP2; LASS4 (CerS4); IRS-1; p-IRS-1/2 (Ser 270): p-IRS-1 (Tyr632), GAPDH (Санта Круз биотехнологии): SPT; AMPK; pAMPK (T183 и T172) (Abcam), FoxO1; pFoxO1 (Ser256); COX IV, mTORPEPCK1 (клетъчно сигнализиране) и подходящи HRP конюгирани вторични антитела. Протеините се попиват върху PVDF мембрани, като се използва полусух трансфер и експресията се измерва чрез хемилуминесценция, използвайки система ChemiDoc XRS + (Hercules, СА) и ImageLab софтуер. Стойностите бяха нормализирани към експресията на GAPDH протеин, измерена от същия цикъл и изразени като кратни промени спрямо стойностите на контролната група. Освен ако не е посочено друго, всички химикали и оборудване, използвани за имуноблотинг, са закупени от Bio-Rad (Hercules, CA).
Тест за орална толерантност към глюкоза (OGTT)
OGTT при животни на гладно (6 часа) се извършва, както следва: глюкозата в кръвта се измерва преди и след 15, 30, 60, 120 и 180 минути след перорално приложение на глюкоза в доза от 3 g/kg. Кръвните проби от вените на опашката се измерват с помощта на глюкометър Accuchek (Roche, Германия). Площта под кривата на плазмената глюкоза за OGTT беше изчислена, като се използва трапецовидно правило както за оригиналните (фиг. 1), така и за нормализираните стойности на глюкозата на гладно (фигура S2).
Интраперитонеален тест за инсулинова толерантност (IPTT)
На гладно (6 часа) животните получиха интраперитонеална инжекция на инсулин в доза от 0,75 U/kg телесно тегло. Концентрацията на глюкоза се измерва върху проби, получени от вената на опашката с помощта на глюкометър Accuchek (Roche, Германия) на 0, 15, 30, 45, 60 и 90 минути след инжектирането на инсулин. Площта под кривата на плазмената глюкоза за IPTT беше изчислена, като се използва трапецовидно правило както за оригиналните (фиг. 1), така и за нормализираните стойности на глюкозата на гладно (фигура S2).
Плазмена концентрация на глюкоза и инсулин
Плазмената глюкоза се определя с помощта на глюкометър Accuchek (Roche, Германия). Плазменият инсулин се измерва с ELISA инсулинов анализ (комплект инсулин за плъх/мишка, Millipore).
HOMA-IR
Стойността на индекса HOMA-IR беше изчислена съгласно формула 38:
Концентрация на протеин
Съдържанието на протеин в хомогенати се измерва с помощта на съвместим с редуциращ агент BCA комплект за анализ на протеин. Говежди серумен албумин (без мастни киселини) се използва като стандарт за концентрация на протеин.
Статистически анализ
Статистическата значимост между групите беше изчислена с помощта на ANOVA с честно значимата разлика на Tukey (HSD) post-hoc тест за равни n-числа (n = 8). Нивото на значимост беше зададено на p
Препратки
Самуил, В. Т. и др. Механизъм на чернодробна инсулинова резистентност при неалкохолна мастна чернодробна болест. J Biol Chem 279, 32345–32353, https://doi.org/10.1074/jbc.M313478200 (2004).
Ву, М. С. и др. Ефект на метформин върху метаболизма на въглехидратите и липопротеините при пациенти с NIDDM. Грижа за диабета 13, 1–8 (1990).
Perriello, G. и др. Остри антихипергликемични механизми на метформин при NIDDM. Доказателства за потискане на липидното окисление и производството на чернодробна глюкоза. Диабет 43, 920–928 (1994).
Golay, A., Swislocki, A. L., Chen, Y. D. & Reaven, G. M. Връзки между концентрацията на мастни киселини без плазма, ендогенното производство на глюкоза и хипергликемията на гладно при нормални и неинсулинозависими пациенти с диабет. Метаболизъм 36, 692–696 (1987).
Кишоре, П. и др. Зависими от времето ефекти на свободните мастни киселини върху ефективността на глюкозата при диабет тип 2. Диабет 55, 1761–1768, https://doi.org/10.2337/db05-0988 (2006).
Schwenk, R. W., Holloway, G. P., Luiken, J. J., Bonen, A. & Glatz, J. F. Транспорт на мастна киселина през клетъчната мембрана: регулиране чрез транспортери на мастни киселини. Простагландини Leukot Essent мастни киселини 82, 149–154, https://doi.org/10.1016/j.plefa.2010.02.029 (2010).
Abumrad, N., Harmon, C. & Ibrahimi, A. Мембранен транспорт на дълговерижни мастни киселини: доказателства за улеснен процес. J Lipid Res 39, 2309–2318 (1998).
Кларк, D.C. и др. Свръхекспресия на свързан с мембраната протеин, свързващ мастните киселини (FABPpm) in vivo увеличава сарколемалния транспорт на мастните киселини и метаболизма. Физиолна геномика 17, 31–37, https://doi.org/10.1152/physiolgenomics.00190.2003 (2004).
Bu, S. Y. & Mashek, D. G. Чернодробна дълговерижна ацил-КоА синтетаза 5 медиира каналирането на мастните киселини между анаболните и катаболните пътища. J Lipid Res 51, 3270–3280, https://doi.org/10.1194/jlr.M009407 (2010).
Papaetis, G. S., Papakyriakou, P. & Panagiotou, T. N. Централно затлъстяване, диабет тип 2 и инсулин: изследване на пътека, пълна с тръни. Arch Med Sci 11., 463–482, https://doi.org/10.5114/aoms.2015.52350 (2015).
Martyn, J. A., Kaneki, M. & Yasuhara, S. Индуцирана резистентност и хипергликемия, предизвикана от затлъстяване: етиологични фактори и молекулярни механизми. Анестезиология 109, 137–148, https://doi.org/10.1097/ALN.0b013e3181799d45 (2008).
Guilherme, A., Virbasius, J. V., Puri, V. & Czech, M. P. Адипоцитни дисфункции, свързващи затлъстяването с инсулинова резистентност и диабет тип 2. Nat Rev Mol Cell Biol 9, 367–377, https://doi.org/10.1038/nrm2391 (2008).
Li, Y., Ding, L., Hassan, W., Abdelkader, D. & Shang, J. Adipokines и чернодробна инсулинова резистентност. J Диабет Res 2013, 170532, https://doi.org/10.1155/2013/170532 (2013).
Оукс, Н. Д. и др. Ново антидиабетно средство, BRL 49653, намалява наличността на липиди и подобрява действието на инсулина и глюкорегулацията при плъховете. Диабет 43, 1203–1210 (1994).
Ragheb, R. и др. Индуцирана на свободни мастни киселини инсулинова резистентност и дисфункция на усвояването на глюкоза: доказателства за активиране на ПКК и сигнални пътища, активирани от оксидативен стрес. Biochem Biophys Res Commun 389, 211–216, https://doi.org/10.1016/j.bbrc.2009.08.106 (2009).
Самуил, В. Т. и др. Инхибирането на протеинкиназата Cepsilon предотвратява чернодробната инсулинова резистентност при неалкохолно мастно чернодробно заболяване. J Clin Invest 117, 739–745, https://doi.org/10.1172/JCI30400 (2007).
Йорнайваз, Ф. Р. и др. Чернодробна инсулинова резистентност при мишки с чернодробна свръхекспресия на диацилглицерол ацилтрансфераза 2. Proc Natl Acad Sci САЩ 108, 5748–5752, https://doi.org/10.1073/pnas.1103451108 (2011).
Turinsky, J., O’Sullivan, D. M. & Bayly, B. P. Нива на 1,2-диацилглицерол и церамид в резистентни на инсулин тъкани на плъхове in vivo. J Biol Chem 265, 16880–16885 (1990).
Hanke, S. & Mann, M. Фосфотирозиновият интерактом от семейството на инсулиновите рецептори и неговите субстрати IRS-1 и IRS-2. Mol Cell Proteomics 8, 519–534, https://doi.org/10.1074/mcp.M800407-MCP200 (2009).
Franke, T. F., Kaplan, D. R., Cantley, L. C. & Toker, A. Директно регулиране на прото-онкогенния продукт на Akt чрез фосфатидилинозитол-3,4-бисфосфат. Наука 275, 665–668 (1997).
Petersen, K. F., Laurent, D., Rothman, D. L., Cline, G. W. & Shulman, G. I. Механизъм, чрез който глюкозата и инсулинът инхибират нетната чернодробна гликогенолиза при хората. J Clin Invest 101, 1203–1209, https://doi.org/10.1172/JCI579 (1998).
Галбо, Т. и др. Наситените и ненаситени мазнини индуцират чернодробна инсулинова резистентност независимо от сигнализирането на TLR-4 и синтеза на керамиди in vivo. Proc Natl Acad Sci САЩ 110, 12780–12785, https://doi.org/10.1073/pnas.1311176110 (2013).
Шулман, Г. I. Клетъчни механизми на инсулинова резистентност. J Clin Invest 106, 171–176, https://doi.org/10.1172/JCI10583 (2000).
Самуел, В. Т. и Шулман, Г. I. Механизми за инсулинова резистентност: общи нишки и липсващи връзки. Клетка 148, 852–871, https://doi.org/10.1016/j.cell.2012.02.017 (2012).
Ю, С. и др. Механизъм, чрез който мастните киселини инхибират инсулиновото активиране на инсулиновия рецепторен субстрат-1 (IRS-1) асоциирана фосфатидилинозитол 3-киназна активност в мускулите. J Biol Chem 277, 50230–50236, https://doi.org/10.1074/jbc.M200958200 (2002).
Manning, B. D. & Cantley, L. C. AKT/PKB сигнализация: навигация надолу по течението. Клетка 129, 1261–1274, https://doi.org/10.1016/j.cell.2007.06.009 (2007).
Chavez, J. A. & Summers, S. A. Изглед, ориентиран към керамидите на инсулиновата резистентност. Cell Metab 15, 585–594, https://doi.org/10.1016/j.cmet.2012.04.002 (2012).
Холандия, W. L. и др. Индуцирана с липиди инсулинова резистентност, медиирана от провъзпалителния рецептор TLR4, изисква биосинтез на керамид, индуциран от наситени мастни киселини при мишки. J Clin Invest 121, 1858–1870, https://doi.org/10.1172/JCI43378 (2011).
Лууконен, П. К. и др. Чернодробните керамиди дисоциират стеатозата и инсулиновата резистентност при пациенти с безалкохолна мастна чернодробна болест. J Хепатол 64, 1167–1175, https://doi.org/10.1016/j.jhep.2016.01.002 (2016).
Guo, Z. & Jensen, M. D. Интрамускулен метаболизъм на мастни киселини, оценен със стабилни изотопни маркери. J Appl Physiol 84, 1674–1679 (1998).
Guo, Z., Nielsen, S., Burguera, B. & Jensen, M. D. Оборот на свободни мастни киселини, измерен с помощта на свръхниски дози [U-13C] палмитат. J Lipid Res 38, 1888–1895 (1997).
Lee, H. B. & Blaufox, M. D. Обем на кръвта при плъхове. J Nucl Med 26, 72–76 (1985).
Serikawa, T. и др. Национален проект BioResource-Плъх и свързани дейности. Опит Anim. 58, 333–341, doi: JST.JSTAGE/expanim/58.333 [pii] (2009).
Persson, X. M., Blachnio-Zabielska, A. U. & Jensen, M. D. Бързо измерване на концентрацията на свободни мастни киселини в плазмата и изотопно обогатяване с помощта на LC/MS. J Lipid Res 51, 2761–2765, https://doi.org/10.1194/jlr.M008011 (2010).
Blachnio-Zabielska, A. U., Persson, X. M., Koutsari, C., Zabielski, P. & Jensen, M. D. Метод с течна хроматография/тандемна масспектрометрия за измерване на in vivo включване на свободни от плазма мастни киселини в интрамиоцелуларни керамиди при хората. Спектър за бърза комуникация 26, 1134–1140, https://doi.org/10.1002/rcm.6216 (2012).
Blachnio-Zabielska, A. U., Zabielski, P. & Jensen, M. D. Вътремиоцелуларни концентрации на диацилглицерол и [U-13C] изотопно обогатяване на палмитат, измерено чрез LC/MS/MS. J Lipid Res 54, 1705–1711, https://doi.org/10.1194/jlr.D035006 (2013).
Sun, D., Cree, M. G., Zhang, X. J., Bøersheim, E. & Wolfe, R. R. Измерване на стабилно изотопно обогатяване и концентрация на дълговерижни мастни ацил-карнитини в тъкан чрез HPLC-MS. J Lipid Res 47, 431–439, https://doi.org/10.1194/jlr.D500026-JLR200 (2006).
Cacho, J., Sevillano, J., de Castro, J., Herrera, E. & Ramos, M. P. Валидиране на прости индекси за оценка на инсулиновата чувствителност по време на бременност при плъхове Wistar и Sprague-Dawley. Am J Physiol Endocrinol Metab 295, E1269–1276, https://doi.org/10.1152/ajpendo.90207.2008 (2008).
Благодарности
Тази работа беше подкрепена от Фондация за полски научен грант HOMING PLUS/2010-2/1 и от Медицинския университет в Белосток (Grants N/ST/ZB/16/004/1118, N/ST/ZB/16/005/1118 и N/ST/ZB/16/010/1118).
Информация за автора
Принадлежности
Катедра по медицинска биология, Медицински университет в Белосток, Белосток, Полша
Катедра по физиология, Медицински университет в Белосток, Белосток, Полша
Piotr Zabielski, Marta Chacinska, Jan Gorski & Agnieszka U. Blachnio-Zabielska
1-ва катедра по обща хирургия и ендокринология, Медицински университет, Белосток, Белосток, Полша
Хади Разак Хади
Катедра по хигиена, епидемиология и метаболитни нарушения, Медицински университет в Белосток, Белосток, Полша
Марта Чачинска, Камила Рощиц и Агнешка У. Блачно-Забелска
Департамент по фундаментални науки, Факултет по здравни науки, Държавен университет за приложни науки в Ломжа, Ломжа, Полша
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Вноски
H.R.H., M.C., K.R., J.G., участва в събирането на данни и прегледа ръкописа. P.Z. и A.B.Z. проектира експериментите, участва в събирането и анализа на данни, пише и редактира ръкописа.
Автора за кореспонденция
Етични декларации
Конкуриращи се интереси
Авторите не декларират конкуриращи се интереси.
Допълнителна информация
Бележка на издателя: Springer Nature остава неутрален по отношение на юрисдикционните претенции в публикувани карти и институционални принадлежности.
- КАКВО ПРЕДСТАВЛЯВА АЦИДОЗАТА Ацидоза; Лечение Високоалкална диета
- С висок риск от генетично затлъстяване, здравословното хранене има най-голям ефект върху теглото Article AMP Reuters
- Защитният ефект на диета, обогатена с елда, върху бъбречно увреждане при силно индуцирано от сол
- Вонящият страничен ефект от вашата високо протеинова диета - VICE
- Терапевтична модификация на нормалната диета; Тяхната употреба в диетичното лечение жадува за битове