Резюме
Заден план
Нутрицевтиците представляват нова терапевтична граница в лечението на метаболитен синдром (MetS) и свързаните сърдечно-съдови рискови фактори. Целта на това проучване е да се оценят потенциалните благоприятни ефекти на Armolipid Plus (AP) (берберин 500 mg, ориз с червена киселина, монаколин К 3 mg и поликозанол 10 mg) върху инсулиновата резистентност, липидния профил, особено върху малкия и плътен LDL холестерол (sdLDL-C), представляващ най-атерогенните компоненти, както и неговите ефекти върху високочувствителния С-реактивен протеин, забележим маркер за сърдечно-съдов риск, кръвно налягане и преустройство на сърцето при лица, засегнати от MetS, с хипертрофия на лявата камера.
Методи
Изследването е проспективно, многоцентрово, рандомизирано, двойно сляпо, плацебо контролирано проучване. Сто и петдесет и осем пациенти на възраст между 28 и 76 години бяха включени и рандомизирани да получават или една таблетка AP или плацебо (PL) веднъж дневно в продължение на 24 седмици. Антропометрични и жизнени параметри, общ холестерол (tot-C), липопротеинов холестерол с ниска плътност (LDL-C), липопротеинов холестерол с висока плътност (HDL-C), триглицеридемия (TG), не-HDL холестерол (NHDL-C) и sdLDL -C бяха оценени.
Резултати
След 24 седмици лечение, анализът, извършен върху 141 пациенти (71 в рамо с АР и 70 в рамо с ПЛ), показва значително подобрение на липидния профил в групата с АР, с намаляване на tot-C (- 13,2 mg/dl), LDL-C (- 13,9 mg/dl) и NHDL-C (- 15,3 mg/dl) и повишаване на HDL-C (+ 2,0 mg/dl). Тези промени са еднакво значими в сравнение с плацебо (tot-C: AP - 13,2 mg/dL срещу PL + 2,7 mg/dL, стр
Въведение
Метаболитният синдром (MetS) е често срещано клинично състояние в западния свят, свързано с повишен риск от сърдечно-съдови заболявания (ССЗ) [1, 2].
Това състояние се характеризира с висцерално затлъстяване, високи стойности на кръвното налягане и инсулинова резистентност (IR), което насърчава атерогенен липиден профил, с повишени триглицериди (TG), повишен липопротеинов холестерол с много ниска плътност (VLDL-C) и намален липопротеинов холестерол с висока плътност (HDL-C), което води до увеличаване на не-HDL холестерола (NHDL-C).
Инсулиновата резистентност е състояние, при което физиологичното количество инсулин има намален ефект върху гликемичния контрол след прандиал с неадекватна инсулинова супресия през нощта. Първоначално се противодейства чрез увеличаване на освобождаването на инсулин, за да се поддържа нормална серумна стойност на глюкозата. С течение на времето този компенсаторен механизъм има тенденция да стане неадекватен, така че пациентите развиват хипергликемия след хранене и след това на гладно. Той също така намалява усвояването на глюкоза, причинявайки намаляване на запасите от мускулен гликоген, насърчава чернодробната глюконеогенеза и повишава симпатиковия тонус. Доказано е, че хиперинсулинемията при пациенти без диабет е свързана с повишена честота на сърдечно-съдови събития, независимо от метаболитния липиден профил [1, 2].
Добре известно е, че хиперхолестеролемията е независим рисков фактор за ССЗ и особено нивата на липопротеините с ниска плътност (LDL-C) над горната нормална граница причиняват повишен сърдечно-съдов риск. С помощта на електрофореза могат да бъдат идентифицирани 7 подфракции на LDL-C, спрямо намаляващия размер и нарастващата плътност. Подфракциите 3 до 7, които обикновено се идентифицират като LDL-C с малка плътност (sdLDL-C), са доказано по-атерогенни от по-големите LDL-C частици, поради по-продължителната им устойчивост в циркулация, по-голямата им податливост на окисляване и гликиране и засилен афинитет към протеогликани в артериалната стена [3,4,5,6,7,8,9,10]. Беше забелязано, че повишената плазмена концентрация на sdLDL-C има тенденция да корелира с високите плазмени TG и ниските нива на HDL-C, които са ключови характеристики на MetS. Освен това, повишаването на нивото на sdLDL-C изглежда е пряко свързано с броя на компонентите на MetS, така че може да представлява маркер за диагностика и тежест на този синдром [11,12,13,14,15,16]. Клиничните проучвания показват, че повишената плазмена концентрация на sdLDL-C е значително свързана с повишен риск при ССЗ [17,18,19,20,21].
Докладът за панел за лечение на възрастни III идентифицира MetS като вторична цел на терапията при лечението на ССЗ, в допълнение към понижаващата LDL-C терапия [22,23,24,25].
Широката фенотипна хетерогенност на MetS и неговата сложна патогенеза затрудняват идентифицирането на една терапевтична цел. Текущият терапевтичен подход на синдрома се основава на стабилни промени в начина на живот и често изисква сложен режим на много лекарства, като се обръща индивидуално към компонентите на синдрома. Това води до високи разходи, лошо съответствие и малко резултати, с повишен риск от странични ефекти.
Хиполипидемичните лекарства, които днес са на разположение, са доказали ефективността си при намаляване на LDL-C и също sdLDL-C. Въпреки това е доказано, че те имат релевантни взаимодействия с други често използвани лекарства и не са пренебрежими странични ефекти.
Нефармакологичните възможности за лечение на дислипидемия биха могли да бъдат добра алтернатива, подобрявайки съответствието на пациентите [26].
Последните проучвания демонстрират ефикасността на нутрицевтичните комбинации за намаляване на липидните плазмени стойности, без повишаване на нивото на CPK, миалгия или миопатия, което ги прави добри кандидати за терапия за понижаване на холестерола при пациенти с непоносимост към често срещани лечения [27,28,29]. Освен това, тази терапия се оказа безопасна и при деца, засегнати от хетерозиготна фамилна хиперхолестеролемия [30].
Целта на това проучване беше да се изследват ефектите на нутрицевтична комбинация върху инсулиновата резистентност, липидния метаболизъм и LDL-C подтиповете при пациенти с MetS и хипертрофия на лявата камера. Нутрицевтичната комбинация, използвана в това проучване, се състои от една таблетка, съдържаща берберин (BRB 500 mg), червен ориз (RYR) (монаколин К 3 mg) и поликозанол 10 mg (Armolipid Plus®, AP, Rottapharm Madaus, Италия).
Материали и методи
Уча дизайн
Проучването е проспективно многоцентрово, рандомизирано, двойно сляпо, плацебо контролирано проучване, състоящо се от скринингово посещение и 24-седмичен период на лечение. Проведено е в три центъра, включително два в Университета по медицина и хирургия в Неапол „Federico II“ и един в Университетската болница в Терни. Институционалният комитет по етика на всеки обект одобрява протокола за изследване, преди да започне някаква дейност, свързана с изпитването (Università degli Studi di Napoli Federico II: номер на протокол 13/12 за център 1 и 28/12 за център 3; Aziende Sanitarie Umbria: номер на протокол 2026/12) и от всеки пациент е получено писмено информирано съгласие. Изследването е проведено в съответствие с принципите на Декларацията от Хелзинки.
Пациенти и лечение
Участниците в проучването са наети между април 2013 г. и юли 2014 г.
Критериите за допустимост бяха: (1) възраст между 18 и 70 години; (2) диагностика на MetS, дефинирана като наличие на обиколка на талията ≥ 94 cm (мъжки), ≥ 80 cm (женска), свързана с поне две от следните: систолично кръвно налягане (SBP) ≥ 130 mmHg или диастолна кръв налягане (DBP) ≥ 85 mmHg или нужда от антихипертензивна терапия; глюкоза на гладно (FG) ≥ 100 mg/dL; HDL-C 48 g/m 2,7 (мъжки) или> 44 g/m 2,7 (женски) и (4) способност за разбиране и даване на информирано съгласие за клинични експерименти.
Критериите за изключване бяха: (1) доказана непоносимост към който и да е компонент на нутрицевтичното съединение; (2) бременност или кърмене; (3) лечение с хипогликемични средства и/или гликиран хемоглобин (HbA1c) ≥ 6,5%; (4) умерена до тежка чернодробна дисфункция (дете В-С); (5) нарушена бъбречна функция (eGFR 2); (6) серумни триглицериди> 500 mg/dL; (7) тежко затлъстяване (индекс на телесна маса (ИТМ)> 35 Kg/m 2); (8) анамнеза или настоящи симптоми на сърдечна недостатъчност; (9) систолна дисфункция на лявата камера (фракция на изтласкване на лявата камера (LVEF) ≤ 40%); (10) хипертрофична кардиомиопатия; (11) стеноза на сърдечната клапа; (12) предшестващ миокарден инфаркт; (13) индуциран от пейсмейкър камерния ритъм; (14) умерена до тежка регургитация на сърдечната клапа; (15) неконтролирана хипертония въпреки оптималната терапия (PAS> 140 mmHg o PAD> 90 mmHg). Включени са пациенти със съпътстващо заболяване, при условие че техните клинични състояния и лечение са били стабилни през предходните три месеца и не са имали големи клинични събития.
Сто и петдесет и осем пациенти, отговарящи на критериите за допустимост, бяха включени в проучването. Пациентите бяха рандомизирани да получават или една таблетка Armolipid Plus.
(MEDA-Rottapharm SpA; 1 таблетка/ден, съдържаща 200 mg RYR [еквивалентно на 3 mg монаколин К], 500 mg берберин, 10 mg поликозаноли, 0,2 mg фолиева киселина, 2,0 mg коензим Q10 и 0,5 mg на астаксантин; RYR, съдържащ се в Armolipid Plus, не съдържа цитринин и афлатоксини) или плацебо (1 таблетка/ден, идентична на вкус и външен вид на таблетката Armolipid Plus, но съдържаща микрокристална целулоза, железен оксид кафяв 70, Compritol E ATO [Gattefoss_e Saint-Priest, Лион, Франция] и магнезиев стеарат). Рандомизацията и заслепяването бяха осигурени от Rottapharm Madaus SpA (Монца, Италия), която също финансира проучването. Рандомизацията беше извършена в съотношение 1: 1 в съответствие с компютърно генериран списък за рандомизация, съдържащ рандомизационните кодове за постепенно присвояване на пациентите и използван за дозиране на лечението. Изследователският персонал и изследователите, както и всички пациенти, бяха заслепени за разпределението на групата. Кодовете за рандомизация се съхраняват в запечатан плик, който не се отваря до приключване на проучването и анализ на данните. В плацебо групата 44 пациенти са били лекувани със статини. По същия начин, в групата с AP, 44 пациенти са били лекувани със статини.
Резултати
Основните крайни точки бяха да потвърдят метаболитните ефекти на AP върху инсулиновата резистентност (IR), при пациенти с MetS и хипертрофия на лявата камера и да оценят ефектите от лечението върху липидния профил, особено върху малкия и плътен LDL холестерол (sdLDL-C), представляващ най-атерогенните компоненти. Вторичните крайни точки са неговите ефекти върху сърдечното ремоделиране, кръвното налягане и С-реактивния протеин Hs (CRP-Hs), забележим маркер за сърдечно-съдов риск. Тази статия ще разгледа само метаболитната част от клиничното изпитване.
Клинични и структурни измервания
Записана е 12-отводна ЕКГ в покой и е извършена базална ехокардиография. Всички записи на ехокардиографските изследвания бяха оценени, заслепени, от един оператор на координационния център. Оценката на LVM е извършена съгласно препоръките на Американското дружество по ехокардиография [31]. Пациентите бяха рандомизирани да получат лечението. След 4 седмици. по време на лечението беше планирано телефонно обаждане за проверка на спазването на лечението, регистриране на всички промени в съпътстващите лекарства и нежелани събития. След 12 седмици. пациентите са подложени на ново клинично посещение и кръвни изследвания за проследяване на параметрите за безопасност. По време на проучването са наблюдавани съпътстващи лекарства и нежелани събития.
Статистически анализ
Статистическите анализи бяха извършени с помощта на софтуер SAS (версия 9.3; SAS Institute, Cary, NC, USA). Описателните резултати са изразени като средно ± стандартно отклонение (SD) или проценти, в зависимост от вида на променливата. Промени в параметрите за ефикасност от изходно ниво до 24 седмици. са сравнени между лекуваните групи чрез еднопосочен дисперсионен анализ (ANOVA) с лечението като фактор. В допълнение, за да се вземе предвид употребата на статини при оценка на ефекта от лечението, беше извършена ANOVA с лечение и употреба на статини (да/не) като фактори. Сравнения в рамките на лечебната група между изходното ниво и стойността на седмица. 24 бяха проведени с помощта на сдвоения t-тест. Значението за всички анализи беше определено на P
Резултати
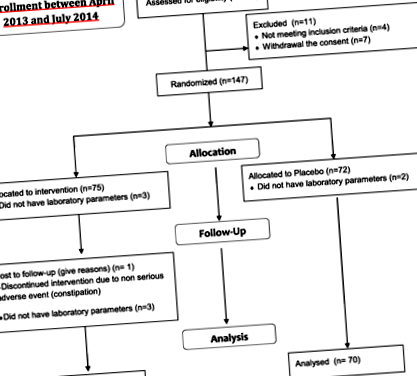
Сто петдесет и осем пациенти, на възраст между 28 и 76 години, отговарящи на критериите за допустимост от нашето проучване, бяха записани. Сто четиридесет и един пациенти (71 в рамото на AP и 70 в рамото на PL) са имали лабораторни параметри, анализирани от координационния център. От останалите 17, 5 пациенти нямат лабораторни параметри, анализирани от координационния център, докато 12 пациенти са прекратили преждевременно проучването (4 поради нарушение на протокола на критериите за включване/изключване, 7 поради оттегляне на съгласието и 1 пациент, в групата с AP, поради несериозни нежелани събития, свързани с лечението) (фиг. 1).
Проучете диаграмата на потока
Клиничните характеристики на пациентите са показани в таблица 1. На изходно ниво двете групи са сравними по възраст, пол, съпътстващи хиполипидемични лекарства, антропометрични параметри и нива на липидите. В плацебо групата 44 пациенти са били лекувани със статини. По същия начин, в групата с AP, 44 пациенти са били лекувани със статини.
След 24 седмици. на лечението, сравнението на абсолютните промени от изходното ниво между 2-те групи не показа значителни вариации за плазмената глюкоза на гладно и инсулина, точно както оценката на модела на хомеостазата на инсулиноустойчивия индекс (HOMA-IR), докато се установи значително подобрение в липидния профил рамото на AP (Tab.2) с намаляване на общия холестерол (Tot-C) (AP = - 11 mg/dl спрямо PL: + 3, стр 0,05) (Таблица 2).
Въпреки че не е наблюдавана значителна разлика между двете рамена в намаляването на HDL-C, въпреки това тя се е увеличила значително в групата на AP (AP = + 2 mg/dL стр Фиг. 2
И накрая, наблюдавахме значително подобрение на CRP-Hs в групата с AP в сравнение с PL (от 1,85 ± 2,34 до 1,25 ± 1,54 mg/L срещу от 1,35 ± 1,01 до 1,58 ± 1,83 mg/L, P Фиг. 3
Не са наблюдавани значителни вариации в телесното тегло, обиколката на талията и кръвното налягане, както в рамките на групата, така и между групите.
Не са наблюдавани промени в бъбречните и чернодробните параметри през целия период на изследване. По принцип AP се понася добре и не настъпва сериозно нежелано събитие, свързано със спериментално лечение.
Дискусия
Нашето проучване не потвърждава ефектите на AP върху IR, докато потвърждава ефикасността и безопасността на AP при подобряване на липидния метаболизъм в местна популация от пациенти, страдащи от MetS. при пациенти с MetS. След 24 седмици лечение наблюдаваме значително намаляване на tot-C, NHDL-C и LDL-C, с увеличаване на размера на sdLDL-C.
Това проучване за първи път оценява нутрицевтичните ефекти на BRB върху sdLDL-C в популация с MetS. След периода на лечение установихме значително подобрение в размера на sdLDL-C, свързано с повишаване на нивото на HDL-C в рамото на AP, в сравнение с PL рамото, което обикновено се счита за защитно средство срещу сърдечно-съдови заболявания.
И накрая, пациентите в активното рамо също показаха подобрение в нивата на NHDL-C, класически повишени в MetS, което изглежда забележимо поради приноса му към сърдечно-съдовия риск и уврежданията на ендотела, също потвърдено от намаляването на стойностите на CRP-Hs, установено по време на AP лечение.
Интересно е да се отбележи, че нашите данни потвърждават, че терапевтичният ефект на AP е очевиден и при онези пациенти, които вече са били на лечение със статини [32].
От „фармакодинамична“ гледна точка някои от тези резултати могат да се дължат на ефектите на BRB върху липидния метаболизъм. BRB увеличават експресията на LDL рецептор (LDLR) върху хепатоцитната мембрана, насърчавайки нейната генна транскрипция, чрез индуциране на стабилизиране на LDLR-mRNA и инхибиране на неговото лизозомно разграждане, медиирано от PCSK9 [33]. Този механизъм е независим от вътреклетъчните нива на холестерола и може да противодейства на индуциращия ефект на статините върху PCSK9, което води до контрапродуктивно повишаване на LDLC плазмените нива, което има тенденция да намалява липидо-понижаващия ефект на лекарството. Фармакологичната и нутрицевтична комбинация може да доведе до синергична ефикасност. BRB също така е в състояние да инактивира ацетил КоА карбосилазата чрез аденозин монофосфатна киназа, ключов ензим, участващ в синтеза на мастни киселини, което води до увеличаване на окисляването на мастните киселини, намаляване на синтеза на мастни киселини и инхибиране на синтеза на TG [33].
Има някои ограничения, които трябва да вземем предвид, като например кратката продължителност на последващото проучване. Със сигурност другото важно ограничение на това проучване е наличието на терапия за понижаване на холестерола; този избор обаче се определя от етични причини, което ни накара да изберем дизайн „отгоре“. Освен това предполагаме, че липсата на ефект на ARM върху инсулиновата чувствителност може да се дължи на лечение със статини, като се има предвид неговият добре известен положителен ефект върху инсулиновата чувствителност.
Заключение
Това е първото проучване, което оценява нутрицевтичния ефект на съединение като BRB върху sdLDL-C в популация с висок риск от ССЗ като пациенти, засегнати от MetS. Нашите резултати показват, че при популация от пациенти, страдащи от MetS, лечението с AP е ефективно и безопасно за подобряване на липидния профил и по-атерогенните фактори, също и при пациенти, които вече са подложени на лечение със статини, като по този начин намалява риска от развитие и прогресия на атеросклероза, особено при лица с висок риск от ССЗ за наличие на атерогенен sdLDL-C.
Профилът на безопасност на комбинираната терапия подкрепя използването й при пациенти, които не понасят статини или не постигат терапевтични цели с единична терапия.
Необходими са по-нататъшни проучвания с дългосрочно проследяване, за да се потвърдят тези обещаващи резултати и да се оценят техните ефекти върху заболеваемостта и смъртността от сърдечно-съдови заболявания.
- Ефикасност на промените в начина на живот при пациенти с безалкохолна чернодробна стеатоза и метаболитен синдром
- Корекция на липидния и пуриновия метаболизъм при пациенти с артериална хипертония, затлъстяване и подагра
- Диетични модели и метаболитен синдром в японско работещо население Хранене; Метаболизъм пълен
- Диета за бърз метаболизъм Как да коригирате увредения си метаболизъм, да увеличите метаболизма си, да ядете повече,
- CrossFit Доказателство за проучване с ниско съдържание на въглехидрати за устойчиво обръщане на метаболитен синдром