Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Кореспонденция
Джора ван Стратен, Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Yalelaan 8, 3508 TD Утрехт 80154, Холандия
Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Фармацевтичен факултет, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Фармацевтичен факултет, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Кореспонденция
Джора ван Стратен, Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Yalelaan 8, 3508 TD Утрехт 80154, Холандия
Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Фармацевтичен факултет, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Катедра по клинични науки за домашни животни, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Фармацевтичен факултет, Факултет по ветеринарна медицина, Университет Утрехт, Утрехт, Холандия
Резюме
Заден план
Хиперамонемията може да доведе до чернодробна енцефалопатия, която в тежки случаи в крайна сметка може да доведе до кома и смърт. При кучетата вродените портосистемни шунтове (CPSS) са най-честата причина за хиперамонемия. Консервативното лечение се състои от диета, модифицирана с протеини, неабсорбиращи се дизахариди, антибиотици или някои комбинации от тях. Натриевият бензоат (SB) и натриевият фенилбутират (SPB) се използват при острото и дългосрочно лечение на хора с хиперамонемия, причинена от ензимен дефицит на урейния цикъл. Смята се, че и двете лечения намаляват концентрациите на амоняк в кръвта, като стимулират отделянето на излишния азот по алтернативни пътища.
Цели
Да се оцени ефикасността и безопасността на PO лечението със SB и SPB при хиперамонемия и клинични признаци при CPSS кучета.
Методи
Рандомизирано, двойно-сляпо, плацебо-контролирано кросоувър проучване. Концентрациите на амоняк и жлъчни киселини в кръвта бяха измерени при CPSS кучета преди и след 5-дневно лечение със SB, SPB и плацебо. Използва се период на измиване от 3 дни между леченията. Разработен е стандартен въпросник, който се разпространява сред собствениците за оценка на клиничните признаци преди и след всяко лечение.
Резултати
Концентрациите на амоняк в кръвта не са повлияни от нито едно от леченията и са сравними с тези, наблюдавани по време на плацебо лечението. Освен това лечението със SB и SPB не води до подобряване на клиничните признаци. Неблагоприятните ефекти по време на лечението включват анорексия, повръщане и летаргия.
Заключения и клинично значение
Въз основа на нашите резултати заключаваме, че SB или SPB не са полезни при консервативното лечение на хиперамонемия при кучета с CPSS.
Съкращения
1. ВЪВЕДЕНИЕ
Амонякът е ключов фактор в патогенезата на чернодробната енцефалопатия (HE), 1-4 синдром, който включва широк спектър от невродегенеративни усложнения и в тежки случаи може дори да доведе до кома и смърт. 5 Поради това детоксикацията на амоняк е от съществено значение за поддържане на хомеостазата и се осъществява главно чрез превръщане на амоняк в урея чрез урейния цикъл в черния дроб и чрез синтеза на глутамин. 6
Хиперамонемията при кучета е предимно вторична спрямо вродените портосистемни шунтове (CPSS). 7-9 Тези CPSS са съдови аномалии, които свързват порталната вена със системната циркулация, като по този начин заобикалят чернодробните синусоиди. 10 В резултат на това притокът на кръв от порталната вена през чернодробния паренхим може да бъде намален с> 95%, като 11 пренася чревни абсорбционни продукти (напр. NH3) директно в системното кръвообращение. Това води до намаляване на уреагенезата и причинява хиперамонемия. 11 Намалената експресия на ензимния цикъл на уреята, което е доказано, че се наблюдава при CPSS кучета, 12 също може да играе роля в патогенезата на хиперамонемия при засегнатите кучета.
Хирургичното затваряне на шунта се счита за идеалното лечение на CPSS и е доказано, че води до значително по-дълго време за оцеляване в сравнение с консервативно лекуваните кучета с CPSS. 13 Консервативното управление е необходимо, когато не се постигне пълно затваряне на шунта след хирургическа интервенция, когато хирургическата намеса е противопоказана по медицински причини и в случай на финансови ограничения. Препоръчваното консервативно лечение е насочено към намаляване на производството и абсорбцията на амоняк от стомашно-чревния тракт. Предложените лечения се състоят от растителен протеин или диета с ограничено съдържание на протеини в комбинация с медицински интервенции като прилагане на неабсорбируеми дизахариди (напр. Лактулоза), антибиотици (напр. Неомицин и метронидазол) или и двете. 14.
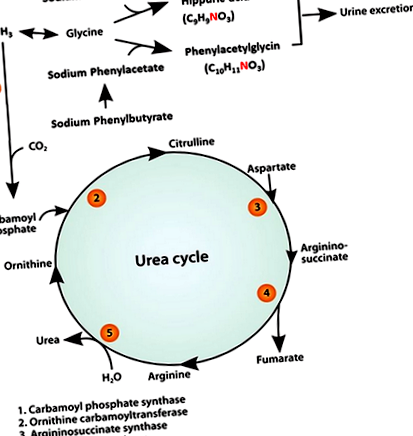
В продължение на много години IV натриев бензоат (SB) и натриев фенилацетат (SPA) се препоръчват за остро лечение на хиперамонемия и HE при пациенти с човешки дефицит на ензимен цикъл на урея (UCED). Съобщава се, че SB и SPA намаляват концентрациите на амоняк в кръвта, като осигуряват алтернативни пътища за екскреция на азот 15-17 (Фигура 1). При кучета бензоатът и фенилацетатът образуват конюгати с глицин, за да образуват съответно хипурова киселина (НА) и фенилацетилглицин (PAG). 18-20 Както HA, така и PAG се екскретират през бъбреците, като по този начин всеки отделя 1 мол азот за всеки мол SB и SPA. 21, 22
В скорошно проучване 18 ефикасността и безопасността на IV SB и SPA са оценени при здрави и CPSS кучета. Елиминационният полуживот на SB и SPA е бил съответно 2,7 и 2,4 часа. 18 Тези стойности са подобни на тези, съобщени при хора. Доказано е, че двете лечения имат само леки неблагоприятни ефекти. Въпреки това, лечението е било толкова ефективно, колкото плацебо лечението (т.е. 0,9% NaCl) при намаляване на амониевите концентрации, когато се използва като IV болус при лечение на хиперамонемия.
Възможно е да е необходимо продължително лечение, за да се покаже ефикасността при понижаване на концентрациите на амоняк. За лечение с РО (т.е. лечение на хронична хиперамонемия) е използван пролекарственият натриев фенилбутират (SPB). 23 Натриевият фенилбутират бързо се окислява до фенилацетат (Фигура 1) и има предимството, че му липсва неприятната миризма на SPA, като същевременно запазва ефикасността му за отстраняване на азота. 24 Целта ни беше да оценим ефикасността и безопасността на монотерапията със SB и SPB при лечение на хиперамонемия и клинични признаци при CPSS кучета.
2 ЖИВОТНИ И МЕТОДИ
2.1 Животни
Проучваната популация се състоеше от кучета, насочени към Катедрата по клинични науки за домашни животни от университета в Утрехт, в която беше поставена окончателна диагноза CPSS. Критериите за включване бяха потвърдена диагноза на CPSS въз основа на повишени концентрации на амоняк в кръвта (референтен интервал, 15-45 μmol/L) и концентрации на жлъчни киселини (референтен интервал, 0-10 μmol/L) и визуализация на шунта чрез ултрасонография, контраст компютърна томография или и двете. Кучетата бяха изключени от проучването, когато не можеше да се направи окончателна диагноза на CPSS, когато концентрацията на амоняк в кръвта беше
2.2 Дизайн на проучването
2.3 Приготвяне на лекарството
Плацебо и SB 500 mg са произведени от аптеката на Факултета по ветеринарна медицина, Университет Утрехт, Холандия под №. 0 капсули, съдържащи само микрокристална целулоза (Bufa, Харлем, Холандия) като плацебо или съдържащи SB (Bufa) и микрокристална целулоза. Капсулите SPB 500 mg (GMP аптека Mierlo-Hout, Helmond, Холандия) бяха с еднакъв размер, но бели, съдържащи също трицилциев фосфат, магнезиев стеарат и силициев диоксид като помощни вещества. Въпреки че тези капсули имаха малко по-различен външен вид, собствениците и изследователите не знаеха кое вещество съдържат капсулите. Всички лечения се отпускат седмично като подходящо лекарство в индивидуалната доза от аптеката, обозначено с пробни лекарства и инструкции за дозиране, име на пациент и номер на субекта. Отпускането на лекарствата е проверено в аптеката и върнатите бутилки са събрани от изследователите и проверени за неизползвани капсули.
2.4 Вземане на кръв и анализ
Проби от венозна кръв за определяне на концентрациите на амоняк и жлъчни киселини са събрани преди започване на лечението (т.е. концентрации преди третиране) и в края на 5-дневния период на лечение за всяко приложено вещество (т.е. концентрации след третиране). Кръв се взема от вратната вена 2 и 4 часа след хранене. За измерване на амоняк кръв веднага се поставя в охладени с лед епруветки с натриев етилендиаминтетраоцетна киселина (NaEDTA). Измерванията на амоняк бяха извършени в рамките на 10 минути след вземане на кръв от микродифузионен метод с използване на PocketChem (Menarini Benelux BV, Valkenswaard, Холандия). Концентрациите на жлъчните киселини бяха определени, за да се оцени чернодробната функция по време на лечението и да се изключи, че потенциалното намаляване на концентрациите на амоняк в кръвта е следствие от подобрена чернодробна функция. За измерване на жлъчните киселини кръвта се поставя в епруветки с 1,3 ml хепарин. Жлъчните киселини бяха определени с помощта на анализ UniCel DxC 600 (Beckman Coulter Nederland BV, Woerden, Холандия).
2.5 Система за точкуване
Ефикасността на леченията също е оценена чрез подобряване на клиничните признаци. За целта беше разработен стандартен въпросник, който беше разпространен до собствениците, за да се оценят клиничните признаци преди и след всяко лечение. Въпросите бяха предназначени за оценка на неврологичните признаци (напр. Намалено ниво на съзнание, слабост, намалена издръжливост, намалено игрово поведение, намалено взаимодействие с други кучета, конвулсии, атаксия, дезориентация, натискане на главата, кръжене, очевидна слепота, агресия), стомашно-чревни признаци напр. анорексия, повръщане, диария) и урологични признаци (напр. полиурия, полидипсия, дизурия, хематурия). За оценка на всеки клиничен признак е използвана скала от 0 до 4. Резултат 0 означаваше, че знак през този период изобщо не се вижда. Резултат 1 беше даден, когато знак беше видян веднъж, резултат 2, когато знак беше видян> 2 пъти, но не всеки ден, резултат 3, когато знак беше видян всеки ден, и резултат 4, когато знак беше присъства> 1 път дневно. Полиурията и полидипсията са оценени съответно с 0, 2 или 4, което означава нормално, малко повече от нормалното и много повече от нормалното. Издръжливостта и готовността за игра и взаимодействие с други кучета са оценени 0, 2 или 4, като 0 означава нормално, 2 означава по-малко и 4 означава почти отсъства.
2.6 Статистически анализ
След тестване на данните за кръвната химия за нормалност с помощта на Z-теста на Колмогоров-Смирнов, бяха използвани параметрични тестове за оценка на разликите между групите. В началото беше използван тест на Kruskal-Wallis за оценка на разликите между лечебните групи. Използван е еднопосочен дисперсионен анализ (ANOVA) за повтарящи се мерки, за да се тества за наличието на ефекти на пренасяне и за разлики между леченията. Post hoc, двойно сравнение на разликата беше извършено с помощта на теста на Tukey. Тестът на Wilcoxon с ранг за повторни измервания е използван за тестване за различия в системите за оценяване. P-стойности
3 РЕЗУЛТАТА
Десет кучета (5 мъжки и 5 женски) бяха включени в проучването, на възраст от 3 месеца до 10 години и с тегло 1,5‐36 kg. Десетте кучета включват 1 ретривър за патица от Нова Скотия, 1 доберман, 2 чихуахуа, 1 кеерн териер, 1 миниатюрен шнауцер, 1 веймаранер, 1 бернско планинско куче, 1 йоркширски териер и 1 средно голямо кръстосано куче. Девет кучета завършиха всички лечения. Едно куче разви парапареза поради дискоспондилит и не участва в рамото на SB. Нежеланите ефекти, които бяха забелязани, бяха анорексия (4 кучета на плацебо и 2 кучета на лечение с SB), повръщане (2 кучета на плацебо, 3 кучета на SPB и 2 кучета на SB лечение) и летаргия (3 кучета на плацебо, 1 на SPB и 3 за SB лечение). Неблагоприятни ефекти се забелязват по време на лечението както с плацебо, така и със SB и SPB. Всички неблагоприятни ефекти са временни и отзвучават без лечение.
С еднопосочен ANOVA за многократни измервания първо беше определено дали има ефект на пренасяне. Тестът установи, че последователността на леченията няма ефект върху резултата от записаните променливи. Не са установени значими разлики между концентрациите на жлъчната киселина в плазмата и концентрациите на амоняк в кръвта на 2 и 4 часа след хранене. Следователно, средната стойност за двете точки от времето (2 и 4 часа след хранене) е използвана за оценка на ефекта от лечението върху плазмените концентрации на амоняк и жлъчни киселини (подкрепяща информация в таблица 1 и фигура 1). Концентрациите на амоняк в кръвта варират между 60 и 286 μmol/L. Не са установени значителни разлики в концентрациите на амоняк в кръвта между лекуваните групи в началото на лечението. Не са установени значителни разлики в концентрациите на амоняк в кръвта преди и след лечение с плацебо, SPB или SB лечение. Концентрациите на амоняк преди и след плацебо лечение са съответно 164 ± 86 μmol/L и 149 ± 78 μmol/L (P = .10). Концентрациите на амоняк преди и след лечението със SB лечение са били 172 ± 58 μmol/L и 187 ± 66 μmol/L (P = .21) и при третиране със SPB са 154 ± 74,0 μmol/L и 155 ± 90 μmol/L (P = .64), съответно.
Концентрациите на жлъчните киселини в плазмата варират между 39 и 630 μmol/L. Не са установени значителни разлики в плазмените концентрации на жлъчна киселина между лекуваните групи в началото на лечението. Не са установени значителни разлики в плазмените концентрации на жлъчна киселина преди или след някое от леченията. Концентрациите на жлъчна киселина преди и след лечението с плацебо са съответно 303 ± 152 μmol/L и 264 ± 118 μmol/L (P = .08). Концентрациите на жлъчна киселина преди и след лечението със SB са били 344 ± 99 μmol/L и 241 ± 85 μmol/L (P = .37) и при третиране със SPB са 293 ± 106 μmol/L и 229 ± 86 μmol/L (P = .18), съответно. Клиничните признаци, налични при кучета преди лечението, са полиурия, полидипсия или и двете (n = 5), периодично анормално поведение (n = 5), летаргия (n = 6), намалена издръжливост (n = 8), анорексия (n = 6), повръщане (n = 6) и атаксия (n = 3). Не са открити значителни разлики в резултатите от клиничните признаци преди и след лечението със SB, SPB и плацебо.
4. ДИСКУСИЯ
В плацебо-контролирано, рандомизирано кръстосано проучване, оценяващо ефикасността на IV SB за лечение на остра хиперамонемия при кучета с CPSS, 18 концентрации на амоняк в кръвта са значително намалени (приблизително 60%) след лечение със SB. Същият ефект обаче е постигнат след лечение на кучета със същия обем IV 0,9% NaCl (т.е. плацебо лечение) и не са установени значителни разлики в концентрациите на амоняк между SB и NaCl лечения. В същото проучване прилагането на NaCl на здрави кучета води до значително по-ниски концентрации на амоняк в сравнение със SB и SPA леченията. Разширяването на обема, вместо отделянето на азот по алтернативни пътища, беше предложено като възможен механизъм за намаляване на концентрациите на амоняк след SB и SPA болус лечение. Фактът, че концентрациите на амоняк не са били засегнати след лечение с PO с SB, SPB и плацебо в нашето проучване засилва това предположение, тъй като при лечение с PO не се наблюдава разширяване на обема.
Доказано е, че и двете SB и SPB лечения са безопасни и се понасят добре при всички кучета. Наблюдаваните нежелани ефекти (т.е. анорексия, повръщане и летаргия) са леки, с кратка продължителност и сравними с тези, съобщени в предишни проучвания при кучета 18 и хора 23, 30, 31 и при плацебо лечение. Въпреки това, повръщане, анорексия и летаргия също са се появили преди лечението в резултат на CPSS и може да се разглежда като последица от неуспешното лечение на CPSS.
В заключение SB и SPB не променят концентрациите на амоняк в тази кохорта кучета с CPSS или подобряват клиничните признаци. Следователно, ние не препоръчваме използването на тези вещества, нито като монотерапия, нито като част от комбинирана терапия, за лечение на хиперамонемия при кучета с CPSS.
ДЕКЛАРАЦИЯ ЗА КОНФЛИКТ НА ИНТЕРЕСИ
Авторите не декларират конфликт на интереси.
АНТИМИКРОБНА ДЕКЛАРАЦИЯ ОТ ЕТИКЕТ
Авторите декларират, че не са използвали антимикробни средства извън етикета.
- Сравнителна фармакокинетика на вориконазол, прилаган перорално като смачкани или цели таблетки
- Храни с най-високо съдържание на диетични фибри и най-ниско съдържание на натрий в зърнени закуски
- Ушни инфекции и външен отит при кучета - Собственици на кучета - Ветеринарно ръководство на Merck
- Ушни инфекции при кучета (Otitis Externa) VCA болница за животни
- Лесни здравословни рецепти с ниско съдържание на натрий от Dr.