Джиюн Ан
1 Група за изследване на метаболизма и храненето, Корейски институт за изследване на храните, 516 Baekhyun, Bundang, Seongnam, Gyeonggi 463-746, Република Корея
Min Young Um
1 Група за изследване на метаболизма и храненето, Корейски институт за изследване на храните, 516 Baekhyun, Bundang, Seongnam, Gyeonggi 463-746, Република Корея
Хюнджунг Лий
1 Група за изследване на метаболизма и храненето, Корейски институт за изследване на храните, 516 Baekhyun, Bundang, Seongnam, Gyeonggi 463-746, Република Корея
Чанг Хва Юнг
1 Група за изследване на метаболизма и храненето, Корейски институт за изследване на храните, 516 Baekhyun, Bundang, Seongnam, Gyeonggi 463-746, Република Корея
Seok Hyun Heo
2 Изследователски отдел, Корейски институт за хранителни добавки, Seongnam 463-400, Република Корея
Tae Youl Ha
1 Група за изследване на метаболизма и храненето, Корейски институт за изследване на храните, 516 Baekhyun, Bundang, Seongnam, Gyeonggi 463-746, Република Корея
Резюме
1. Въведение
Диабетът е метаболитно разстройство, характеризиращо се с хипергликемия и причинено от повишено производство на чернодробна глюкоза, необичайно използване на глюкоза в периферните тъкани и неадекватна секреция на инсулин [1]. Инсулинорезистентният захарен диабет тип 2 (T2DM) представлява 90–95% от всички случаи на диабет. Това хетерогенно разстройство засяга приблизително 6% от възрастното население в западните общества [2]. Препоръчват се няколко подхода за намаляване на хипергликемията, включително увеличаване на отделянето на инсулин от панкреаса чрез сулфонилурейни продукти, намаляване на производството на чернодробна глюкоза чрез метформин, усилване на действието на инсулина от тиазолидиндионите и потискане на абсорбцията на глюкоза в червата от α-глюкозидаза. Тези лечения обаче имат ограничена ефикасност, голяма вероятност от проблеми с поносимостта и значителни странични ефекти, основани на механизма [1].
Eleutherococcus senticosus (Rupr. & Maxim.) Се нарича още Harms (ES), Acanthopanax senticosus, сибирски женшен или Gasiogapi в Корея. Това е добре позната тонизираща и успокоителна китайска билка, която засяга различни заболявания със своите антибактериални, антиуморителни [3], антиоксидантни [4] и имуномодулиращи [5] дейности. Съобщава се и за хипогликемичната активност на ES метанолов екстракт [6]. Кой функционален компонент обаче медиира антидиабетния ефект на ES остава неизвестен.
Съобщава се, че ES има няколко активни съставки, включително лигнани (сезамин, елеутерозид Е), гликани (елеутерани, елеутерозид D), тритерпенови сапонини (елеутерозид I, K, L и M), стероидни гликозиди (елеутерозид А), хидроксикумарини (изофлаксидин), производни на фенилакрилова киселина (сирингин) и флавони [7].
Известно е, че елеутерозид Е (ЕЕ) намалява физическата умора и подобрява издръжливостта [3]. В допълнение, той също така съобщава, че има противовъзпалителни ефекти чрез инхибиране на NF-κB [8] и защита срещу инфаркт на миокарда [9]. Към днешна дата обаче ефектите на ЕЕ върху усвояването на глюкозата и инсулиновата резистентност все още не са проучени.
В настоящото проучване измерихме ефекта на ЕЕ върху усвояването на глюкоза в миотръбите и инсулинорезистентните адипоцити. Също така изследвахме хипогликемичния ефект на ES и EE при T2DM db/db мишки. Сигнализиращият път на инсулина в скелетните мускули и експресията на иРНК на гени, свързани с чернодробния метаболизъм, бяха оценени, за да се определят молекулните механизми на ES и EE-индуцирана активност.
2. Материали и методи
2.1. Приготвяне на растителни екстракти и HPLC анализи
2.2. Анализи за усвояване на глюкозата
C2C12 (ATCC, Manassas, VA, USA) клетки се поддържат в DMEM, допълнена с 10% FBS, 30 μg/ml пеницилин и 100 μg/ml стрептомицин. Диференциацията на миобластите на C2C12 се индуцира чрез превключване на сливащи се клетки към DMEM, допълнен с 2% конски серум и позволяващ образуване на миотръби с ежедневни промени в средата. Клетките бяха използвани в експерименти 4 дни след диференциацията. Клетките C2C12 бяха изложени на 10 μM сирингин, ЕЕ или изофлаксидин в продължение на 24 часа.
3T3-L1 фибробластите (ATCC) се поддържат и диференцират, както е описано по-горе [10]. За да се индуцира инсулинова резистентност, диференцирани 3T3-L1 адипоцити се третират с 20 ng/ml рекомбинантен миши TNF-a (Sigma Aldrich) в продължение на 6 часа. Резистентните към инсулин 3T3-L1 адипоцити се третират с 10 μM EE в продължение на 24 часа.
Аналог на флуоресцентна глюкоза, 2- [N- (7-нитробенц-2-окса-1,3-диазол-4-ил) амино] -2-дезоксиглюкоза (2-NBDG, Invitrogen, Карлсбад, Калифорния, САЩ), беше използва се за измерване на усвояването на глюкоза. След излагане на съединенията, описани по-горе, 500 μM 2-NBDG се добавят към културалната среда за 10 минути инкубация. Клетките се промиват с буфер на Krebs и се инкубират със 100 nM инсулин в продължение на 10 минути. За да се спре реакцията, клетките се измиват с ледено студен буфер на Krebs и се измерва интензивността на флуоресценцията на 2-NBDG при дължина на вълната на възбуждане 480 nm и дължина на вълната на излъчване 540 nm.
2.3. Животни, тестове за интраперитонеална глюкозна толерантност (IPGTT) и инсулинови толерантни тестове (IPITTs)
Пет седмични мъжки db/db мишки са получени от SLC (Hamamatsu, Япония). Db/db мишката има мутация на лептинов рецептор и е модел на метаболитен синдром с T2DM [11]. След аклиматизация в продължение на 1 седмица, мишките се поддържат в продължение на 5 седмици на диета на база AIN-76 (DM) или диета, съдържаща 0,05% или 0,1% ES екстракт (ESL, ESH, респ.), Или 0,003% EE. Телесното тегло и кръвната захар на гладно в продължение на 4 часа на всяка мишка се проследяват ежеседмично.
Пет седмици след хранене са проведени интраперитонеални тестове за толерантност към глюкоза (IPGTTs) и инсулинови толерантности (IPITTs). IPGTT се определя в отговор на интраперитонеално приложение на 2 g D-глюкоза/kg телесно тегло след 4-часово гладуване. Кръвната глюкоза се измерва от опашната вена 0, 15, 30, 60, 90 и 120 минути след прилагане на глюкоза. IPITT се определя в отговор на интраперитонеално приложение на 1,2 IU човешки инсулин/kg телесно тегло след 4-часово гладуване. Кръвната глюкоза се измерва 0, 15, 30, 60, 90 и 120 минути след приложението на инсулин. Площта под кривата (AUC) беше изчислена с помощта на трапецовиден метод. След 5 седмици на диета, мишки бяха умъртвени след 12-часов пост. Всички проучвания върху животни са проведени в съответствие с протокол, одобрен от Институционалния комитет по грижа и употреба на животните към Корейския институт за изследване на храните.
2.4. Параметри на кръвта
Нивата на кръвната глюкоза, триглицеридите (TG), свободните мастни киселини (FFA), общия холестерол (TC) и липопротеините с висока плътност (HDL) се измерват ензимно с помощта на търговски комплекти (Shinyang Chemical Co., Busan, Република Корея). Нивата на серумен инсулин се измерват с помощта на ELISA комплект (ALPCO Diagnostics, Salem, NH, USA). Оценката на модела на хомеостазата за инсулинова резистентност (HOMA-IR) беше изчислена, като се използва следната формула:
2.5. Хистологично изследване
За хистологични анализи тъканите на панкреаса бяха фиксирани в 10% буфериран формалин, вградени в парафин, разделени и оцветени с хематоксилин и еозин. Оцветените области бяха наблюдавани с помощта на светлинен микроскоп (Олимп, Токио, Япония) с увеличаваща сила × 200. За имунохистохимия панкреасните срези бяха депарафинизирани и рехидратирани и инкубирани в продължение на 25 минути в 70% метанол и водороден прекис (H2O2). След измиване с Tris-буфериран физиологичен разтвор (TBS, рН 7.3), срезовете се инкубират цяла нощ при 4 ° C с анти-инсулиново антитяло (BioGenex, Fremont, CA, USA), разредено 1: 1000 в TBS, съдържащо 10% говежди серум . Секциите бяха инкубирани в продължение на 90 минути с антитяло против морско свинче (Vectastain, Vector, Servion, Швейцария) в TBS, съдържащо 10% говежди серум (разреждане 1: 200). След измиване срезите се инкубират с авидин-пероксидазен комплекс (Vectastain) в продължение на 15 минути и се измиват отново. Срезите бяха оцветени с 3,3 диаминобензидин (DAB) за 5 минути и контра-оцветени с хематоксилин за 30 секунди.
Относителният обем на бета-клетките в панкреаса е описан като брой точки, съответстващи на оцветената от анти-инсулиновите антитела зона/брой точки, съответстващи на останалата област на панкреаса.
2.6. Инсулинова сигнализация
За експериментите за сигнализиране на инсулин, мишките се инжектират интраперитонеално с 5 U/kg човешки инсулин (Sigma Aldrich) след бързо нощуване. След 5 минути мускулните тъкани бяха отстранени и замразени в течен азот. Тъканите се лизират в RIPA буфер и се правят анализи на Western blot, както е описано по-рано [10]. Използваните първични антитела включват фосфо-AKT, фосфо-P70S6 киназа (P70S6K), бета субединица на фосфо-инсулиновия рецептор (IRβ) и β-актин (Cell Signaling, Danvers, MA, USA).
2.7. Количествена верижна реакция с обратна транскрипция-полимераза в реално време (qRT-PCR)
2.8. Статистически анализи
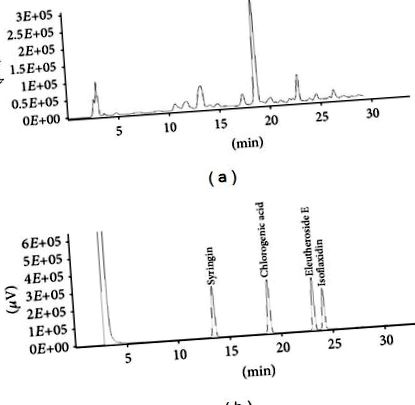
Резултатите се изразяват като средна стойност ± стандартно отклонение (SD) за изследвания на клетките и средна стойност ± стандартна грешка (SEM) за изследвания върху животни. Статистическите анализи бяха извършени с помощта на софтуера GraphPad Prism 5 (Сан Диего, Калифорния, САЩ). За сравнение на количествените данни между групите е използван еднопосочен дисперсионен анализ (ANOVA). Използва се post hoc тестът Bonferroni, ако ANOVA показва значимост (P Фигура 1. Съдържанието на всяко активно съединение е представено в Таблица 1. Екстрактът ES съдържа 16,78, 64,8 и 10,72 mg/g екстракт от сирингин, хлорогенова киселина и ЕЕ Предишни изследвания показват, че сирингин, ЕЕ, хлорогенова киселина и изофлаксидин са основните компоненти, допринасящи за фармакологичните ефекти на ES [12]. Изофлаксидин обаче не е открит в нашите ES проби.
Представителна HPLC хроматограма на екстракта от E. senticosus (ES) и неговите функционални стандартни съединения. а) HPLC хроматограма на ES екстракта. (b) HPLC хроматограма на основните съединения, включително сирингин, хлорогенова киселина, елеутерозид Е и изофлаксидин.
маса 1
Функционалните съставки в екстракти от E. senticosus.
| 16,78 ± 0,18 | 64,80 ± 0,79 | 10,72 ± 0,19 |
Данните се изразяват като средна стойност ± SD от поне три измервания.
3.2. Елеутерозид Е увеличава усвояването на глюкоза, предизвикана от инсулин
Първо изследвахме ефектите на функционалните компоненти на ES върху усвояването на глюкозата в мускулните миотръби. Както е показано на Фигура 2 (а), сирингинът е увеличил поглъщането на базалната глюкоза в миотръбите C2C12. ЕЕ значително усилва поглъщането на глюкоза, стимулирано от инсулин.
3.3. Диета, съдържаща елеутерозид Е, подобрява диабета при db/db мишки
За да потвърдим ефекта на ЕЕ върху хипергликемия и непоносимост към глюкоза, допълнихме db/db мишки с експериментална диета, съдържаща ESL, ESH или EE в продължение на 5 седмици. Промените в телесното тегло на животните по време на експерименталния период са показани на фигура 3 (а). Налице е прогресивно нарастване на телесното тегло в продължение на 5 седмици, а крайното телесно тегло на животните в експерименталните групи (ESL, ESH и EE) е значително по-високо от контролните животни.
Таблица 2
Ефектът на ES и EE върху липидния профил на db/db мишки.
| Общ холестерол (mg/dL) | 375,11 ± 74,79 | 238,19 ± 86,42 * | 247,29 ± 45,91 * | 330,59 ± 21,17 |
| Триглицерид (mg/dL) | 180,24 ± 57,19 | 137,89 ± 35,77 | 113,93 ± 20,17 * | 112,35 ± 29,75 * |
| FFA (uEq/L) | 1412,78 ± 74,28 | 1080,16 ± 160,21 * | 1190,08 ± 102,30 | 1072,38 ± 269,91 * |
| Глюкоза (mg/dL) | 486 ± 21,53 | 397,8 ± 29,30 * | 389,2 ± 21,24 * | 315,0 ± 24,67 * |
| Инсулин (ng/ml) | 8 ± 1,8 | 2,81 ± 0,71 * | 4,28 ± 1,29 * | 3,56 ± 0,41 * |
| HOMA-IR | 75,89 ± 13,64 | 36,49 ± 12,22 * | 42,79 ± 15,95 * | 33,5 ± 6,63 * |
Всички стойности са изразени като средната стойност ± SEM. Шестседмични db/db мишки бяха хранени с експериментална диета, която не съдържаше, 0,05-0,01% екстракт от E. senticosus (ES) и 0,1% елеутерозид Е (EE) в продължение на 5 седмици.
DM: група захарен диабет; ESL: 0,05% ES екстракт, допълнена група; ESH: 0,1% ES екстракт, допълнена група; EE: 0,003% група, допълнена с елеутерозид Е.
* P Фигура 3 (в), както ES, така и EE подобряват нарушен глюкозен толеранс, въпреки че лечението с ES не достига статистическа значимост. Площта под кривата (AUC) намалява съответно с 17,7%, 22,6% и 43,9% в групите ESL, ESH и EE в сравнение с контролната група за диабет.
За IPITT (Фигура 3 (d)) лечението с ES и EE умерено подобрява нарушеното инсулиново действие в сравнение с контролната група за диабет. AUC на IPITT е значително намалена при лекувани с ЕЕ мишки в сравнение с контролните мишки с диабет. Като цяло тези резултати показват, че ES и EE имат хипогликемични ефекти и подобряват глюкозния толеранс.
Ние предположихме, че подобряването на глюкозния толеранс от ES и EE е резултат от защита на функцията на β-клетките. За да тестваме тази хипотеза, ние изследвахме ефекта на ES и EE върху функцията на панкреатичните α- и β-клетки (Фигура 4 (а)). Съдържанието на инсулин в β-клетките беше определено с помощта на имунохимия и установихме, че ESL и EE ефективно предотвратяват диабетната загуба на β-клетки (Фигура 4 (b)). Освен това ESL и EE подобряват увреждането на α-клетките, потвърдено от имунохистологично оцветяване с глюкагон (Фигура 4 (а)). Тези резултати предполагат, че добавянето на ES и EE ефективно предотвратява диабетично увреждане на панкреатичните α- и β-клетки.
Ефектът на ESL (a) и EE (b) върху инсулиновата сигнализация в скелетните мускули. Анализи на индуцирано от инсулин фосфорилиране на IRβ, AKT и P70S6K се извършват чрез Western blot. След гладуване през нощта, мишките или се умъртвяват, или се инжектират с 5 U/kg инсулин. Пет минути след инжектирането се събират мускулни тъкани и се анализират общите протеини. Посочено е мястото на фосфорилиране във всеки протеин.
Накрая изследвахме ефекта на ES и EE върху метаболизма на чернодробната глюкоза чрез измерване на експресията на гени, участващи в гликолизата и глюконеогенезата. Както е показано на Фигура 6 (а), добавките на ESL и EE значително повишават експресията на иРНК на глюкокиназа и 6-фосфофруктокиназа. За разлика от това ESL и EE значително намаляват експресията на иРНК на G6Pase и PEPCK (Фигура 6 (b)). Тези данни показват, че ES и EE подобряват метаболизма на глюкозата чрез регулиране на гликолизата и понижаване на регулирането на глюконеогенезата при мишки с диабет.
Ефектът на ESL и EE върху метаболизма на чернодробната глюкоза. (а) е показана експресия на иРНК на свързаните с гликолизата гени, глюкокиназа и 6-фосфофруктокиназа. (b) е показана експресия на иРНК на свързани с глюконеогенезата гени, G6Pase и PEPCK. След нормализиране на всеки ген към гена 18S, нивата на иРНК се изразяват като процент на мишки с диабет. Стойностите показват средната стойност ± SEM. * P Moller DE. Нови лекарствени цели за диабет тип 2 и метаболитен синдром. Природата. 2001; 414 (6865): 821–827. [PubMed] [Google Scholar]
- Централна роля на мастния черен дроб в патогенезата на инсулиновата резистентност при затлъстяващи юноши
- Контрапунктното висцерално затлъстяване не е причинно свързано с инсулиновата резистентност към диабет
- Обогатената с гама-аминомаслена киселина диета с оризови трици отслабва инсулиновата резистентност и балансира енергията
- Дефектната чернодробна автофагия при затлъстяване насърчава стреса на ER и причинява инсулинова резистентност -
- Ефекти на високо протеиновата диета върху гликемичния контрол, инсулиновата резистентност и кръвното налягане при тип 2