Резюме
Еозинофилният езофагит (EoE) е атопично състояние на хранопровода, което все повече се признава през последното десетилетие. Диагнозата на разстройството зависи от клиничните прояви на пациента и хистологичните находки на биопсии на лигавицата на хранопровода. Пациентите с еозинофилен езофагит трябва да бъдат насочени както към алерголог, така и към гастроентеролог за оптимално управление, което може да включва диетични модификации, фармакологични агенти като кортикостероиди, левкотриенови модификатори и биологични препарати, както и механична дилатация на хранопровода. В този преглед са обсъдени епидемиологията, патофизиологията, диагностиката, лечението и прогнозата на EoE.
Въведение
Еозинофилният езофагит (EoE) е атопично възпалително заболяване на хранопровода, което все повече се признава при деца и възрастни през последното десетилетие. Понякога разстройството се нарича „астма на хранопровода“, тъй като има много клинични и патофизиологични характеристики с астма [1].
Еозинофилите обикновено присъстват в стомашно-чревния тракт, тъй като той е постоянно изложен на храни, алергени от околната среда, токсини и патогени. Интересното е, че при здрави индивиди хранопровода е уникален с това, че еозинофилите обикновено липсват. В EoE обаче еозинофилите инфилтрират хранопровода, допринасяйки за увреждане на тъканите и хронично възпаление. EoE се дефинира като клиникопатологично разстройство, характеризиращо се с> 15 еозинофили на поле с висока мощност [HPF] в един или повече образци на биопсия на хранопровода и отсъствието на патологична стомашно-чревна рефлуксна болест (ГЕРБ) (както се доказва от проучване за нормално рН наблюдение или липса на отговор до адекватна терапия за подтискане на киселини) [2].
Нарастващият брой признати случаи на EoE доведе до драстично разширяване на медицинската литература около болестта. Тази статия предоставя практически преглед на най-новата литература около епидемиологията, патофизиологията, диагностиката, лечението и прогнозата на EoE.
Епидемиология
Предвид слабата осведоменост и признаване на болестта в миналото, епидемиологията на EoE все още е неясна. При деца/юноши до 19-годишна възраст настоящите оценки на разпространението варират от 1 до 4 на 10 000 души [3]. Съвременната литература предполага, че разпространението на EoE се увеличава [4]. Съществуват обаче спорове дали новите случаи на диагностициране на EoE представляват истинско нарастване на разпространението или по-скоро повишено разпознаване на латентно заболяване. Освен това понастоящем се изискват ендоскопски биопсии на хранопровода, за да се установи диагнозата EoE и следователно вариациите в практиките на ендоскопия могат да отклонят резултатите от епидемиологичните проучвания. Например, някои проучвания показват, че когато се коригира броят на ендоскопиите/биопсиите, които се извършват, възприетото увеличение на разпространението на EoE може да не е толкова драматично, както първоначално се предполага [5].
Доказателствата също така показват, че има разпространение както на етническа, така и на полова принадлежност на EoE, като по-голямата част от случаите се съобщават при кавказки мъже. Това откритие обаче също е несигурно, тъй като това е популацията от пациенти, която е била проучена най-подробно [6, 7]. Необходими са допълнителни популационни епидемиологични проучвания, за да се изследва истинското разпространение на EoE, особено сред възрастното население.
Патофизиология
Въпреки че патогенезата на EoE остава неясна, доказателствата сочат, че заболяването е свързано с имунни отговори от тип Т-помощни клетки (Th) -2, които са типични за други атопични състояния. По-специално, в хранопровода на пациенти с EoE са открити повишени нива на Th2 цитокини интерлевкин (IL) -4, IL-5 и IL-13, както и мастоцити [8–10]. Изглежда, че тези цитокини играят важна роля в активирането и набирането на еозинофили в хранопровода. Освен това има доказателства, предполагащи генетично предразположение към заболяването, тъй като е установено, че генът за еотаксин-3 - хемокин, участващ в насърчаването на натрупването и адхезията на еозинофили - е свръхекспресиран при пациенти с EoE [9].
Смята се също, че EoE е смесен имуноглобулинов (Ig) Е- и не-IgE-медииран алергичен отговор към хранителни и екологични алергени [11, 12]. IgE-медиираните реакции са незабавни реакции на свръхчувствителност, които обикновено се появяват в рамките на минути след излагане на алерген. Не-IgE медиираните алергични разстройства се характеризират със забавено начало (часове или дни след излагане на антигена) и потенциално по-хронични симптоми. Установено е, че по-голямата част от пациентите с EoE имат положителни кожни тестове за убождане (които откриват IgE-медиирани реакции) и тестове за атопични пластири (които могат да идентифицират не-IgE-медиирани реакции) към храни и/или аероалергени. Въпреки това дали сенсибилизацията (положително тестване) към тези алергени установява причинно-следствена роля в EoE, остава неясно.
Диагностика и изследвания
Тъй като физическият преглед на пациенти с EoE често е неразкриваем, диагнозата EoE зависи от клиничните прояви на пациента, ендоскопската оценка на хранопровода и хистологичните находки върху биопсии на лигавицата на хранопровода.
Клинични проявления
Въпреки че типичното начало на EoE е в детска възраст, заболяването може да се открие във всички възрастови групи и симптомите са склонни да варират в зависимост от възрастта на представяне [13]. Клиничните прояви при кърмачета и малки деца обикновено включват повръщане, отказ от храна, задушаване по време на хранене и по-рядко неуспех да процъфтяват. Преобладаващите симптоми при деца и юноши в училищна възраст включват дисфагия (затруднено преглъщане), въздействие върху храната и задушаване/запушване по време на хранене, особено когато се състоят от храни с груби текстури. Други симптоми при тази популация пациенти включват болки в корема/гърдите, повръщане и регургитация. Внимателната история при деца и юноши с EoE разкрива, че те са се научили да компенсират тези симптоми, като ядат бавно, дъвчат прекомерно или приемат малки хапки, пият прекалено по време на хранене, смазват ястия необичайно със сосове и избягват специфични хранителни консистенции като месо ( или други храни с груби текстури) [14, 15].
Преобладаващият симптом при възрастни е дисфагия; обаче могат да присъстват и неразрешими киселини и избягване на храна. Поради дългогодишното възпаление и възможните последващи белези, които са останали неразпознати, възрастните, които се представят с EoE, са склонни да имат повече въздействия върху хранопровода, както и други аномалии в хранопровода, като пръстен на Шацки (тесен пръстен от тъкан, разположен точно над кръстовището на хранопровод и стомах), езофагеални мрежи (малки тънки израстъци на тъкани, които частично блокират хранопровода) и в някои случаи ахалазия (нарушение на моториката на хранопровода, характеризиращо се с затруднено преглъщане и регургитация). Важно е обаче да се отбележи, че някои пациенти с EoE са безсимптомни и подозрението за заболяването се основава на случайни находки при ендоскопия, която се извършва за други индикации или на доказателства за въздействие върху храната при липса на други симптоми.
Въпреки че много от тези симптоми се припокриват с гастроезофагеален рефлукс, по-голямата част от пациентите с EoE проявяват лош отговор на терапия за потискане на киселината (напр. Инхибитори на протонната помпа [ИПП]) и до 75% имат лична или фамилна анамнеза за атопично заболяване (напр. астма, екзема, ринит) и алергии към околната среда и/или храни [13]. Таблица 1 предоставя кратко резюме на клиничните прояви на EoE.
Ендоскопия
За да се помогне за изключване на ГЕРБ, се препоръчва емпирично 6- до 8-седмично проучване на високодозова киселинно-супресивна терапия преди извършване на ендоскопия при пациенти със съмнение за EoE. Трябва да се обмисли и поглъщане на барий, за да се изключи тежък храносмилател с малък калибър.
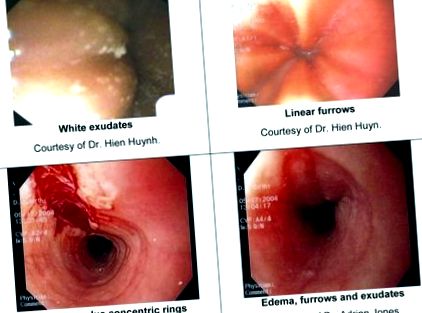
Въпреки че ендоскопското изследване може да бъде незабележимо, ендоскопските характеристики на EoE са добре характеризирани и включват: линейна бразда (хребети или бразди в стената на хранопровода), концентрични пръстени, бели петнисти ексудати (еозинофилни абсцеси), пръстен на Шацки, малокалибрена хранопровода и линейни повърхностни разкъсвания на лигавицата, които се появяват след въвеждането на ендоскопа [13]. Таблица 2 предоставя по-подробно описание на всяка от тези характеристики. Изображения на ексудати, линейни бразди и разкъсвания са представени на фигура 1.
Изображения на ендоскопски характеристики на EoE. А. Бели ексудати С любезното съдействие на д-р Hien Huynh. Б. Линейни бразди С любезното съдействие на д-р Hien Huyn. В. Линейно разкъсване плюс концентрични пръстени С любезното съдействие на д-р Адриан Джоунс. Г. Оток, бразди и ексудати С любезното съдействие на д-р Адриан Джоунс.
Въпреки че ендоскопските находки са полезни при идентифицирането на пациенти с EoE [16], те не са диагностика на заболяването. Освен това е важно да се изключи кандидоза на хранопровода, когато се идентифицират бели ексудати. Като такива, всички пациенти със съмнение за EoE трябва да се подложат на биопсии на лигавицата на хранопровода, за да потвърдят диагнозата.
Биопсии на лигавицата на хранопровода
В момента ендоскопската биопсия на лигавицата остава най-важният диагностичен тест за EoE. Биопсични проби трябва да се вземат независимо от грубия вид на лигавицата, а пробите трябва да се вземат както от проксималния и дисталния хранопровод, така и от зоните, разкриващи ендоскопски аномалии [2]. Необходими са поне четири биопсии, за да се получи висока чувствителност за откриване на EoE (обикновено се препоръчват 5-6 биопсии) [13].
Както беше обсъдено по-рано, окончателната диагноза на EoE се основава на наличието на най-малко 15 еозинофили/HPF в биопсиите на хранопровода на пациенти, които имат изследвания с нормално pH или са рефрактерни на терапия за подтискане на киселини (т.е. за да се изключи ГЕРБ). ГЕРБ може да увеличи еозинофилната инфилтрация в дисталния хранопровод, но еозинофилите, свързани с ГЕРБ, обикновено се срещат при по-ниска плътност (т.е.,
Лечение
Наличните стратегии за лечение на EoE се разделят на три категории: (1) избягване на задействания чрез диетична модификация, (2) фармакологична терапия (кортикостероиди, левкотриенови модификатори и биологични препарати) и (3) механична дилатация на хранопровода. Важно е обаче да се отбележи, че повечето от публикуваните проучвания, изследващи тези терапии, са поредици от случаи и има ограничени тестове на тези режими в рандомизирани контролирани проучвания.
Диетично управление
През последното десетилетие се появиха три диетични подхода за управление на EoE: (1) елементарната диета, (2) емпирични диетични ограничения (наричани още емпирична диета за елиминиране на шест храни) и (3) целенасочени диетични ограничения. Елементарната диета включва премахване на всички източници на потенциално алергенен протеин от диетата на пациента чрез използването на формула на основата на аминокиселина за хранителна подкрепа. Ако приемем, че има благоприятен клиничен и хистологичен отговор, една нова храна на седмица се въвежда последователно, започвайки с най-малко алергенни храни (плодове и зеленчуци) до най-силно алергизиращите (например млечни продукти, соя, яйца, пшеница и фъстъци). Повторна ендоскопска оценка се извършва след повторното въвеждане на всеки 3-5 храни, за да се гарантира, че възпалението не се е повторило.
Въпреки че елементарната диета е свързана с високи нива на клинично и хистологично подобрение както при възрастни, така и при деца с EoE (т.е. 90%), симптомите често се повтарят след нормализиране на диетата на пациента [12, 18]. Освен това, предвид неприятния вкус на формулата, повечето пациенти се нуждаят от хранене чрез назогастрална сонда, което може да доведе до проблеми с придържането и влошено качество на живот, особено при юноши и възрастни.
Често се използват целенасочени и емпирични диетични ограничения, преди да се обмисли елементарна диета. Целевите диетични ограничения включват елиминиране на храни въз основа на резултатите от тестването на кожни убождания и атопия. Въпреки че процентите на отговор, отбелязани при този подход, са по-ниски от тези, отбелязани при елементарната диета, все още е доказано, че целенасочените диетични ограничения са ефективни при приблизително 70-80% от пациентите и могат да доведат до по-добро придържане на пациентите [12]. Въпреки това, клинично-ирелевантни положителни резултати и фалшиво отрицателни резултати усложняват този диетичен подход и следователно са необходими допълнителни проучвания, изследващи както положителната, така и отрицателната прогностична стойност на целевите диетични ограничения в EoE.
Вместо да се основават на елиминирането на диетата на тестване на кожни убождания и тестване на пластир с атопия, емпиричните диетични ограничения включват премахването на шестте най-често срещани алергични храни (независимо от резултатите от теста за алергия): млечни продукти, яйца, пшеница, соя, фъстъци и риба/черупчести. Подобно на целенасочените диетични ограничения, емпиричната диета за елиминиране на храната е показала, че е ефективна при приблизително 75% от пациентите с EoE и може също да бъде свързана с по-добро придържане на пациентите от елементарната диета [19].
При всички диетични подходи остава неясно колко дълго трябва да се избягват специфични храни и дали диетата на пациента може да се нормализира с течение на времето. Ясно е, че са необходими повече проучвания по този подход, включително опит за оценка на качеството на живот на пациента, като се имат предвид обширните диетични ограничения, които често се изискват, включително много "основни" храни. Освен това, ако няколко храни трябва да бъдат елиминирани едновременно, привличането на помощта на диетолог може да бъде от полза, особено при педиатричната популация. Това може да помогне да се гарантира, че хранителните изисквания продължават да бъдат изпълнявани, за да се улесни адекватният растеж и развитие.
Фармакологично управление
Медицинските терапии за EoE включват кортикостероиди, левкотриенови модификатори и биологични агенти. Системните (орални) кортикостероиди са една от първите възможности за лечение, доказано ефективна при пациенти с EoE. Както клиничното, така и хистологичното подобрение са наблюдавани при приблизително 95% от пациентите с EoE, използващи системни кортикостероиди; въпреки това, при прекратяване на терапията, 90% от пациентите изпитват рецидив на симптомите [20]. Освен това, като се има предвид, че продължителната употреба на системни кортикостероиди е свързана с добре известни и потенциално сериозни неблагоприятни ефекти, тяхната продължителна употреба не се препоръчва. Системните кортикостероиди трябва да бъдат запазени за спешни случаи, като пациенти с дисфагия, изискващи хоспитализация, или пациенти със значителна загуба на тегло или дехидратация поради затруднено преглъщане [2].
Като се има предвид техния значително по-добър профил на безопасност, локалните кортикостероиди, доставени в хранопровода, се превърнаха в основата на фармакотерапията за пациенти с EoE. Доказано е, че както погълнатият флутиказон пропионат (500-1000 µg/ден), така и пероралният вискозен (дебел) будезонид (500-1000 µg/ден) са ефективни при лечението на EoE. Флутиказон пропионат се доставя чрез инхалатор с измерена доза под налягане (pMDI), който се активира в устата (без вдишване и без дистанционно устройство) и се поглъща. Будезонид се прилага перорално, след като съдържанието на флакона, използван за пулверизиране, се смеси с изкуствен подсладител, за да се увеличи вискозитетът (дебелината) на разтвора, което теоретично забавя преминаването му през лигавицата на хранопровода [13].
Рандомизираните клинични проучвания на локална терапия с флутиказон пропионат показват както хистологични, така и симптоматични подобрения при 50-80% от пациентите с EoE [21, 22]. Най-честите усложнения, отбелязани при локален флутиказон пропионат, са повърхностна кандидоза на орофарингеята и хранопровода. Въпреки че не е толкова добре проучен, колкото локалният флутиказон пропионат, пероралният вискозен будезонид също води до подобна клинична и хистологична степен на отговор при педиатрични пациенти с EoE [23, 24]. Пероралният будезонид е свързан с по-нисък риск от развитие на езофагеална кандидоза и предвид вискозитета на разтвора може да осигури по-добро доставяне до езофагеалната повърхност, отколкото погълнатия флутиказон. Будезонидът обаче има малко по-висока системна бионаличност от пероралния флутиказон пропионат и следователно може да бъде свързан с по-системни ефекти.
Пациентите, използващи локални кортикостероиди за EoE, трябва да бъдат посъветвани да не ядат, пият или изплакват устата си в продължение на 20 до 30 минути след употребата на лекарството [13]. След 6-8 седмици локална терапия, пациентите трябва да се подложат на повторна ендоскопска оценка, за да се осигури хистологичен отговор на терапията. Ако се потвърди терапевтичен отговор, лечението трябва да се намали до най-ниската ефективна доза с подходящо проследяване. Важно е да се отбележи, че симптомите и патологичните промени често се повтарят след прекратяване на локалната кортикостероидна терапия. Следователно много пациенти с EoE ще се нуждаят от продължително лечение.
Тъй като възпалителните медиатори като левкотриени са теоретизирани да играят роля в възпалението на хранопровода, отбелязвано при пациенти с EoE, левкотриеновите модификатори могат да бъдат от полза за управлението на EoE [2]. Малко проучване на 8 пациенти с EoE изследва ефикасността на антагониста на левкотриеновия рецептор, монтелукаст, и установява значително подобрение на симптомите при повечето пациенти, но няма подобрение в хистологията [25]. Като се има предвид, че монтелукаст обикновено се понася добре и е потенциално полезен за лечение на други атопични заболявания като астма, може да бъде терапевтичен вариант да се обмисли при пациенти с EoE и съпътстващи атопични състояния.
Като се има предвид, че както IL-5, така и IgE играят роля в патогенезата на EoE, хуманизираните моноклонални антитела срещу IL-5 (реслизумаб, меполизумаб) и IgE (омализумаб) също могат да бъдат потенциални терапевтични възможности за заболяването. Резултатите от малки случаи, използващи антитела срещу IL-5 при пациенти с EoE, показват, че тези биологични препарати се понасят добре и могат да подобрят клиничните симптоми, хистологията и качеството на живот [26]. В момента се провеждат две големи педиатрични проучвания за по-нататъшно изследване на ефикасността и безопасността на антитела срещу IL-5 при управлението на EoE.
Анти-IgE антитялото омализумаб се използва за лечение на тежка атопична астма и алергичен ринит. Тъй като е доказано, че омализумаб намалява броя на еозинофилите в кръвта и белите дробове на астматици [27], това може да е потенциален терапевтичен подход за EoE. Въпреки че не са провеждани клинични проучвания на омализумаб при пациенти с EoE, анекдотични доклади сочат, че това може да е обещаваща възможност за лечение.
Ендоскопска дилатация
Езофагеалната ендоскопска дилатация е начин на лечение, най-често използван при възрастни с установени езофагеални стриктури. Въпреки че дилатацията е ефективна за облекчаване на дисфагия, тя не обръща внимание на основното възпаление и следователно по-голямата част от пациентите, подложени на тази процедура, развиват повтарящи се симптоми в рамките на 3-8 месеца [4, 28–30]. Освен това при пациенти с EoE ендоскопската дилатация се свързва с широко разкъсване и перфорация на лигавицата. Следователно дилатацията обикновено е запазена за пациенти със симптоматични стриктури, които продължават след изпитване на фармакологична или диетична терапия [2, 7, 13].
Предложен алгоритъм за диагностика и управление на EoE е показан на фигура 2.
Предложен алгоритъм за диагностика и управление на EoE. EoE: еозинофилен езофагит; PPI: инхибитор на протонната помпа; ГЕРБ: стомашно-чревна рефлуксна болест; HPF: поле с висока мощност; IgE: имуноглобулин Е; IL5: интерлевкин 5
- Прогресия на заболяването и резултати от бременността при жени с еозинофилен езофагит -
- Еозинофилен езофагит - гастроентерология на Северния Роли
- Клинично представяне и подход към диетичното управление на еозинофилен езофагит
- Елиминационната диета разрешава симптомите на еозинофилен езофагит при млади пациенти
- Езофагеални сквамозни папиломи с фокална дермална хипоплазия и еозинофилен езофагит