Отделение по анестезия,
Училище по диететика и хранене на човека, Университет Макгил, Монреал, Квебек, Канада H3A 1A1
Отделение по анестезия,
Резюме
Въпреки че осигуряването на адекватни количества глюкоза, самостоятелно или като част от общото парентерално хранене, намалява загубите на протеини чрез увеличаване на синтеза на протеин в цялото тяло, повишената скорост на протеинов катаболизъм продължава да бъде непроменена (32). Тази ограничена ефективност на хранителната подкрепа се дължи на невъзможността за глюконеогенеза чрез прилагане на глюкоза и на нарушената способност на пациентите в стрес да окисляват глюкозата, която се дава над необходимото количество за най-ефективно потискане на глюконеогенезата. Само половината от глюкозата, вливана при 4 mg · kg -1 min/-1, се окислява директно след хирургическа или случайна травма и този процент дори спада, когато глюкозата се прилага в по-високи дози (32,36).
Фактът, че дори енергичната хранителна подкрепа не успява да намали изцяло катаболизма на протеините след травма и по време на сепсис, е довел до изследване на различни фармакологични подходи. Инфузията на инсулин, основният ендокринен регулаторен фактор на организма за насърчаване на протеиновия анаболизъм, подобрява загубите на протеин при критично болни пациенти (2, 26). За да се преодолее периоперативната инсулинова резистентност обаче, инсулинът трябва да се прилага във високи дози (26). В същото време е необходимо осигуряване на прекомерни количества глюкоза за поддържане на нормогликемия. Този въпрос повдига потенциални метаболитни проблеми, тъй като високият прием на въглехидрати причинява мастна инфилтрация в черния дроб (12) и стимулира производството на въглероден диоксид (1).
Тъй като болката се счита за мощен стимул за катаболния отговор на операцията, манипулирането на стресовата реакция чрез различни аналгетични техники представлява по-директен фармакологичен подход за модифициране на белтъчния катаболизъм. Добре установено е, че блокирането на ноцицептивните и неноцицептивните пътища, като симпатиковата нервна система, чрез епидурални локални анестетици подобрява азотния баланс (34), намалява нарастването на разграждането на протеините в цялото тяло (7) и предотвратява намаляването на синтеза на мускулен протеин след операция (4). Тези резултати обаче са получени изключително при пациенти, получаващи периоперативно парентерално хранене с въздействие върху всички аспекти на икономията на протеини и глюкоза.
Целта на този проект беше да се провери хипотезата, че антикатаболните ефекти на парентералното приложение на глюкоза могат да бъдат засилени чрез епидурална блокада с локални анестетици, инициирана преди и поддържана след колоректална операция. За да се получи интегрирана представа за метаболизма на протеините и глюкозата, динамичните промени в разграждането на протеините, окисляването на аминокиселини, синтеза на протеини, производството на глюкоза и глюкозния клирънс бяха оценени чрез използване на стабилна изотопна проследяваща кинетика на гладно и хранене.
Пациенти
Изследването е одобрено от Етичния комитет на болницата и е получено информирано съгласие от всички пациенти. Шестнадесет пациенти с локализиран неметастатичен аденокарцином на ректосигмоидното дебело черво, планирани за планова колоректална хирургия, бяха допуснати до проучването (Таблица 1). Нито един от пациентите не е страдал от сърдечно, чернодробно, бъбречно или метаболитно заболяване. Никой субект не е развил скорошна загуба на тегло или е имал концентрация на плазмен албумин
Таблица 1. Биометрични и клинични данни за пациенти
Стойностите са средни стойности ± SD; n, не. на пациентите. КАТО; Американско дружество по анестезиология.
Анестезия и хирургични грижи
При пристигането си в анестетичната стая, пациентите от групата на ЕДА заеха седнало положение и беше поставен епидурален катетър на едно от гръдните гръбначни нива между Т10 и Т12. Невронната блокада се инициира с 0,5% бупивакаин, за да се постигне двустранен сензорен блок за лед и убождане от гръден дерматом ниво четвърто (T4) до сакрален дерматом ниво пет (S5). Блокът се поддържа по време на операцията с болуси от 0,25% бупивакаин. Общата анестезия и в двете групи се предизвиква с интравенозен тиопентон и се поддържа с 35% азотен оксид в кислород и изофлуран. Фентанил (3 μg/kg) се прилага в контролната група преди хирургичен разрез. Всички операции са извършени от един и същ хирург и по едно и също време на деня (от 1100 до 1400). Пациентите и в двете групи са получавали хипокалорична хранителна добавка с глюкоза от 0800 до 2000 г. на първия следоперативен ден (100 ml/h 5% глюкоза, еквивалентна на ~ 250 kcal), последвана от инфузия на 0,9% NaCl (100 ml/h) до периода на изследване.
Сензорната блокада от T8 до L3, покриваща 10- до 15-сантиметровия субмубилен разрез на парамедиана, се поддържаше следоперативно в групата на EDA чрез непрекъсната епидурална инфузия на 0,1% бупивакаин, допълнена с 2 μg/ml фентанил. В контролната група облекчаването на болката се постига чрез PCA с интравенозен морфин. Постепенната доза морфин е 1-2 mg, локаутът е 8 минути и продължителността на дозата е 30 s. Интензитетът на следоперативната болка се изчислява с помощта на 10-сантиметрова визуална аналогова скала (VAS от 0 = липса на болка до 10 = най-силната болка, която може да си представим). Лечението на болката и в двете групи се коригира, за да се получи VAS резултат в покой под четири. Пациентите от двете групи бяха помолени от сестрата в отделението да се издигнат в леглото, да седнат на леглото и да изпънат долните крайници.
Вливане на глюкоза
След 3-часов период на гладуване, разтвор на кристализирана захар от цвекло (10% безводна декстроза; Avebe, Foxhol, Holland) се влива при 4 mg · kg -1 min min -1 за 3 часа. Разтворът се приготвя от местната аптека при стерилни условия и се тества за стерилност, стабилност и отсъствие на пирогени преди интравенозна инфузия. Разтворът на цвекло декстроза е избран поради ниското му съдържание на 13 C и следователно липсата на значително смущение от 13 CO2 обогатяване във въздуха с издишване (6).
Експериментален протокол
Плазмената кинетика на левцин и глюкоза се определя чрез грундова постоянна инфузия на проследяващи количества 1 - [1- 13 С] левцин (99% 13 С) и [6,6-2 Н2] глюкоза (99% 2 Н), получени от Кембриджски изотопни лаборатории (Кеймбридж, Масачузетс). Преди всяко инфузионно проучване се приготвят стерилни разтвори на изотопи в болничната аптека и се държат при 4 ° C до приложение.
Фиг. 1.Времеви ход на инфузията на изотопи и събиране на проби от плазма и въздух с изтекъл срок на годност (○), индиректна калориметрия (отворени правоъгълници) и събиране на плазма за определяне на метаболитни субстрати и хормони (x) на гладно и по време на инфузията на глюкоза.
Газова обмяна
Индиректната калориметрия (Datex Deltatrac, Хелзинки, Финландия) беше извършена през последния час на гладно и нахранено състояние. Субектите са лежали в полулегнало положение (20 °), вдишвайки въздух в стаята във вентилираната качулка, по 20 минути за всеки случай. Измерва се консумацията на кислород (V˙o 2) и производството на въглероден диоксид (V˙ co 2) и се изчислява дихателният коефициент (RQ). Взета е средна стойност на V˙o 2, V˙ co 2 и RQ, с коефициент на вариация 13 C] обогатяване на кетоизокапроат (α-KIC), определена чрез електронно въздействие, избрана йонна газова хроматография-масспектрометрия с помощта на метод, описан по-рано от Mamer и Montgomery (21), с изключение на тозит-бяха получени бутилдиметилсилил, а не триметилсилил производни. Обогатяването с изтичане на 13 СО2 се определя чрез изотопно съотношение-масова спектрометрия (Analytical Precision AP2003, Манчестър, Великобритания; вж. Реф. 28). Плазмената глюкоза се дериватизира до нейното пента-ацетатно съединение и обогатяването на [6,6-2 Н2] глюкоза се определя чрез газова хроматография-масова спектрометрия, използвайки йонизация с електронен удар (27). Във всеки цикъл на анализ винаги се извършват дублирани инжекции и техните средства са взети, за да представят обогатяването.
Плазмени метаболити и хормони.
Глюкозата в плазмата се измерва с метод на глюкозна оксидаза, като се използва глюкозен анализатор 2 (Beckman Instruments, Fullerton, CA). Анализът на плазмения лактат се основава на лактат оксидаза и се извършва с помощта на синхронната система CX 7 (Beckman Instruments). Циркулиращите концентрации на кортизол, инсулин и глюкагон са измерени чрез чувствителни и специфични RIA на двойни антитела (Amersham International, Amersham, Bucks, UK).
Изчисления
Когато съществува физиологично и изотопно стационарно състояние, скоростта на поява (Ra) на немаркиран субстрат в плазмата може да бъде получена от обогатяването на плазмения изотоп (APE или излишък в проценти на атома), изчислено от
На гладно, глюкозата Ra е равна на ендогенното производство на глюкоза. По време на инфузията на глюкоза се изчислява ендогенното производство на глюкоза чрез изваждане на скоростта на инфузия на глюкоза от общата глюкоза Ra. Във физиологично стабилно състояние усвояването на глюкоза в цялото тяло се равнява на скоростта на ендогенно производство на глюкоза. Тъй като усвояването на глюкоза се увеличава пропорционално с повишаване на концентрацията на глюкоза в кръвта, промените в усвояването на глюкоза в цялото тяло не отразяват непременно съответните промени в способността на тъканите да поемат глюкоза. Това може да се дължи на това, че по-голямата част от усвояването на глюкоза се случва в нечувствителни към инсулин тъкани и скоростта на усвояване до голяма степен се определя от дифузионния градиент за глюкоза. По този начин скоростта на усвояване на глюкозата трябва да бъде коригирана за преобладаващата плазмена концентрация на глюкоза. Получената стойност, скоростта на глюкозния клирънс, представлява индекс на способността на тъканите да поемат глюкоза. Скоростта на плазмения клирънс на глюкозата се изчислява като глюкоза Ra, разделена на съответната плазмена концентрация на глюкоза.
Статистика
Всички данни са представени като средни стойности ± SD. Сравненията за всяка зависима променлива бяха извършени с помощта на двуфакторна ANOVA с факторите епидурална блокада и инфузия на глюкоза. ANOVA за многократни измервания се прилага за анализ на всяка значима промяна в плазмените концентрации на метаболитни субстрати (глюкоза, лактат) и хормони (кортизол, инсулин, глюкагон) по време на приложението на глюкоза. Ако не се открие значителна промяна между двете измервания, получени на гладно и след 120 и 180 минути вливане на глюкоза, двете средни стойности се сравняват. Връзката между левцин Ra и глюкоза Ra в постабсорбционното състояние и между промените в глюкозния клирънс и окислението на левцин по време на прилагане на глюкоза се оценява чрез коефициента на корелация. Статистическата значимост беше приета наP 13 C] KIC, [6,6-2 H2] глюкоза и 13 CO2 с изтекъл срок на годност се постига на гладно и на хранене (коефициент на вариация
Таблица 2. Кинетика на метаболизма на левцин и глюкоза на гладно и хранене
Стойностите са представени като средни стойности ± SD. Ra, скорост на поява. Ендогенната глюкоза Ra се изчислява чрез изваждане на скоростта на екзогенна инфузия на глюкоза от общата глюкоза Ra.
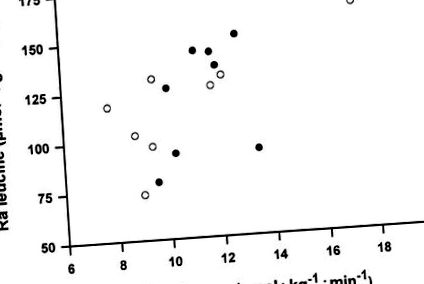
Фиг. 2.Корелация между скоростта на поява на левцин (Ra) и глюкозата Ra на гладно [левцин Ra = 4.975 + (0.051 × глюкоза Ra), r = 0,59, P
Прилагане на глюкоза, потиснало ендогенното производство на глюкоза в подобна степен и в двете групи (P
Фиг. 3.Корелация между промените в глюкозния клирънс и оксидирането на левцин по време на инфузия на глюкоза [промяна в глюкозния клирънс = 3.08 - (11.35 × промяна в окислението на левцин), r = -0,74, P
Метаболити и хормони
Епидуралната блокада не е оказала значително влияние върху циркулиращите концентрации на метаболитни субстрати и хормони на гладно (Таблица 3). Плазмените концентрации на метаболити и хормони, получени след 150 и 180 минути инфузия на глюкоза, не се различават значително. Прилагането на глюкоза повишава плазмената глюкоза и концентрацията на инсулин (P
Таблица 3. Плазмени концентрации на циркулиращи метаболити и хормони на гладно и хранене
Стойностите са представени като средни стойности ± SD.
F3-150 P o 2, V˙ co 2 и RQ не са били значително повлияни от епидурална блокада на гладно (Таблица 4). Инфузията на глюкоза повишава RQ в групата на EDA (P o 2 и V˙ co 2. V˙ o 2, V˙ co 2 и RQ не се променят значително в контролната група.
Таблица 4. Газообразен обмен при пациенти със и без епидурална блокада на гладно и хранене
Стойностите са представени като средни стойности ± SD.V˙ o 2, потребление на кислород в цялото тяло; V˙ co 2, производство на въглероден диоксид в цялото тяло; RQ, коефициент на дишане.
F4-150 P 2 H2] глюкоза не позволява диференциация между двата метаболитни пътя. Като се има предвид дългият предоперативен период на гладуване на пациентите, влизащи в този протокол от проучването, и фактът, че само малко глюкоза е била прилагана след операция, изглежда вероятно запасите от гликоген на пациента да са изчерпани. Резултатите от скорошно проучване показват, че глюконеогенезата представлява почти цялата глюкоза, произведена след 42 часа на гладно (9). По този начин скоростта на производство на глюкоза, измерена на втория ден след колоректална операция, вероятно е еквивалентна на глюконеогенезата.
Следователно може да се заключи, че подобряването на усвояването и окислителното използване на глюкозата чрез епидурална блокада води до инхибиране на ендогенното окисление на аминокиселини, което води до по-добро запазване на азота в цялото тяло.
Тъй като нашият протокол за изследване не е предназначен за дисекция на биохимичните фактори, отговорни за промените в използването на следоперативния субстрат в групата на EDA, можем само да спекулираме с основните ендокринни механизми. Често е показано, че епидуралната блокада с местни анестетици потиска кортизола и симпатоадренергичния отговор на коремна хирургия, като по този начин улеснява антикатаболното действие на инсулина (18). По този начин подобрението на инсулиновата чувствителност, наблюдавано в групата на EDA, може да е резултат от инхибиторния ефект на епидуралните местни анестетици върху периоперативното повишаване на нивата на циркулиране на кортизол, епинефрин и норепинефрин. Плазмените концентрации на катехоламин не са измерени в настоящото проучване и няма значителна разлика в плазмените концентрации на кортизол между двете групи, нито на гладно, нито в хранене. Не може да се изключи обаче, че по-честите интра- и следоперативни измервания на кортизол биха могли да разкрият такава разлика.
За да се оптимизира следоперативната аналгезия в групата на EDA, в настоящото разследване се прилага комбинирана инфузия на бупивакаин и фентанил. Ефектите на епидуралните опиоиди върху метаболитните ендокринни промени, предизвикани от хирургична травма, са по-слабо изразени в сравнение с местните анестетици въпреки еквивалентното задоволително облекчаване на болката (18). Според резултатите от няколко проучвания, епидуралните опиоиди за разлика от епидуралните местни анестетици не успяват да отслабят хипергликемичния, симпатоадренергичния и катаболния отговор на операцията (14, 18). Въпреки че потенциалното метаболитно въздействие на епидуралния фентанил не може да бъде напълно изключено в настоящото проучване, този ефект вероятно е малък.
В заключение, епидуралната блокада, установена преди и продължена след коремна операция, не влияе на катаболизма на протеините и метаболизма на глюкозата на гладно. Интравенозното приложение на глюкоза подобрява усвояването на глюкоза и щади телесните протеини, което се отразява чрез намаляване на ендогенното окисление на протеини само в присъствието на епидурална блокада.
Благодарим на д-р Пол Беливо за разрешението да изследва пациентите си. Длъжни сме и на д-р Орвал Мамер и Тина Нордолило за отлична техническа помощ.
СТЪПКИ
Това проучване е финансирано отчасти чрез безвъзмездна помощ, предоставена от Канадското общество за анестезия, Торонто, Канада. Т. Шрикър е подкрепен от Изследователски оперативен грант (Schr 623/1–1) от Deutsche Forschungsgemeinschaft, Бон, Германия.
Адрес за заявки за препечатка и друга кореспонденция: F. Carli, отдел по анестезия, болница Royal Victoria, McGill Univ., 687 Pine Ave. West, Rm. F9.16, Монреал, Квебек, Канада H3A 1A1 (Имейл на: [имейл защитен] mcgill. Ca).
- Диетичното съдържание на мазнини променя медиирания от инсулина метаболизъм на глюкозата при здрави мъже The American Journal
- Диетичната профилактика на атеросклерозата върви с пълнозърнести храни The American Journal of Clinical
- Ефекти от диета с високо съдържание на фибри върху отслабване при мъже в колеж Американският вестник на
- Подобрено възстановяване след операция в гинекологична онкология - Glaser - 2018 - International Journal of
- Енергийна плътност на храните, изграждащи случай за управление на приема на храна The American Journal of Clinical