Чиа-Чен Лий
Департамент по хранителни науки, Национален университет Chiayi, град Chiayi 60004, Тайван
Wei-Hsuan Hsu
Департамент по хранителни науки, Национален университет Chiayi, град Chiayi 60004, Тайван
Siou-Ru Shen
Департамент по хранителни науки, Национален университет Chiayi, град Chiayi 60004, Тайван
Ю-Сянг Ченг
Департамент по хранителни науки, Национален университет Chiayi, град Chiayi 60004, Тайван
She-Ching Wu
Департамент по хранителни науки, Национален университет Chiayi, град Chiayi 60004, Тайван
Резюме
Fagopyrum tataricum (елда) се използва за лечение на захарен диабет тип 2 в Тайван. Това проучване трябваше да оцени антихипергликемичните и антиинсулиновите резистентни ефекти на 75% етанолови екстракти от елда (EEB) в хепатоцити FL83B чрез индукция с високо съдържание на глюкоза (33 mM) и при мишки C57BL/6 чрез богата на фруктоза диета (FRD; 60 %) индукция. Активните съединения на EEB (100 μg/ml; 50 mg/kg т.т.), кверцетин (6 μg/ml; 3 mg/kg т.т.) и рутин (23 μg/ml; 11,5 mg/kg т.т.) също са използвани за лечение на FL83B хепатоцити и животни. Резултатите показват, че EEB, рутин и кверцетин + рутин значително подобряват усвояването на 2-NBDG чрез насърчаване на Akt фосфорилиране и предотвратяване на разграждането на PPARy, причинено от индукция с високо глюкоза за 48 h в хепатоцити FL83B. Също така открихме, че EEB може да повиши активността на чернодробните антиоксидантни ензими, за да отслаби инсулиновата резистентност, както и неговата антиоксидация, причинена от рутин и кверцетин. И накрая, EEB също инхибира повишаване на нивата на кръвната глюкоза и инсулина на мишки C57BL/6, индуцирани от FRD.
1. Въведение
Захарният диабет тип 2 (T2DM) е хронично заболяване, причинено от недостатъчна секреция на инсулин или неефективна инсулинова активност, което влияе отрицателно на въглехидратния метаболизъм. Лечебните растения се използват като често срещано алтернативно лечение на T2DM в много части на света. Инсулиновата резистентност е свързана с възпалителни фактори като фактор на туморна некроза-α (TNF-α) и интерлевкин-6 (IL-6) при пациенти с T2DM. Смята се, че клетъчният стрес поради затлъстяване е свързан с нарушаването на хомеостазата в ендоплазмения ретикулум (ER). Чернодробната регулация на глюкозната хомеостаза е основният фактор, контролиращ плазмените концентрации на глюкоза и е изследвана индукцията на чернодробен ER стрес и оксидативен стрес, водещ до инсулинова резистентност [1].
Диетата с високо съдържание на фруктоза повишава чернодробната експресия на стерол регулаторния елемент, свързващ протеин-1с (SREBP-1c), ключов транскрипционен фактор за чернодробната експресия на липогенни ензими, но надолу регулира експресията на PPARα (насърчаване на окисляването на мастните киселини) [2, 3 ]. Проучването също така изследва индуциращия фруктоза ефект при мишки C57BL/6 и е установило, че фруктозата ще стимулира промоторната активност на SREBP-1c, водеща до чернодробна липогенеза [4]. Освен това, фруктозата се използва за индуциране на инсулинова резистентност, чернодробна стеатоза и метаболитен синдром [5]. Фруктозата е силно липогенна захар, която има дълбоки метаболитни ефекти в черния дроб, водещи до метаболитен синдром, а фруктозата не стимулира секрецията на инсулин [6]. Скоростта на чернодробно усвояване на фруктоза от порталната циркулация е по-голяма от скоростта на усвояване на глюкозата и тъй като метаболизмът на фруктозата заобикаля фосфофруктокиназата, метаболизмът на фруктозата не е под регулаторния контрол на инсулина [7]. От друга страна, фруктозата може да активира SREBP-1c, който активира гените, участващи в de novo липогенезата, и триглицеридите [8].
Fagopyrum tataricum (елда) е тревисто растение, което принадлежи към семейство Polygonaceae. Сега той е въведен в много страни, защото семената на тази билка са здравословна и хранително важна храна. Установено е, че рутинът е основната съставка на елдата [9]. Тартарна елда (F. tataricum) съдържа повече рутин и кверцетин, отколкото обикновената доза елда (F. esculentum); Известно е, че рутинът има антиоксидантна активност [10]. Поради нарастването през последните години за изследване на антидиабетната активност на антиоксидантите, в това проучване бяха изследвани анти-инсулинова резистентност на рутин, кверцетин и 75% етанолови екстракти от елда (EEB) in vivo и in vitro.
2. Материали и методи
2.1. Материали и химикали
3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолиев бромид (MTT), глюкоза, кверцетин, Triton-X 100, рутин и трипсин са закупени от Sigma Co. (St. Louis, MO, САЩ). Натриев бикарбонат, фетален говежди серум (FBS), среда F12-K, пеницилин и стрептомицин са закупени от HyClone Laboratories (Logan, UT, USA). Тестовото багрило Bio-Rad е от Bio-Rad Laboratories (Херкулес, Калифорния, САЩ). 2- [N- (7-нитробенц-2-окса-1,3-диазол-4-ил) амино] -2-дезокси-d-глюкоза (2-NBDG) е от Invitrogen (Карлсбад, Калифорния, САЩ).
2.2. Подготовка на пробата
Семената на F. tataricum (елда) са предоставени от тайванската компания Golden Buckwheat Limited) и след това са изсушени чрез замразяване и смлени. Приблизително 2,5 kg от елдата на прах се екстрахира с 25 L 75% етанол за 2 дни. След екстракция етаноловите екстракти бяха концентрирани във вакуум и лиофилизирани. Екстрактът на прах се съхранява при -20 ° C, докато се използва. 75% етанолови екстракти от елда са показани като EEB в това проучване.
2.3. Клетъчна култура
Клетките FL83B се засяват в 10 cm съдове с плътност 5 × 10 5 на гнездо и се отглеждат до достигане на 80% сливане. Впоследствие в тези клетки се индуцира инсулинова резистентност и се определя усвояването на глюкоза [11]. Клетъчната линия FL83B е нормална чернодробна клетка на мишка от Центъра за събиране и изследване на биоресурси (BCRC) в Тайван (Hsinchu, Тайван), която се култивира в среда F12-K, допълнена с 10% дезактивиран FBS и антибиотици (100 единица/mL пеницилин и 100 μg/mL стрептомицин). Клетките се култивират при 37 ° С в овлажнена атмосфера от 5% CO2.
2.4. Тест за високоефективна течна хроматография (HPLC)
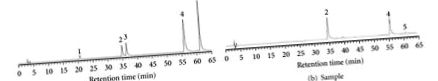
HPLC се извършва с течен хроматограф на Hitachi (Hitachi, Ltd., Токио, Япония), състоящ се от модел L-6200 помпа и модел L-4200 UV-Vis детектор, настроен на 320 nm. Анализите бяха проведени на колона LiChrospher RP-18 (250 mm · 4.6 mm i.d., 5 μm, E. Merck Co., Darmstadt, Германия). Екстрактите се филтрират през 0,45 μm филтър преди употреба. Подвижната фаза А е 2% оцетна киселина, а подвижната фаза В е 0,5% оцетна киселина/вода (1: 1; v/v). Ефективната киселина, рутин, кверцетин, кемпферол и кверцетин-3-глюкозид се определят с ултравиолетов детектор (Hitachi L-7455 диоден детектор). Caffic киселина, рутин, кверцетин, кемпферол и кверцетин-3-глюкозид бяха идентифицирани чрез сравняване на техните стойности на времето на задържане (Rt) и UV спектрите с тези на известните стандарти и определени от пиковите области от хроматограмите [12]. Резултатите предполагат, че 228,8 mg/g рутин и 58,6 mg/g кверцетин се съдържат в EEB (Фигура 1).
(а) HPLC хроматограма на стандарти (рутин и кверцетин): (1) катафикова киселина, (2) рутин, (3) кверцетин-3-глюкозид, (4) кверцетин и (5) кемпферол. (b) HPLC хроматограма на проба (75% етанолови екстракти от F. tataricum).
2.5. Клетъчна жизнеспособност
Миши FL83B клетки (1,5 х 105 клетки на гнездо) се посяват в плаки с 24 гнезда за една нощ. Клетките се третират с висока глюкоза (33 mM) и проба (кверцетин/рутин/EEB) в свободна серумна среда F12-K в продължение на 48 часа. Впоследствие клетките се промиват с фосфатно буфериран физиологичен разтвор (PBS) два пъти и супернатантите се обменят с 1 ml среда и МТТ (0,5 mg/ml), за да реагират в продължение на 2 часа при 37 ° С. След реакция, отстраняване на средата и измиване на клетки с PBS, реагиралият с МТТ продукт (кристали на формазан) се разтваря с 0,5 ml диметилсулфоксид (DMSO) и абсорбцията се измерва при 570 nm от ELISA четец за анализ на жизнеспособността на клетките.
2.6. Индукция на инсулинова резистентност и усвояване на глюкоза (2-NBDG)
Поглъщането на глюкоза от FL83B клетки беше оценено с помощта на флуоресцентен аналог на глюкоза, 2-NBDG. Накратко, клетките бяха третирани с висока глюкоза (33 mM) и проба в среда без серум в продължение на 48 часа и след това средата беше заменена с буфер на Krebs-Ringer-бикарбонат (KRB), съдържащ инсулин (500 nM; крайна концентрация) и 2 -NBDG (160 μM; крайна концентрация) за 20 минути за инкубация при 37 ° C. Свободният 2-NBDG се измива от култури след третиране и се измерва 2-NBDG с поточен цитометър FACS (BD Biosciences, Сан Хосе, Калифорния, САЩ) и се анализира с помощта на софтуера CellQuest [11].
2.7. Анализ на Western Blot
2.8. Проучване на животни
C57BL6 мишки (на 4 седмици) са получени от BioLASCO, Taiwan Co., Ltd. в това проучване. Животните бяха снабдени с храна и вода ad libitum. Животните бяха подложени на 12-часов цикъл светлина/тъмнина с поддържана относителна влажност 60% и температура при 25 ° С. Експериментите са проведени в квалифицирана стая за разплод на животни в центъра за животни в нашия институт. Хипергликемия и хиперинсулинемия при мишки се индуцират от богата на фруктоза диета (FRD; 60%) в продължение на 8 седмици на индукция [13]. Животните бяха разделени на случаен принцип в 6 групи (n = 12), включително (a) контрол, (b) богата на фруктоза диета (FRD), (c) FRD + кверцетин (3 mg/kg телесно тегло), (d) FRD + рутин (11,5 mg/kg т.т.), (e) FRD + EEB (50 mg/kg т.т.) и (f) FRD + рутин + кверцетин. Дозите рутин и кверцетин са еквивалентни на тези, прилагани на групата за приложение на EEB.
2.9. Тест за орална толерантност към глюкоза (OGTT)
OGTT се провежда на седмица 4 и седмица 8. Експериментът се извършва върху животни след гладуване в продължение на 12 часа (свободен достъп до вода). Животните са получавали глюкоза (2 g/kg телесно тегло) с орално приложение. Кръвни проби се събират от опашната вена на моменти 0, 30, 60, 90 и 120 минути след прилагане на глюкоза. Оценката на хомеостазния модел на инсулинова резистентност (HOMA-IR) се изчислява по формулата HOMA-IR = инсулин на гладно × глюкоза на гладно/22,5 [14, 15].
2.10. Анализи за кръвна глюкоза
Кръвната глюкоза веднага се определя по метода на глюкозната оксидаза, като се използва анализатор [16].
2.11. Анализ за антиоксидазна активност
Активността на глутатион пероксидазата (GPx) се определя, както е описано по-рано [17]. Определянето на активността на глутатион редуктаза (GR) е съгласно Bellomo et al. (1987) [18]. Активността на каталазата (CAT) се определя по метода на Aebi (1984) [19]. Активността на SOD се определя по метода на S. Marklund и G. Marklund (1974) [20].
2.12. Анализ за реактивни на черния дроб и панкреаса видове кислород (ROS)
Нивата на ROS са анализирани с нитроблуев тетразолий (NBT), който е редуциран, за да образува синьо-черен формазан. В този анализ 100 μL хомогенати реагират с 10 mg/ml NBT и се измерват чрез абсорбцията при 570 nm [21].
2.13. Анализ за ниво на инсулин
Инсулинът се определя от инсулиновия комплект, получен от Mercodia AB (Упсала, Швеция).
2.14. Хистопатологични изследвания
Чернодробните тъкани бяха подрязани (2 mm дебелина) и фиксирани (буферен формалдехид). Фиксираните тъкани бяха обработени, включително тези, вградени в парафин, разрязани и рехидратирани. Хистологичното изследване по предишните конвенционални методи оценява индекса на етанол-индуцирана некроза чрез оценка на морфологичните промени в чернодробните участъци, оцветени с хематоксилин и еозин (Н и Е) [22].
2.15. Статистически анализ
Експерименталните резултати бяха усреднени трикратни анализи. Данните бяха записани като средно ± стандартно отклонение (SD) и анализ чрез система за статистически анализ (SAS Inc., Cary, NC, USA). Еднопосочен дисперсионен анализ беше извършен по ANOVA процедури. Значителни разлики между средните стойности бяха определени чрез многобройните тестове на Дънкан. Резултатите се считат за статистически значими при P Фигура 1). Проведохме 2-NBDG поглъщащ тест, включващ FL83B клетки с индуцирана с висока глюкоза (33 mM) инсулинова резистентност, за да оценим ефектите от EEB (100 μg/ml), рутин (23 μg/ml; 37 μM) и кверцетин ( 6 μg/mL; 20 μM) за подобряване на инсулиновата чувствителност. Резултатите показаха, че EEB, кверцетин и рутин значително увеличават усвояването на глюкоза в тези клетки (Фигура 2 (а)). Освен това, лекуваните концентрации на EEB, рутин и кверцетин без цитотоксични ефекти са открити в FL83B хепатоцити (данните не са показани).
Ефекти на EEB върху усвояването на 2-NBDG (a), фосфорилирането на Akt (b) и експресията на GLUT2 (c) на хепатоцитите FL83B, индуцирани от висока глюкоза. FL83B клетките се инкубират в безсерумна F12K среда с глюкоза (33 тМ; крайна концентрация) със или без EEB, кверцетин, рутин и кверцетин + рутин в продължение на 48 часа. EEB: 75% етанолови екстракти от елда. # Значително различни (P Фигура 2 (b)). Тези резултати показват, че излагането на високи концентрации на глюкоза предизвиква състояние, подобно на инсулинова резистентност, включително инхибиране на Akt пътя и EEB, рутин, кверцетин и рутин + кверцетин могат да преодолеят инсулиновата резистентност чрез активиране на Akt пътищата, като по този начин се води до повишена глюкоза усвояване.
GLUT2 е основният преносител на глюкоза, експресиран в хепатоцити, секретиращи инсулин β-клетки на панкреаса и абсорбиращи епителни клетки на чревната лигавица и бъбреците. Смята се, че GLUT2 действа като глюкозосензор, който играе роля в хомеостазата на кръвната глюкоза, като реагира на промените в концентрацията на глюкоза в кръвта и променя скоростта на усвояване на глюкозата от хепатоцитите. Високите нива на глюкоза намаляват експресията на GLUT2 протеин в клетки FL83B, но EEB, рутин, кверцетин и рутин + кверцетин значително увеличават експресията на GLUT2 протеин (Фигура 2 (в)). Резултатите показват, че EEB, рутин и кверцетин насърчават фосфорилирането на Akt, от своя страна насърчавайки транслокацията на GLUT2 в плазмената мембрана на клетки FL83B, като по този начин увеличават усвояването на глюкозата и облекчават инсулиновата резистентност, индуцирана от високо глюкоза. Въпреки че лечението с рутин + кверцетин не показва синтетичен ефект върху усвояването на 2-NBDG, фосфорилирането на Akt и експресията на GLUT2 в хепатоцитите, предизвикани от високо глюкоза FL83B, в сравнение с групите, третирани с кверцетин или рутин.
3.2. Ефекти на EEB, рутин и кверцетин върху AMP-зависима протеин киназа (AMPK), протеин тирозин фосфатаза 1B (PTP1B) и експресии на гликоген синтаза (GS) в хепатоцити FL83B
AMPK е запазен вътреклетъчен енергиен сензор, който играе централна роля в регулирането на глюкозния и липидния метаболизъм, а AMPK има множество биологични ефекти, включително регулирането на вътреклетъчния транспорт на глюкоза [24]. Последните проучвания показват, че AMPK може потенциално да бъде полезен като терапевтична цел при лечението на диабет и затлъстяване [25]. Експресията на AMPK обаче ще бъде инхибирана от оксидативен стрес и ER стрес при възпалителни фактори или индукция на високо глюкоза, понижаваща експресията на AMPK и фосфорилиране [1, 5, 6, 8]. От друга страна, специфичният за черния дроб PTP1B играе ключова роля в метаболизма на глюкозата и липидите. Инхибирането на PTP1B в периферните тъкани може да бъде от полза по отношение на лечението на диабет, както и лечението на метаболитен синдром и намаляване на сърдечно-съдовия риск. Изследването демонстрира, че експресията на PTP1B участва в ER стрес при индукция с висока глюкоза [1, 24]. В допълнение е доказано, че естественият продукт, монасцин, идентифициран от ферментирали Monascus продукти, показва инхибиторната активност за експресия на PTP1B в индуцирани от инсулин резистентност клетки C2C12 [26].
Оценихме ефектите на EEB, рутин и кверцетин върху експресията на AMPK и PTP1B на хепатоцити FL83B, индуцирани от лечение с високо глюкоза в продължение на 48 часа. Резултатите показват, че EEB, рутин и кверцетин значително предотвратяват намаляването на AMPK (Фигура 3 (а)), а инхибирането на PTP1B е установено при лечение с EEB, рутин и кверцетин в индуцирани с високо глюкоза хепатоцити FL83B (Фигура 3 ( б)). Тези резултати показаха, че EEB, рутин и кверцетин могат значително да регулират активността на AMPK и PTP1B в хепатоцитите FL83B, като по този начин отслабват инсулиновата резистентност и насърчават поемането на 2-NBDG.
3.3. Антиоксидативен стрес и анти-PPARγ фосфорилиране от EEB, рутин и кверцетин в FL83B хепатоцити
Доказано е, че високите нива на глюкоза индуцират активността на възпалителни цитокини, хемокини, p38 митоген-активирана протеин киназа, реактивни кислородни видове (ROS), протеин киназа C (PKC) и активност на ядрен фактор-kB (NF-kB) в клинични и експериментални системи [27–29]. Ние оценихме инхибиторния ефект на EEB върху производството на ROS в това проучване. Високите нива на глюкоза значително увеличават производството на ROS, докато лечението с EEB, рутин, кверцетин и рутин + кверцетин може да намали производството на ROS в индуцирани от високо глюкоза хепатоцити FL83B (Фигура 4). Активирането на p-PKC директно допринася за оксидативния стрес и свързаните с мембраната NADPH оксидази, което допълнително води до прекомерно производство на ROS. Резултатите предполагат, че EEB, рутин, кверцетин и рутин + кверцетин значително инхибират PKC фосфорилирането, причинено от индукция с висока глюкоза за 48 часа (Фигура 5 (а)).
3.4. Регулирането на EEB, рутин, кверцетин и рутин + кверцетин върху кръвната глюкоза In Vivo
Фруктозата се използва за индуциране на инсулинова резистентност, чернодробна стеатоза и метаболитен синдром [32]. Фруктозата е силно липогенна захар, която има дълбоки метаболитни ефекти в черния дроб, водещи до метаболитен синдром, а фруктозата не стимулира секрецията на инсулин [6]. Скоростта на чернодробно усвояване на фруктоза от порталната циркулация е по-голяма от скоростта на усвояване на глюкозата и тъй като метаболизмът на фруктозата заобикаля фосфофруктокиназата, метаболизмът на фруктозата не е под регулаторния контрол на инсулина [7].
Нивата на кръвната глюкоза и инсулина в групата, предизвикана от FRD, са значително повишени в сравнение с нормалната група, което предполага, че FRD значително индуцира хиперинсулинемия и хипергликемия, а повишенията на кръвната глюкоза и инсулина са инхибирани от EEB и рутин/кверцетин + лечение с рутин; освен това стойността на HOMA-IR чрез индукция на FRD беше значително намалена чрез лечение с EEB и рутин/кверцетин + рутин (Таблица 1). От друга страна, подобряването на EEB и прилагането на рутин/кверцетин + рутин за регулиране на кръвната глюкоза при OGTT тест беше значително наблюдавано в сравнение с контролната група и FRD-индуцираната група, което предполага, че хипогликемичната активност на рутин + кверцетин и EEB е едновременно по-голямо от приложението на рутин или кверцетин от 30 минути до 120 минути (Фигура 6). Тези ефекти обаче не са открити в групата на кверцетин, което показва, че EEB и кое активно вещество (рутин) подобряват чувствителността към инсулин при мишки C57BL/6, индуцирани от FRD.
- Пълна статия Силимарин подобрява индуцираното увреждане на черния дроб и инсулиновата резистентност чрез намаляване
- Лесни за следване насоки за обръщане на инсулиновата резистентност
- Инсулиновата резистентност причинява ли наддаване на тегло Marty Kendall
- Състоянието на фолиева киселина и витамин В12 е свързано с инсулинова резистентност и метаболитен синдром в
- Промяна на глюкозата и инсулинова резистентност при асимптоматични затлъстели деца и юноши