Субекти
Резюме
Непосредствената близост на хранопровода до задната стена на лявото предсърдие предразполага хранопровода към термично увреждане по време на катетърна аблация за предсърдно мъждене (AF). В това ретроспективно проучване имахме за цел да изследваме рисковите фактори за увреждане на хранопровода (EI), причинено от аблация на катетъра за AF. Включени са пациенти, претърпели за първи път аблация на AF от юли 2013 г. до юни 2018 г. Езофагусът се визуализира чрез орално разтворим контраст по време на аблация за всички пациенти и подгрупа от пациенти е избрана да се подложи на ендоскопска ултрасонография (EUS), за да се оцени EI след аблация. Степента на EI е категоризирана като класификация в Канзас Сити: тип 1: еритема; тип 2: язви (2a: повърхностни язви; 2b: дълбоки язви); тип 3: перфорация (3а: перфорация без комуникация с предсърдията; 3b: атриоезофагеална фистула [AEF]). От 3 852 пациенти 236 пациенти (61,5 ± 9,7 години; мъже, 69%) са получили EUS (EUS група) и 3616 (63,2 ± 10,9 години; мъже, 61,1%) без EUS (No-EUS група). В групата на EUS EI се наблюдава при 63 пациенти (EI от тип 1 при 35 и EI от тип 2 при 28) и по време на проследяването не се наблюдава EI от тип 3. При многовариативен логистичен регресионен анализ припокриването между аблационната лезия и хранопровода е независим предиктор за EI (коефициент на вероятност 21,2; 95% CI: 6,23–72,0; P
Въведение
Методи
Популация от пациенти
Всички пациенти със симптоматична пароксизмална или персистираща ФП, подложени на първа катетърна аблация (радиочестота или крио аблация) в нашата институция между юли 2013 г. и юни 2018 г., бяха включени в изчерпателна база данни и индексът на процедурата беше събран и анализиран. Пациентите бяха разделени на 2 групи: пациенти с ендоскопска ултрасонография (EUS група) и пациенти без EUS (No-EUS група). Всички методи са проведени в съответствие със съответните насоки и разпоредби. Протоколът за проучване е одобрен от институционалните съвети за преглед на болница Sir Run Run Shaw и е получено писмено информирано съгласие от всеки пациент.
Процедура за аблация на предсърдно мъждене
Трансезофагеална ехокардиография или компютърно томографско сканиране (CT) на лявото предсърдие (LA) е извършено преди процедурата за аблация, за да се изключат тромбите на лявото предсърдие при всички пациенти. Интравенозен хепарин 100 IU/kg е приложен след успешна трансептална пункция, последван от 1000 IU/час, независимо от пероралния антикоагулационен режим. По време на процедурата пациентите получават съзнателна седация, използвайки мидазолам и непрекъсната инфузия на фентанил съгласно нашия стандартен протокол. LET не се предлагат в нашата институция.
PVI беше стандартен подход при всички пациенти. Радиочестотната (RF) аблация се извършва с помощта на триизмерна електроанатомна система за картографиране (CARTO; Biosense Webster, CA или NavX/Velocity; Abbott, St. Paul, MN). След двойни трансептални пункции напоеният RF аблационен катетър и кръгов картографиращ катетър бяха позиционирани в LA. Радиочестотната енергия се доставя на разстояние 5–10 mm от PV ostia, като се използва режим за управление на мощността (35 W за предната стена и до 25 W за задната стена), както беше описано по-горе 10. Когато има припокриване между аблационната лезия и хранопровода по задната стена, се прилага модифицирана аблация (мощност ≤25 W и продължителност ≤15 секунди) 11. Допълнителни процедури за аблация, като лезия на кутия при персистираща ФП, бяха извършени по преценка на операторите.
Криоаблацията се извършва с помощта на 23/28-милиметров криобалон (Arctic Front Advance, Medtronic, Inc., Минеаполис, MN), вмъкнат чрез 12 френски управляеми обвивки (FlexCath, Medtronic, Inc.) върху кръгъл катетър/направляващ вътрешен лумен (Achieve, Medtronic, Inc.). Едно до две 120- до 180-секундни крио приложения бяха доставени на всеки фотоволтаич, водени от времето до PVI. Приложена е модифицирана аблация (температура ≥ − 50 ° C и по-кратка продължителност [≤120 s, когато времето до PVI по-малко от 60 s]), когато е имало припокриване между лезията на аблация и хранопровода 12. PVI се оценява непрекъснато, като се използва кръговият катетър Achieve по време на криоаблация. Ако PV остане свързан след 2 или повече крио приложения, RF приложението се изпълнява, за да се постигне PVI, използвайки широко антрална техника за периферна аблация.
Припокриване между аблационната лезия и хода на хранопровода
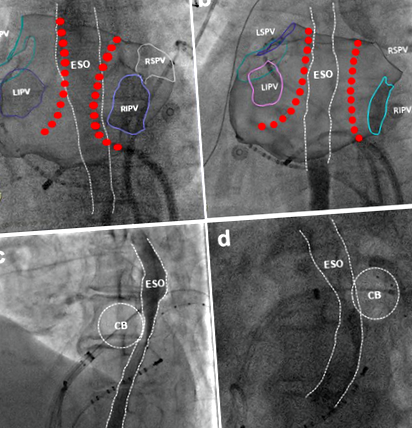
Преди да бъде доставена енергията за аблация, на всеки пациент е даден орален разтворим контраст (5 ml), за да се определи хода на хранопровода под флуороскопия, а аблационната лезия е проектирана да сведе до минимум директния контакт на аблационния катетър с хранопровода 10. Пространствената връзка между хранопровода и задната стена на лявото предсърдие е оценена в изгледи на проекция отзад-отпред (PA) и ляво странично (LL) по време на RF аблация и два изгледа за ортогонална проекция на лява предна коса (LAO) и дясна предна коса (RAO) по време на крио аблация. Когато точките на аблация на аблация са извън границата на хранопровода (фиг. 1А) или предната половина на криобалона е близо до хранопровода под LAO (фиг. 1С), се определя припокриването между аблационните лезии и хода на хранопровода (фиг. 1).
Припокриване между аблационната лезия и хода на хранопровода. Проектираната радиочестотна аблация на аблация с (а, PA изглед) и без (б, PA изглед) се припокриват с хода на хранопровода. Крио аблационна лезия с (° С, LAO изглед) и без (д, LAO съдовете) се припокриват с хода на хранопровода. CB = криобалон; ESO = хранопровод.
Езофагеална ендоскопия и ултрасонография
Решението за извършване на EUS е взето по преценка на операторите въз основа на потенциални рискови фактори на EI 3,13,14,15,16,17, както и клинична проява след аблация (като треска, дискомфорт в гърдите, повишена бяла кръв брой клетки и ниво на С-реакционен протеин).
EUS беше извършен от опитни оператори, за да се оцени величината на EI. EI се дефинира като всяка езофагеална лезия, съседна на контактната зона между хранопровода и LA, и се определя съгласно класификацията в Канзас Сити: тип 1: еритема; тип 2: язви (2a: повърхностни язви; 2b: дълбоки язви); тип 3: перфорация (3а: перфорация без комуникация с предсърдията; 3b: перфорация с атриоезофагеална фистула) 18. Всички гастроскопии (GIFQ 260, GIFQ 165, GIFQ 145; Olympus, Япония) са извършени от ендоскописти в лаборатория за ендоскопия. За изследване е използван радиален ехоендоскоп (EU-ME2 PREMIER PLUS, Olympus, Япония). Извършен е внимателен преглед на медиастинума и стената на хранопровода, за да се оценят лигавичните и перизофагеалните/медиастиналните лезии. Пациентите са били на гладно поне 8 часа преди процедурата. Изследванията бяха извършени в ляво странично декубитално положение и под съзнателна седация с пропофол.
Управление на увреждане на хранопровода
Всички пациенти са получавали рутинна мека диета и инхибитори на протонната помпа (PPI) в продължение на 6 седмици след аблация на AF. Пациентите с EI тип 1 получават полутвърда диета, както и PPI. Пациентите с тип 2 EI получават интравенозно PPI и държат на гладно, докато повторното EUS не покаже разрешаване на EI или подобрение до лезия от тип 1 (фиг. 2). Ако очакваното време за възстановяване е над 7 дни, се поставя еюнална сонда за хранене.
Травма на хранопровода след аблация, показана чрез ендоскопска ултрасонография. Гастроскопия разкри язва на хранопровода (a1, кръг с бяла точка) 2 дни след радиочестотна аблация. Ултрасонографията показва удебеляване и загуба на архитектурата на субмукозните слоеве (a2, кръг с бяла точка). Хранопроводът се възстанови с нормална архитектура 10 дни по-късно (b1, b2, кръг с бяла точка).
След като се подозира EI от тип 3, се извършва CT подсилено CT. EI от тип 3 се определя, когато изображенията показват екстравазация на въздух или орално контрастно вещество от хранопровода до медиастинума, перикарда или LA. Когато AEF беше изключен, EUS беше длъжен да оцени величината на EI. За пациенти с езофагоперикардна фистула (EPF), навременна перикардиоцентеза и дренаж бяха извършени в допълнение към допълнително лечение с широкоспектърни антибиотици и хранителна подкрепа. След диагностицирането на AEF се проведе мултидисциплинарна оценка и се обмисли хирургично възстановяване.
Проследяване
Всички пациенти са били проследявани на всеки 2 седмици през първите 3 месеца след аблация на AF и на всеки 3 месеца след това.
Статистически анализ
Непрекъснатите променливи се изразяват като средна стойност ± SD или медиана. ANOVA се използва за сравняване на различни групи. Категоричните променливи са представени като броячи и проценти и са сравнени между групи, използвайки χ2 тест или точен тест на Фишер, според случая. За логистична регресия резултатите бяха дадени като коефициенти на вероятност, 95% доверителни интервали и P стойности. P стойности
Резултати
Популация от пациенти
Общо 3 852 пациенти са претърпели PVI за първа аблация на AF в нашата институция между юли 2013 г. и юни 2018 г. От тях 236 пациенти (61,5 ± 9,7 години; мъже, 69,1%) са претърпели EUS в рамките на 3 дни след аблация (EUS група) и 3616 пациенти (63,2 ± 10,9 години; мъже, 61,1%) не са претърпели EUS (No-EUS group, Фиг. 3). Пациентите в групата с EUS имат по-нисък ИТМ и по-висок процент на хипертония и диабет в сравнение с тези в групата без EUS (Таблица 1).
Диаграма на кохортата на пациентите, анализирана и включена в проучването. EI = увреждане на хранопровода; EUS = ендоскопска ултрасонография; Класификация в Канзас Сити: тип 1: еритема; тип 2: язви (2a: повърхностни язви; 2b: дълбоки язви); тип 3: перфорация (3а: перфорация без комуникация с предсърдията; 3b: AEF).
Нараняване на хранопровода в EUS група
В групата на EUS 236 пациенти са претърпели AF аблация с 3 енергийни метода: 161 пациенти (68,2%) с RF, 53 пациенти (22,5%) с Cryo и 22 пациенти (9,3%) с Cryo плюс RF. От 236 пациенти 150 (63,6%) са се припокривали между аблационните лезии и хода на хранопровода, а 60 пациенти (40%) са имали ЕИ: 25 пациенти с ЕИ тип 1 и 35 с ЕИ тип 2, докато при 86 пациенти без припокриване между аблационната лезия хранопровод, 3 пациенти (3,5%) са имали категория 1 EI (P Таблица 2 Характеристика на пациенти, подложени на ендоскопска ултрасонография.
Увреждане на хранопровода в група без EUS
В група без EUS 3 616 пациенти са претърпели аблация на AF с 3 енергийни метода: 3227 пациенти (89,2%) с RF, 331 пациенти (9,2%) с Cryo и 58 пациенти (1,6%) с RF плюс Cryo. Общо 2045 пациенти (56,6%) са се припокривали между аблационните лезии и хода на хранопровода. Пет пациенти (0,14%) развиха EI от категория 3: 3 с категория 3а (EPF) и 2 с категория 3b (AEF, таблица 3). Всичките 5 пациенти са получили RF аблация и са имали припокриване между аблационната лезия и хода на хранопровода. При 3-те пациенти с EPF 1 умира в резултат на прогресия към AEF след ендоскопско затваряне с титаниева скоба (фиг. 4), а 2 се възстановяват без последствия след консервативно лечение (фиг. 5) При пациенти с AEF 1 е подложен на хирургичен ремонт, но е починал поради септичен шок, а 1 е починал 3 дни след постъпване в местна болница.
Прогресия от езофагоперикардна фистула до атриоезофагеална фистула. Неподобрената КТ разкри пневмоперикард (a1, стрелка) и наличието на суспензия на бариев сулфат преди езофаграфия в перикардната торбичка (a2, стрелка). Ендоскопско затваряне на перфорация на хранопровода с титаниеви скоби (b1,b2). Газът (кръг с бяла точка) в лявото предсърдие, документиран от CT (c1) и множествена церебрална емболия, документирана чрез ЯМР (c2).
Еволюция на езофагоперикардната фистула след аблация. Гастроскопията демонстрира прогресия на езофагоперикардната фистула 7 дни (a1) 14 дни (b1), 21 дни (c1) и 30 дни (d1) след RF аблация. Ултрасонографията разкрива плътно ехо с въздух, което показва локално образуване на фистула (a2, кръг с бяла точка) и възстановяване на тъканния слой на хранопровода (b2,c2,d2).
Дискусия
Изследването е ретроспективно наблюдателно проучване и основните констатации са: (1) Припокриването между лезията на аблация и хода на хранопровода е независим предиктор за EI; (2) EUS може да предотврати прогресирането на EI, а консервативното лечение, ръководено от EUS, може да бъде алтернатива при управлението на EPF; (3) Остава предизвикателство да се идентифицират пациенти с висок риск от ЕИ.
Честота и предиктори на увреждане на хранопровода
Последното проучване показва, че аблация на криобалон за ФП, ръководена от времето до PVI, намалява езофагеалните усложнения 19. В съответствие с предишното проучване за аблация на криобалон, при което са съобщени общо 11 случая на AEF от повече от 120 000 случая по света 20, нашите данни подкрепят, че аблация на криобалон има по-ниска честота на EI, въпреки че това не е нашата основна цел. Много признаци след аблация, като треска, дискомфорт в гърдите, повишен брой на левкоцитите и ниво на CRP, могат да бъдат причинени от нараняване на вагусния нерв или възпалителна реакция. Тези фактори са неспецифични и не могат да бъдат използвани за идентифициране на пациенти, които са изложени на висок риск от ЕИ.
Очакваната честота на AEF, от 0,05% до 0,25% 21, може да бъде подценена поради недостатъчно докладване или неправилна диагноза. Проучването на Halbfass демонстрира, че само улцерозен ИИ е свързан с перфорация на хранопровода 5. Въпреки че пациентите с висок риск от EI бяха избрани да преминат EUS, 5 пациенти развиха EI тип 3 в група, която не е EUS, което предполага, че това изисква по-нататъшно разследване за идентифициране на надеждни предиктори на тип 3 EI.
Управление на нараняване на хранопровода
Въпреки че точният механизъм на EI от аблация не е напълно разбран, язвата на хранопровода изглежда предшества развитието на AEF 21,22. Проучването на Halbfass показва, че около 10% от язвения ИИ е прогресирал до перфорация на хранопровода 5. Като се има предвид, че причиненото от аблация нараняване засяга хранопровода отвън и визуализацията на лигавицата може да представи по-малко действителния размер на EI 18, EUS е извършено при пациенти с висок риск от развитие на EI в нашето проучване. В групата на EUS няма пациенти с улцерозен ЕИ, които са прогресирали до тип 3 ЕИ в резултат на агресивно лечение, ръководено от EUS.
Ограничения
Заключения
Аблацията в близост до хранопровода увеличава риска от ЕИ. EUS след аблация може да предотврати прогресирането на EI и може да бъде полезен при консервативното управление на PEF. Остава предизвикателство да се идентифицират надеждни прогнози за EI.
- Клинични характеристики и резултат на болни със затлъстяване бариатрични пациенти със съпътстващ хепатит
- Предизвикателства при храненето при пациенти с рак на хранопровода и гастроезофагея - FullText -
- Различни характеристики на качеството на живот при пациенти с целиакия - PubMed
- Храни, които не са полезни за пациенти с таласемия Др
- Отлично лечение и грижи в Индия за язва на хранопровода