Резюме
1. Въведение
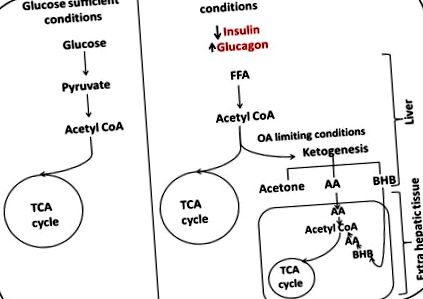
При нормални условия глюкозата се превръща в ацетил КоА и навлиза в цикъла на трикарбоксилната киселина (TCA), за да се получи енергия. Когато глюкозата стане ограничаваща, нивата на глюкагон се повишават, улеснявайки транспортирането на свободни мастни киселини (FFA) в черния дроб, окисляването на мастните киселини се извършва от черния дроб, за да генерира кетонни тела, които могат да отговорят на енергийните нужди на мозъка. Кетогенезата се увеличава, тъй като наличността на оксалоацетат (ОА) се ограничава, което принуждава пуловете ацетил КоА към производството на кетони. Кетоните се превръщат в ацетил КоА в допълнителните чернодробни тъкани и влизат в TCA цикъла, снабдявайки с енергия.
2.1 Кетогенеза
Ацетоацетат (AA), 3-β-хидроксибутират (BHB) и ацетон (най-малко в изобилие) са трите кетонни тела, произведени по време на кетогенезата. АА е централното кетонно тяло, произведено и използвано в хода на междинния метаболизъм от 3-хидрокси-3-метилглутарил коензим-А (HMG CoA), а останалите кетонни тела са получени от него [3, 5]. Ацетонът се получава чрез спонтанно декарбоксилиране на АА. Той е от клиничен интерес преди всичко, защото придава плодов мирис, по който може да се идентифицира кетоза. BHB се образува от редукцията на АА чрез действието на 3-хидроксибутират дехидрогеназа (EC 1.1.1.30) [3].
2.2 Кетолиза
Веднъж образувани в черния дроб, кетоните след това се дифузират в кръвообращението за използване в екстрахепаталните тъкани, където настъпва кетолиза. В присъствието на сукцинил-CoA: 3 оксокиселина CoA-трансфераза (EC 2.8.3.18, SCOT), AA се активира до ацетоацетил-CoA, който след това се превръща в AcCoA от митохондриална ацетоацетил CoA тиолаза (EC 2.3.1.9) [3, 5, 15]. След това произведеното AcCoA може да се използва за производство на енергия чрез окислителен метаболизъм. Кетолитичният капацитет на тъканите зависи от тяхната SCOT активност. Известно е, че сърцето има най-висока SCOT активност, последвано от бъбреците. Това прави сърцето и бъбреците да имат най-голям капацитет за използване на кетонното тяло. Кетоните могат да служат като основен енергиен източник в мозъка, с SCOT активност от
10% в сравнение с това на сърцето, по време на гладуване или гладуване. Важно е, че нито SCOT протеинът, нито иРНК се откриват в черния дроб, като по този начин предотвратяват безсмисленото циклиране на кетони в черния дроб. По този начин кетоните, произведени от черния дроб, се транспортират до екстрахепаталните тъкани, за да се използват като гориво, което прави черния дроб преобладаващият източник на кетогенеза [3, 15, 16]. Има доказателства в подкрепа на спада на функционалната SCOT с диабет. Изследванията върху животински модели на диабет показват, че съществува връзка между диабета и тирозиновата нитрация, което води до инактивиране на SCOT [17, 18]. Това инактивиране на SCOT е наблюдавано в сърдечната тъкан на животинските модели, въпреки че не е потвърдено при хора, може да се намекне, че диабетиците имат нарушен капацитет да изчистват кетоните от кръвообращението, поради потенциално увреждане на тяхната SCOT активност.
2.3. Ацетоацетат и β-хидроксибутират хомеостаза
Индивидуалната концентрация на кетон в тялото при диабет варира. BHB се открива при концентрации 2 до 3 пъти по-големи от тези на АА [19]. В зависимост от тежестта на инсулиновия дефицит, нивата на кетони, особено съотношението АА към BHB, могат да варират при пациенти с T1D навсякъде от 1: 1 до 1: 4 поради нарушеното използване на BHB, както и неспособността на екстра чернодробни периферни тъкани за взаимно преобразуване на BHB в AA [7, 19, 20]. Други фактори, които допринасят за съотношението на тези циркулиращи кетони, са намаленото състояние на черния дроб с повишаване на нивата на NADH и намаляване на активността на β-хидроксибутират дехидрогеназата [21, 22].
3. DKA, оксидативен стрес и съпътстващи заболявания при диабет
Въпреки че няколко проучвания предполагат антиоксидантна роля на кетоните и тяхното използване при лечението на различни заболявания [23-26], едно проучване, проведено от Beskow et al. оценява различни параметри на оксидативен стрес като окисляване на протеини и липиди, нива на ензимна и не-ензимна антиоксидантна защита и демонстрира, че AA и BHB нито предизвикват, нито предотвратяват оксидативен стрес in vitro [27].
3.1 Индукция на оксидативен стрес
Литературата показва, че кетоните могат да увеличат оксидативния стрес по няколко механизма и повишаването на регулацията на NADPH оксидазите е един такъв пример. Увеличаването на производството на супероксидни радикали, медиирано от кетони, може да регулира сигналните механизми, индуциращи експресията на адхезионни молекули. Доказано е в ендотелните клетки, където повишената експресия на адхезионната молекула може да доведе до прилепване на моноцитите, което потенциално може да доведе до иницииране на лезии или плаки или тъканна инфилтрация, допринасяща за увреждане на тъканите [31].
3.2 Ефекти върху инсулиновата резистентност/секреция
3.3 Потенциране на съдово възпаление
3.4 Участие в чернодробна дисфункция
3.5 DKA и мозъчни аномалии
Някои от факторите, допринасящи за повишаването на кетоните в кръвта, са показани на фигура 2. Те могат да имат физиологичен или патологичен характер. В обобщение, повишените кетони в зависимост от естеството на метаболитното състояние биха могли да имат различни ефекти. При нормални гликемични условия или при хипергликемични състояния, както се наблюдава при диабетични състояния, кетоните се натрупват и функционират по начин, който е вреден и увреждащ активиращи сигнални пътища, водещи до противовъзпалителни отговори. От друга страна, в хипогликемични състояния, повишените кетони се използват като гориво и се изчистват ефективно поради липсата на глюкоза. Поемането на кетон от тялото от тъканите за енергийни цели е енергийно ефективно и се счита за полезно.
Състояния, които предизвикват повишено регулиране на синтеза на кетони или причиняват натрупване на кетони в кръвта. При индивиди по време на нормални физиологични условия като гладуване и бременност, заедно с кърмаческа възраст, концентрацията на кетони се повишава в кръвта. Други състояния като диабет, известен също като състояние с дефицит на инсулин, алкохолизъм и някои мутации в гените, необходими за разграждането на кетоните, също повишават нивата на кетони в кръвта.
4. Физиологична кетоза
При физиологична кетоза нивата на кетон в кръвта са умерено повишени (
2 mM) [80]. Повишаването на кетоните, постигнато тук, е незначително и не достига опасно високи нива. Продължителните физически упражнения и гладуването са едни от честите причини за нормалното регулиране на отделянето на чернодробни кетони.
4.1 Гладуване
Физиологичният отговор на липсата на прием на храна е да се обърнат по няколко пътища, които в крайна сметка могат да осигурят гориво за тъканите и особено за мозъка. Гладуването или гладуването могат да инициират кетогенеза за регулиране и поддържане на хомеостазата на енергията на цялото тяло. Идеята, че глюконеогенезата от аминокиселини предхожда индуцирането на кетогенеза, докато последната се индуцира за целите на пестенето на протеини, е добре приета [2]. Оцеляването при продължителен глад е възможно благодарение на запасите от мастно гориво в тялото, като по този начин се щадят основните протеини, необходими за жизнените функции. Липсата на прием на храна (въглехидрати) причинява спад в нивата на инсулин с едновременно покачване на нивата на глюкагон в кръвта. Увеличението на глюкагона, както е обсъдено по-горе, причинява активирането на пътя на кетогенезата. Концентрациите на кетон в тялото през това време могат да достигнат до 6-8 mM [81]. Изходът на кетонното тяло, главно управляван от черния дроб, помага за поддържане на енергийните нужди на мозъка и други жизненоважни органи [2, 5, 81]. Кетогенезата, която се появява в този контекст, е основно за препитание и се счита за полезна при условия, лишени от храна.
4.2 Кетогенна диета
KD се използва за лечение на глюкозен транспортер 1 (GLUT1) и дефицит на пируват дехидрогеназа, когато пациентите не могат да използват глюкоза за енергийни цели и се нуждаят от алтернативен източник за оцеляването си [91–94]. Дефицитът на GLUT1 причинява нарушен транспорт на глюкоза през кръвно-мозъчната бариера и използването на KD диета осигурява кетони като алтернативен източник на енергия за мозъка. От друга страна, дефицитът на пируват дехидрогеназа възпрепятства превръщането на глюкозата в енергия и пациентите с този дефект могат да бъдат подпомогнати от включването на кетогенни диети [91–94]. Интересното е, че в момента се изследват и ползите от кетоните при лечението на рак. За разлика от нормалните мозъчни клетки, мозъчните туморни клетки (глиомни клетки) най-често показват намалена експресия на ензими в пътя на кетолизата [95, 96]. В резултат на това туморните клетки не могат да използват кетони, тъй като разчитат силно на глюкозата за енергия. Последните проучвания показват, че кетоните, прилагани като KD, увеличават преживяемостта при глиомни модели на мишки и гризачи, тъй като заместването на кетони с глюкоза възпрепятства способността на раковите клетки да метаболизират кетони и по този начин предотвратява растежа и оцеляването на раковите клетки [97–99].
Въпреки това, при пациенти, спазващи тази диета, са срещани различни проблеми (Таблица 1). С увеличаването на продължителността на диетата се увеличават и усложненията. Дългосрочният прием на KD е свързан с камъни в бъбреците, камъни в жлъчката, повишени чернодробни ензими и дори смърт в редки случаи [100]. Въпреки че диетата се понася добре от кърмачетата, тя създава трудности сред по-големите деца. Съобщава се за тънкости като дехидратация, стомашно-чревни нарушения, хиперхолестеролемия, метаболитна ацидоза [101] и сърдечни усложнения при пациенти след KD [102]. Усложненията, срещани с KD, въведоха формулирането на различни диети, които предлагат подобни ползи, но също така могат да се понасят добре. Модифицираната диета на Аткин, средноверижните триглицериди и лечението с нисък гликемичен индекс са включили по-голяма пропорция на протеини и въглехидрати в диетичния режим, за да осигурят повече възможности за избор на храна, по-добра поносимост и съответствие [85].
Маса 1
Таблицата изброява краткосрочните и дългосрочните усложнения, преживени от пациенти на диета с KD.
| Краткосрочен | Хипогликемия [138] |
| Дехидратация [139] | |
| Анорексия [138] | |
| Гастроезофагеален рефлукс [140] | |
| Повръщане [139, 141] | |
| Диария [140] | |
| Запек [141] | |
| Коремна болка [140] | |
| Дългосрочен | Промени в растежа [138] |
| Хиперлипидемия [142] | |
| Нефролитиаза [138] | |
| Недостиг на витамини, минерали и електролити [139] | |
| Хипертриглицеридемия [139, 143] | |
| Сърдечни усложнения [60] |
4.3 Възрастта и енергийните нужди
Други случаи също съобщават за повишено производство на кетон в организма. Например, поглъщането на мляко с високо съдържание на мазнини може да повиши кетонните тела при новородени бебета [103]. При малки деца с много високи енергийни нужди, дори еднодневно гладуване или инфекции могат да увеличат производството на кетонни тела, причиняващи хиперкетонемия [104, 105]. Изглежда, че съществува обратна корелация между възрастта и нивата на кетон в кръвта сред децата [105]. При възрастни обаче 12-16 часа на гладно може да предизвика умерено повишаване на нивата на кетони, докато гладуването до 3 дни може да постигне хиперкетонемия [106, 107]. Изключение от това е бременността. Бременните жени са склонни да имат високи нива на кетон в кръвта и нивата на кръвните им кетони след гладуване могат бързо да се увеличат, което ги прави по-податливи на кетоацидоза [108].
5. Патологична кетоза
Дисрегулираният метаболизъм на кетоните, който включва дефекти в клетъчния клирънс или прекомерното производство на кетони, може да увеличи концентрацията на кетон в кръвта до нива, които могат да причинят промени в рН на кръвта. Това необичайно повишаване на нивата на кетони може да бъде вредно.
5.1 Нарушен път на кетолиза
Хората с дефицит на ензими, участващи в разграждането на кетонното тяло или кетолизата, обикновено имат високи нива на кетони в кръвта си, докато от друга страна, вродените грешки в пътя на кетогенезата водят до високи FFA и ниски нива на кетони. Дефектите в пътя на кетолизата включват SCOT и дефицит на ацетоацетил КоА тиолаза, докато тези в пътя на кетогенезата включват HMG-CoA синтаза и дефицит на HMG-CoA лиаза [5]. Пациентите с дефицит на SCOT изпитват непрекъсната хиперкетонемия, която също се счита за постоянно повишаване на нивата на кетон в кръвта и след гладуване техните нива на кетони се повишават необичайно високо и те бързо развиват кетоацидоза [109]. Друго състояние, при което хората изпитват необичайно високи нива на кетон в кръвта, е дефицитът на ацетоацетил КоА тиолаза, който е свързан с повтарящи се атаки на кетоацидоза [110].
5.2 Алкохолна кетоацидоза
Това състояние най-често се диагностицира в спешното отделение при алкохолици. Алкохолната кетоацидоза е индуцирано състояние или състояние, което възниква при продължителен прием на етанол. Злоупотребата с алкохол може да доведе до ацидоза, медиирана от повишените нива на кетони в кръвта [111, 112]. Окисляването на етанол от чернодробен алкохол дехидрогеназа води до увеличаване на NADH и създава дисбаланс, благоприятстващ превръщането на FFA в кетони [113, 114]. Най-често това състояние е свързано с нормални нива на глюкоза в кръвта [111], но когато е придружено с недохранване (нисък прием на въглехидрати), пациентите стават хипогликемични и са в безсъзнание с потенциално мозъчно увреждане [115, 116]. Въпреки че хормоналният профил на тези пациенти е подобен на този с DKA (ниско ниво на инсулин и хормони с висок брой регулатори), техният биохимичен и метаболитен профил варира доста [117]. Изследването показва, че алкохолната кетоацидоза е имала по-високо съотношение BHB към АА и по-високи нива на лактат в сравнение с DKA, което може да се обясни с промененото окислително-редукционно състояние, индуцирано от метаболизма на алкохола [117].
5.3 Диабет
В резултат на относителна или абсолютна липса на инсулин повишената кетогенеза се наблюдава при пациенти с диабет, по-често при лица с тип 1, отколкото тип 2.
5.3.1 Диабет тип 1
Диабет тип 1 (T1D), който представлява
10% от случаите на диабет в световен мащаб се наблюдават най-често при деца и по време на юношеството [118]. T1D се медиира от автоимунното унищожаване на β-клетките на панкреаса, което води до абсолютен дефицит на инсулин. Необходимо е екзогенно приложение на инсулин, за да се постигне контрол върху повишените нива на глюкоза. Всеки пропуск в приложението на инсулин или пропусната доза може да доведе до активиране на пътя на кетогенезата. Кетонни нива от 1–2 mM (1–2 µmol/mL) често се наблюдават при пациенти с T1D по време на рутинни контролни посещения в клиниката [119–122]. Кетогенезата обикновено се предпочита и се счита за полезна по време на гладуване или глад, тъй като кетоните поемат ролята на генериране на енергия в условия на ограничаване на глюкозата. По същество това се случва при липса на поглъщане на въглехидрати и се регулира строго както от глюкагон, така и от инсулин. В случай на диабет, липсата на инсулин, съчетано с освобождаване на глюкагон, задвижва глюконеогенезата в черния дроб, липолизата в мастната тъкан и чернодробната кетогенеза [73]. Въпреки че са съобщени няколко предимства на кетоните, въпреки това, когато кетоните са в излишък, могат да причинят вредни ефекти. Натрупването на концентрация на кетони в кръвта, което потенциално може да доведе до спад на нивата на рН в кръвта, може да доведе до кетоацидоза, опустошително усложнение [73].
5.3.2 Диабетна кетоацидоза (DKA)
Бележки под линия
Отказ от отговорност на издателя: Това е PDF файл на нередактиран ръкопис, който е приет за публикуване. Като услуга за нашите клиенти ние предоставяме тази ранна версия на ръкописа. Ръкописът ще бъде подложен на редактиране, набиране и преглед на полученото доказателство, преди да бъде публикуван в окончателния си вид. Моля, обърнете внимание, че по време на производствения процес могат да бъдат открити грешки, които биха могли да повлияят на съдържанието, и всички правни откази от отговорност, които се отнасят до списанието, се отнасят до.
- Хотдоги, студените разфасовки значително увеличават риска от диабет Наука на живо
- По-голямата продължителност на затлъстяването повишава риска от диабет тип 2 сред жените
- Диета с ниско съдържание на въглехидрати и риск от диабет тип 2 при мъжете - PubMed
- Как да намалим риска от чернодробни заболявания с диабет тип 2
- Диетата с високо съдържание на фибри и ниско съдържание на мазнини предсказва дългосрочна загуба на тегло и намален диабет тип 2 рискуват