Чае-Юн Ким
1 Катедра по фармакология, Колеж по източна медицина, Университет Санджи, Wonju, Gangwon-do 220702
Кюнг-Сук Чунг
1 Катедра по фармакология, Колеж по източна медицина, Университет Санджи, Wonju, Gangwon-do 220702
Se-Yun Cheon
1 Катедра по фармакология, Колеж по източна медицина, Университет Санджи, Wonju, Gangwon-do 220702
Кюнджин Лий
2 Катедра по хербология, Колеж по корейска медицина, Университет Кюнг Хи, Сеул 130701
Inhye Ham
2 Катедра по хербология, Колеж по корейска медицина, Университет Кюнг Хи, Сеул 130701
Хо-Йънг Чой
2 Катедра по хербология, Колеж по корейска медицина, Университет Кюнг Хи, Сеул 130701
Йонг Байк Чо
3 Фармацевтичен център за научноизследователска и развойна дейност, Kolmar Korea Co. Ltd, Sejong 339853, Република Корея
Byoung-Heon Cho
3 Фармацевтичен център за научноизследователска и развойна дейност, Kolmar Korea Co. Ltd, Sejong 339853, Република Корея
Така че Юн Мок
3 Фармацевтичен център за научноизследователска и развойна дейност, Kolmar Korea Co. Ltd, Sejong 339853, Република Корея
Хьо-Джин Ан
1 Катедра по фармакология, Колеж по източна медицина, Университет Санджи, Wonju, Gangwon-do 220702
Резюме
HVC1, нова формация, съдържаща четири билки, е разработена и са изследвани нейните хиполипидемични ефекти при плъхове с хиперлипидемия, индуцирана с висок холестерол (HCD). Плъховете получават HCD за 8 седмици. Групите, лекувани с HVC1, се прилагат перорално HVC1 в дози съответно 10, 50 или 250 mg/kg, а групата на симвастатин се лекува в доза 10 mg/kg. Нормалната диета и контролните групи за HCD се прилагат с физиологичен разтвор. Пероралното приложение на HVC1 (10, 50 или 250 mg/kg) значително намалява телесното тегло на плъхове с хиперлипидемия и регулира общия холестерол, холестерола на липопротеините с ниска плътност и холестерола на липопротеините с висока плътност в серума. В допълнение, тъканният анализ разкрива, че натрупването на липиди в черния дроб и аортата е намалено чрез приложение на HVC1. Освен това, HVC1 значително намалява експресията на иРНК на активиран от пероксизомен пролифератор рецептор-γ, 3-хидрокси-3-метилглутарил-КоА редуктаза и липопротеинов рецептор с ниска плътност, както и нивото на протеин на 5 'аденозин монофосфат активирана протеин киназа в Черният дроб. Резултатите ясно показват, че HVC1 има мощен хиполипидемичен ефект и предполагат, че HVC1 трябва да се оцени като потенциално лечение за хиперлипидемия.
Въведение
Хиперлипидемията е група от нарушения, характеризиращи се с повишени концентрации на циркулиращи липиди, включително холестерол, естери на холестерола, фосфолипиди и триглицериди. Често е резултат от забавен или дефектен клирънс или свръхпродукция на липопротеин с много ниска плътност (VLDL) от черния дроб, който впоследствие се трансформира в липопротеин с ниска плътност (LDL). Прекомерният прием на наситени мазнини увеличава производството на липиди в черния дроб чрез молекулярен механизъм, включващ протеинови активатори (1). По-специално, хиперлипидемията е основен модифицируем рисков фактор за атеросклероза и сърдечно-съдови заболявания, включително коронарна болест на сърцето.
Въз основа на предишни данни, HVC1 е разработен за лечение или профилактика на хиперлипидемични заболявания (15) и настоящото проучване е предназначено да изследва хиполипидемичните ефекти на HVC1 в индуциран от хиперлипидемия модел на плъхове с висок холестерол (HCD).
Материали и методи
Реактиви
Нормалната диета (ND) и HCD са получени от Research Diets (New Brunswick, NJ, USA). Р-5 ′ аденозин монофосфат-активираната протеин киназа (P-5 ′ AMPK; Thr 172; кат. № sc-33524), AMPK (кат. № sc-398861) и β-актин (кат. № sc -81178) моноклонални антитела са закупени от Santa Cruz Biotechnology Inc. (Санта Круз, Калифорния, САЩ). Конюгирана с пероксидаза от хрян анти-мишка (кат. № 315-035-003) и анти-заек (кат. № 111-035-003) са закупени от Jackson ImmunoResearch Laboratories, Inc. (West Grove, PA, USA) . Всички други реактиви са закупени от Sigma-Aldrich (Сейнт Луис, Мисури, САЩ).
Приготвяне на HVC1
HVC1 се състои от кора на P. yedoensis Matsum, R. palmatum L. коренище, C. chinensis Franch. коренище и S. baicalensis Georgi radix. Билките са закупени от Dongwoodang Co., Ltd. (Yeongcheon, Корея). Професор Хо-Йънг Чой от университета Кюнг Хи идентифицира растенията. Образци на ваучери от коренище C. chinensis (CC001), S. baicalensis radix (SB001), коренище R. palmatum (RP001) и кора от P. yedoensis (PY001) са депозирани в Колежа по корейска медицина, Университет Kyung Hee (Сеул, Корея). Всяка билка се използва в съотношение 2: 2: 1: 1 (600: 600: 300: 300 g). Билките се екстрахират с използване на 30% (обем/обем) етанол във вода при 60 ° С за 8 часа. Екстрактите се филтрират през 10-μm хартиена хартия и етанолът се отстранява чрез вакуумно ротационно изпаряване (EYELA; Токио, Япония). Концентратите бяха лиофилизирани и добивът беше изчислен на 13%. Праховете се разтварят в дестилирана вода за експериментите и остатъчният прах се съхранява при -20 ° С.
Експерименти с животни
Анализ на серума
Серумни концентрации на TC, LDL холестерол и HDL холестерол се определят чрез ензимни методи с HDL и LDL/VLDL количествено определяне Колориметричен/Флуорометричен комплект (кат. № K613-100; BioVision, Milpitas, CA, USA).
Хистологичен анализ
Черният дроб и аортата от представителен плъх във всяка група бяха фиксирани в 10% буфериран формалин, вградени в парафин и нарязани на 5-μm участъци. Определени секции бяха оцветени с хематоксилин и еозин (H&E) за хистологично изследване на мастните капчици. Проби от аорта бяха оцветени с маслено червено О, както беше описано по-рано (16). Изображенията са получени с помощта на микроскоп SZX10 (Olympus; Токио, Япония).
Western blot анализ
Чернодробните тъкани се хомогенизират в разтвора за екстракция на протеини PRO-PREP (Intron Biotechnology, Gyeongi-do, Корея) и след това се инкубират в продължение на 25 минути върху лед. Пробите се центрофугират при 16 000 × g (4 ° С) в продължение на 5 минути и супернатантата се прехвърля в нова епруветка от 1,5 ml. Концентрацията на протеин се определя с помощта на реагент за анализ на протеин Bio-Rad, съгласно инструкциите на производителя (Bio-Rad Laboratories, Hercules, CA, USA). Протеиновите проби бяха имуноблотирани върху мембрана от поливинилиден дифлуорид (PVDF) след разделяне върху 10% натриев додецил сулфат (SDS) -полиакриламиден гел. Мембраните бяха блокирани с 5% разтвор на обезмаслено мляко за 1 h и инкубирани за една нощ с първично антитяло (разреждане 1: 1 000). Имуноблотите се промиват 3 пъти с Tween 20/Tris-буфериран физиологичен разтвор (TTBS) и се инкубират със съответното вторично антитяло (1: 2000 разреждане) за 1 h при стайна температура. След измиване 3 пъти с TTBS, имуноблотите бяха разработени с помощта на подобрена хемилуминесценция и рентгенов филм (Amersham Life Science, Бъкингамшир, Великобритания).
Количествена полимеразна верижна реакция с обратна транскрипция (RT-qPCR)
Чернодробните тъкани се хомогенизират и се изолира обща РНК с помощта на реагента Easy-Blue съгласно инструкциите на производителя (Intron Biotechnology). Общата РНК се определя количествено, като се използва система за микрообемни спектрофотометри Epoch (BioTek Instruments, Winooski, VT, USA). Накратко, общата РНК се преобразува в cDNA, като се използва комплект за обратна транскрипция на cDNA с висок капацитет (Applied Biosystems, Foster City, CA, USA) и термоциклер (Gene Amp PCR система 9700; Applied Biosystems) със следната програма: Иницииране за 10 минути при 25 ° С, последвано от инкубация при 50 ° С за 90 минути и при 85 ° С за 5 минути. Анализът на qPCR беше извършен с помощта на PCR система в реално време Step One Plus (софтуер StepOne версия 2.3; Applied Biosystems). SYBR Green master mix и праймери бяха използвани за PCR анализ на глицералдехид-3-фосфат дехидрогеназа (GAPDH), активиран от пероксизома пролифератор рецептор-y (PPAR-y), HMG-CoA R и липопротеинов рецептор с ниска плътност (LDLR). Параметрите на PCR циклиране са както следва: 10 минути при 95 ° C; 40 цикъла от 5 секунди при 95 ° C и 45 секунди при 60 ° C; и крайна крива на топене от 15 секунди при 95 ° С, 1 минута при 60 ° С и 15 секунди при 95 ° С. Всички последователности на грундове са показани в Таблица I. Експресията на гена се изчислява съгласно метода Cq.
Таблица I
| PPAR-γ | 5′-ATCGAGTGCCGAGTCTGTGG-3 ′ | 5′-GCAAGGCACTTCTGAAACCG-3 ′ |
| HMG-CoA R | 5′-TGTTGGAGTGGCAGGACCTC-3 ′ | 5′-GGCACCTCCACCAAGACTGA-3 ′ |
| LDL рецептор | 5′-CTCACTTCCGCTGCAACTCC-3 ′ | 5′-CCACAGTGGAACTCGAGGGA-3 ′ |
| GAPDH | 5′-TGATTCTACCCACGGCAAGT-3 ′ | 5′-AGCATCACCCCATTTGATGT-3 ′ |
PPAR-γ HMG-CoA R LDL рецептор PPAR-γ, активиран от пероксизомен пролифератор рецептор-γ; HMG-CoA R, 3-хидрокси-3-метилглутарил-КоА редуктаза; LDLR, липопротеинов рецептор с ниска плътност; AMPK, AMP-активирана протеин киназа; р-, фосфорилиран.
Анализ на високоефективна течна хроматография (HPLC) на HVC1
Статистически анализ
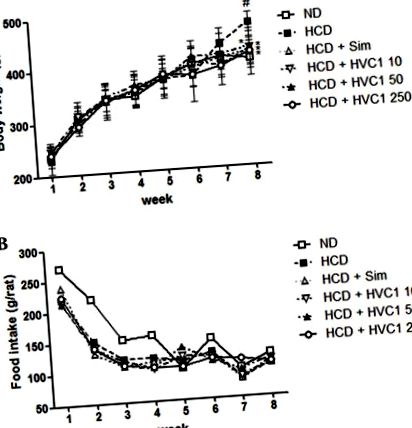
Всички стойности са изразени като средна стойност ± стандартна грешка на средната стойност. Данните бяха анализирани с помощта на еднопосочен дисперсионен анализ с теста на Dunnett. Статистическият анализ беше извършен с помощта на GraphPad Prism (версия 5; Graphpad Software Inc., La Jolla, CA, USA). P Фиг. 1. Групата с HCD е спечелила средно 202,5 g, докато групите, третирани с HVC1 (10, 50 или 250 mg/kg), са спечелили само 160,2, 176,6 или 172,2 g, съответно, след 8 седмици (фиг. 1А). По време на експерименталния период не е имало значителни разлики в приема на храна и вода в групата с HCD в сравнение с другите лечебни групи (Фиг. 1В).
Ефекти на HVC1 върху телесното тегло и приема на храна при плъхове. (A) Телесното тегло и (B) приема на храна се записват ежеседмично. Стойностите са представени като средна стойност ± стандартна грешка на средната стойност (n = 6). # P * P Фиг. 2A и B). Серумното ниво на TC в групата с HCD е 443,3 ± 67,7 mg/dl, а 10, 50 и 250 mg/kg HVC1 намаляват нивата на TC до 255,0 ± 41,6, 218,0 ± 34,6 и 170,3 ± 21,0 mg/dl, съответно (Фиг. 2А). Серумното ниво на LDL холестерол в групата с HCD е 124,3 ± 23,7 mg/dl и 10, 50 и 250 mg/kg HVC1 намаляват нивата на LDL съответно до 80,7 ± 11,6, 67,0 ± 6,9 и 49,7 ± 11,0 mg/dl (фиг. 2Б). Имаше дозозависим отговор с HVC1 за нивата на ТС и LDL холестерол; HVC1 проявява по-голям ефект от този на симвастатин. В допълнение, приложението на HVC1 (250 mg/kg) също значително обърна индуцираното от HCD намаляване на серумните нива на HDL холестерол (фиг. 1С). Серумните нива на HDL холестерол в HCD групата и HVC1 групата (250 mg/kg) са съответно 14,7 ± 3,1 и 24,7 ± 2,9 mg/dl (фиг. 2С). Въз основа на тези данни, HVC1 по-ефективно инхибира индуцираните от HCD промени в нивата на серумния холестерол, отколкото хиполипидемичното лекарство, симвастатин.
Ефекти на HVC1 върху серумния холестерол при плъхове, хранени с високо съдържание на холестерол. Серумните концентрации на TC, LDL-холестерол и HDL-холестерол се определят чрез ензимни методи. (A) Серумно ниво на TC. (B) Серумно ниво на LDL-холестерол. (C) Серумно ниво на HDL-холестерол. ND, нормална диетична група; HCD, диетична група с висок холестерол; Sim, симвастатин (10 mg/kg), третиран с HCD група; HVC1, HVC1, третирани с HCD група. Стойностите са представени като средна стойност ± стандартна грешка на средната стойност (n = 6). # P ** P *** P Фиг. 3 резултатите от H&E оцветяване на чернодробни тъкани показват, че в групата на HCD липидните капчици се появяват като малки вакуоли в чернодробните клетки. Увеличаването на липидните капчици е по-силно изразено в чернодробната тъкан на плъхове от групата на HCD, отколкото групата HVC1 (250 mg/kg). В допълнение, натрупването на липиди в аортата е по-видимо в HCD групата, отколкото в групите, третирани с HVC1 (Фиг. 4). По този начин резултатите за всяка представителна тъкан ясно показват, че натрупването на липиди в черния дроб и аортата е по-високо в HCD групата, отколкото в HVC1 групата (250 mg/kg).
Ефекти на HVC1 върху натрупването на липиди в черния дроб. Черният дроб от представителния плъх във всяка група беше фиксиран, вграден в парафин и оцветен с хематоксилин и еозин. Изображенията се правят при първоначалното увеличение × 100. Мащабна лента, 100 мм. ND, група с нормална диета; HCD, диетична група с висок холестерол; Sim, Simvastatin (10 mg/kg), лекувани с HCD група; HVC1, HVC1, третирани с HCD група.
Ефекти на HVC1 върху натрупването на липиди в аортата. Аортата от представителен плъх във всяка група беше фиксирана, вградена в парафин и оцветена с Маслено червено О. Изображенията са направени при първоначалното увеличение × 100. ND, група с нормална диета; HCD, диетична група с висок холестерол; HVC1, HVC1, третирани с HCD група.
Ефекти на HVC1 върху mRNA експресията на чернодробни PPAR-γ, HMG-CoA R и LDLR
За да се изследват ефектите на HVC1 върху експресията на иРНК на чернодробни PPAR-γ, HMG-CoA R и LDLR, беше извършен RT-qPCR. Както е показано на фиг. 5А и В, експресията на иРНК на PPAR-γ и HMG-CoA R е увеличена в HCD групата в сравнение с групата ND и приложението на HVC1 значително и дозозависимо потиска експресията на иРНК на PPAR- γ и HMG-CoA R. В допълнение, приложението на HVC1 (250 mg/kg) значително обърна индуцираното от HCD намаляване на експресията на LDLR иРНК (Фиг. 5С). Забележително е, че HVC1 има по-мощен ефект от симвастатин.
Стандартен анализ на материала
За стандартизация беше извършен HPLC анализ. Времето на задържане на пробната смес беше, както следва: 3,49 мин за сенозид А и сенозид В, 4,98 мин за генистеин-7-глюкоза, 9,61 мин за коптизин, 13,78 мин за байкалин, 17,18 мин за прунетин-5-глюкоза, 21,22 мин за берберин, 59,76 мин за байкалейн, 72,53 мин за вогонин, 74,12 мин за прунетин (фиг. 6А и Б).
HPLC хроматограма на HVC1. (А) HPLC хроматограма на стандартни смеси HVC1. (B) HPLC хроматограма на HVC1. SA, сенозид А; SB, сенозид В; G7g, генистеин-7-глюкоза; P5g, прунетин-5-глюкоза.
Дискусия
В настоящото проучване бяха изследвани хиполипидемичните ефекти на HVC1 срещу HCD-индуцирана хиперлипидемия при плъхове. HVC1 значително намалява серумните нива на липидите и инхибира експресията на PPAR-γ, HMG-CoA R и LDLR.
Повишените серумни концентрации на LDL холестерол и триглицериди са атерогенни и са признати като рисков фактор за сърдечно-съдови заболявания (18). Повишеното ниво на HDL се счита за кардиопротективно. В това проучване HVC1 намалява TC и LDL и увеличава HDL в серума на плъхове, хранени с HCD. По същия начин, натрупването на липиди в аортата е по-слабо видимо в групите, лекувани с HVC1, отколкото в групата на HCD. HVC1 се състои от коренище R. palmatum, кора на P. yedoensis, коренище на C. chinensis и S. baicalensis radix, за които е известно, че повлияват положително липидния метаболизъм. Според настоящото проучване, тези четири билки или активни съединения могат да бъдат свързани с мощния ефект на HVC1.
Като цяло черният дроб се счита за основен орган в липидния метаболизъм. Както е показано на фиг. 3, HCD индуцира липидно натрупване в чернодробната тъкан, но лечението с HVC1 потиска съдържанието на липидни капки в чернодробната тъкан. Чернодробният липиден метаболизъм е силно координиран процес, при който множество пътища се регулират чрез транскрипция (19). PPAR-γ е ядрен рецептор и лиганд-активиран транскрипционен фактор, който участва в експресията на липогенни ензими, като ацетил КоА карбоксилаза и синтетаза на мастни киселини (20). HMG-CoA R е трансмембранен протеин, който участва в синтеза на липиди. Това е ограничаващата скоростта стъпка в синтеза на холестерол и представлява основната цел за лекарствата за понижаване на холестерола, статини (21). Инхибирането на HMG-CoA R индуцира експресията на LDLR в черния дроб (22). LDLR е рецептор на клетъчна повърхност, който увеличава катаболизма на LDL в плазмата и понижава плазмената концентрация на холестерол. LDL-холестеролът се свързва с LDLR, се интернализира в процес, известен като ендоцитоза, и предотвратява дифузията на LDL около мембранната повърхност (23). Ендоцитозата се среща предимно в черния дроб, който премахва
70% от LDL от циркулацията (24). В това проучване, mRNA експресията на PPAR-γ, HMG-CoA R и LDLR са били значително и зависими от дозата възстановени от HVC1. Тези резултати показват, че HVC1 може да намали серумните нива на липидите и натрупването на мазнини в черния дроб и аортата чрез регулиране на генната експресия.
AMPK е добре известен регулатор на липидния метаболизъм в черния дроб и също така участва в хомеостазата на клетъчната енергия (19). Известно е, че AMPK се регулира чрез фосфорилиране и инактивира HMG-CoA R, ключов ензим в синтеза на холестерол в черния дроб (25). За да се изследва възможен механизъм за хиполипидемичните ефекти на HVC1, бяха изследвани фосфорилирането и общото ниво на протеин на AMPK. HVC1 значително обърна намаляването на AMPK фосфорилирането, както и намаляването на общите нива на AMPK протеин. Тези данни показват, че HVC1 може да регулира AMPK на транскрипционно или транслационно ниво. Следователно може да е възможно HVC1 да упражнява своите хиполипидемични ефекти чрез регулирането на AMPK.
В заключение, HVC1 ефективно потиска серумните нива на липидите и натрупването на мазнини в черния дроб и аортата на плъхове с HCD-индуцирана хиперлипидемия. Механизмите, залегнали в основата на хиполипидемичния ефект на HVC1, изглежда включват възстановяване на експресията на PPAR-γ, HMG-CoA R и LDLR чрез индуциране на AMPK. Констатациите ясно показват, че HVC1 има мощен хиполипидемичен ефект и предлага HVC1 да бъде оценен като потенциално лечение за хиперлипидемия.
Благодарности
Това проучване беше подкрепено с безвъзмездна финансова помощ от Корейския проект за научноизследователска и развойна дейност в областта на здравните технологии, Министерство на здравеопазването и благосъстоянието, Република Корея (грант № B110081).
- Модел на животни с високо съдържание на мазнини на свързано с възрастта затлъстяване и остеопороза - PubMed
- Дългосрочни ефекти на кетогенната диета при затлъстели лица с високо ниво на холестерол - PubMed
- Лупусната патогенеза и автоимунитетът се влошават от затлъстяването, предизвикано от диета с високо съдържание на мазнини при мишки.
- Здравословен избор ли е скаридите, ако имам висок холестерол; HealthyDiningFinder
- Център за висок холестерол за млади жени; s Здраве