Institut für Biologie, Zoologie - Molekulare Ökologie, Martin-Luther-Universität Halle-Wittenberg, Halle (Saale), Германия
Departamentul de Apiculturǎ и Sericiculturǎ, Facultatea de Zootehnie şi Biotehnologii, Universitatea de Ştiinţe Agricole и Medicinş Veterinarǎ, Клуж-Напока, Румъния
Institut für Biologie, Zoologie - Molekulare Ökologie, Martin-Luther-Universität Halle-Wittenberg, Halle (Saale), Германия
Institut für Biologie, Zoologie - Molekulare Ökologie, Martin-Luther-Universität Halle-Wittenberg, Halle (Saale), Германия
Кореспонденция
Anja Buttstedt; Institut für Biologie - Molekulare Ökologie, Martin-Luther-Universität Halle-Wittenberg, Halle (Saale), Германия.
Institut für Biologie, Zoologie - Molekulare Ökologie, Martin-Luther-Universität Halle-Wittenberg, Halle (Saale), Германия
Departamentul de Apiculturǎ и Sericiculturǎ, Facultatea de Zootehnie şi Biotehnologii, Universitatea de Ştiinţe Agricole и Medicinş Veterinarǎ, Клуж-Напока, Румъния
Institut für Biologie, Zoologie - Molekulare Ökologie, Martin-Luther-Universität Halle-Wittenberg, Halle (Saale), Германия
Institut für Biologie, Zoologie - Molekulare Ökologie, Martin-Luther-Universität Halle-Wittenberg, Halle (Saale), Германия
Кореспонденция
Anja Buttstedt; Institut für Biologie - Molekulare Ökologie, Martin-Luther-Universität Halle-Wittenberg, Halle (Saale), Германия.
Резюме
Пчелни колонии (Apis mellifera) служат като привлекателни гостоприемници за различни патогени, осигуряващи оптимални температури, влажност и изобилие от храна. По този начин медоносните пчели трябва да се справят с патогени през целия си живот и дори като ларви те са засегнати от тежки болести по разплода като Европейската гнила кръв, причинени от Melissococcus plutonius. Съответно е силно адаптивно, че желето от ларви съдържа антибиотични съединения. Въпреки това, въпреки че хранителните желе се консумират предимно от пчелни ларви, проучванията, изследващи антибиотичните ефекти на това желе, са концентрирани до голяма степен върху бактериалните човешки заболявания. В това проучване ние показваме, че пчелното млечице, хранено с ларви на маточници и добавено към желето от ларви на търтеи и работници, инхибира не само растежа на европейските бактерии, свързани с Foulbrood, но и неговия причинител М. плутоний. Доказано е, че този ефект се причинява от основния протеин (основен протеин от пчелно млечице 1) от пчелното млечице.
1. Въведение
Възрастни медоносни пчели (Apis mellifera) хранят растящите си ларви в кошера с различни желе, в зависимост от пола, кастата и възрастта. Кралските ларви получават само пчелно млечице (RJ), секрет на хипофарингеалната и долночелюстната жлеза на младите пчели работнички, съдържащ всички хранителни вещества, необходими за развитието на царица (Snodgrass, 1925). Ларвите на работниците и търтеите се хранят с RJ, допълнен с мед и прашец, получен от магазините в кошера. Това огромно количество храна, съхранявана при оптимални температури (
30 ° C) и влажност (
60%) за бактериален и гъбичен растеж осигуряват идеални условия за растежа на всички видове патогени. Като се има предвид, че всяка ларва в колонията получава своя дял от пай RJ, може да не е изненадващо, че RJ притежава антибиотични свойства срещу различни бактерии (Fujiwara et al., 1990; Hinglais, Hinglais, Gautherie, & Langlade, 1955; McCleskey & Melampy, 1939), въпреки че по-голямата част от проведените проучвания са свързани с бактерии, причиняващи човешки заболявания. Що се отнася до патогените на пчелите, удивително малко се знае за ефекта на RJ върху специфичните за пчелите патогени, като се има предвид научната и обществената осведоменост за глобалните загуби на колонии (Moritz & Erler, 2016; Potts et al., 2010). Повечето изследвания са ограничени до грам-положителната бактерия Ларви на Paenibacillus отговорен за болестта по пилото American Foulbrood (AFB) (Erler & Moritz, 2016; White, 1906).
Въпреки това, колониите могат да умрат и от европейска гнилостна болест (EFB), друга болест на пилото, свързана с множество различни бактерии (Forsgren, 2010). Въпреки че основният механизъм за EFB е грам-положителният микроаерофилен Melissococcus plutonius (Forsgren, 2010; White, 1912) други бактерии, например, Enterococcus faecalis, Paenibacillus alvei, Brevibacillus laterosporus, Bacillus pumilus, и Achromobacter euridice, е доказано, че се срещат съвместно с EFB като така наречените вторични нашественици (Erler, Denner, Bobiş, Forsgren и Moritz, 2014; Forsgren, 2010). Докато, М. плутоний е несъмнено патогенен и предизвиква EFB, P. alvei, B. pumilus, и А. euridice също са идентифицирани като често срещани бактериални видове на чревната микрофлора на възрастните медоносни пчели (Gilliam, 1997) и Б. латероспорус е открит при ларви, какавиди и фуражи на пчелни пчели, без да е патогенен (Marche, Mura и Ruiu, 2016). Въпреки това, освен съвместната поява с М. плутоний, ролята на вторичните нашественици по време на напредъка на EFB не се разбира.
1 kDa) антимикробни пептиди, получени от С-края на MRJP1, също присъстващи в храната на ларвите (Fontana et al., 2004). Въпреки това, по-голямата част от бактериите, тествани в тези проучвания, не са свързани със заболявания на пчелните пчели и не се знае нищо за антимикробната активност на MRJPs срещу М. плутоний и вторични нашественици на болестта медоносни пчели EFB. Тук докладваме за ефекта на RJ и неговия основен протеин MRJP1 върху М. плутоний и върху бактериални видове, свързани с EFB, които могат да разкрият съответстващи на еволюцията адаптации, вместо да скринират човешки патогени.
2 Материал и методи
2.1 Бактериални щамове и отглеждане
2.2 Анализи за растеж на бактериите
2.3 Проби от пчелно млечице
Проби от пчелно млечице (RJ) са закупени от Naturprodukte Lembcke GbR (Faulenrost, Германия) (RJNP, внос от Китай), Cum Natura GmbH (Bühl, Германия) (RJCUM, внос от Тайланд) и Aspermühle Naturwaren-Niederrhein GmbH (Goch ‐ Asperden, Германия) (RJASP, внос от Китай) и се замразява директно след пристигане при −20 ° C в 2 g аликвотни части. Нито една от пробите не е показала никакво антибиотично замърсяване над границата на откриване (анализи, извършени от Intertek Holding Deutschland GmbH, Leinefelden-Echterdingen, Германия). Тестваните антибиотици са стрептомицин, сулфонамиди и триметоприм за всички проби от RJ, както и тетрациклини, хлорамфеникол, метаболити на нитрофуран, нитроимидазоли, флуорохинолони и макролиди за RJNP и RJCUM.
2.4 Приготвяне и анализ на екстракти от вода/пчелно млечице
За приготвяне на RJ екстракти от вода/среда, 2 g RJ се смесват или с 2 ml двойно дестилирана вода за физикохимичния анализ, или с 2 ml от съответната среда за анализ на бактериалния растеж. Пробите се центрофугират два пъти в продължение на 10 минути при 20 000ж за да се осигури отстраняването на всякакви твърди частици. Съдържанието на глюкоза, фруктоза и захароза се определя чрез HPLC (Sesta, 2006), като се използва течна хроматография от серия Shimadzu VP, оборудвана с дегазатор, помпа, контролер, колонна фурна и автоинжектор (Shimadzu Scientific Instruments, Columbia, USA). Ацетонитрил/вода 75% (v/v) е използван като подвижна фаза за разделяне на захари на колона Alltima Amino 100Å 5 μm (256 × 4.6 mm) при скорост на потока 1,3 ml/min, 30 ° C и е открит с детектор на пречупващ индекс RID ‐ 10A. Съдържанието на 10-HDA се определя съгласно (Liu, Yang, Shi, & Peng, 2008) с течна хроматография от серия Shimadzu VP, детектор с фотодиодни редици и колона LC ‐ 18 (5 μm) (256 × 4,6 mm) с LC ‐ 18 2CM КОМПЛЕКТ предколона. Общото съдържание на протеин беше определено по метода на Bradford (Bradford, 1976) и BSA (говежди серумен албумин) като стандарт за калибрационната крива. Измерванията при 595 nm бяха направени на ултраспектрофотометър Shimadzu.
2.5 Пречистване на MRJP1 от RJ
Водните екстракти RJ съдържат средно 46 mg/ml общо протеини, от които 30% се считат за MRJP1 (Schmitzová et al., 1998) и по този начин екстрактите съдържат около 14 mg MRJP1 на ml. Затова решихме да използваме MRJP1 в първия експеримент при концентрация от 500 μg/ml, приблизително отразяваща концентрацията на протеина в 4% RJ водни екстракти.
2.6 Статистика
Статистически анализи бяха извършени със STATISTICA 8.0 (StatSoft, Tulsa, OK, USA). За да се определи въздействието на контрола на захарта, са сравнени наклоните на кривите на бактериален растеж, като се използва еднопосочен дисперсионен анализ (ANOVA), последван от post hoc тест на Scheffe, ако данните отговарят на критериите за нормално разпределение според Kolmogorov – Smirnov или Kruskal – Wallis ANOVA, ако не се разпространява нормално. Влиянието на трите различни проби RJ върху растежа на E. faecalis, B. pumilus, P. алвей и Б. латероспорус бяха анализирани с помощта на общ линеаризиран модел (GLM) (функция на логаритна връзка и гама разпределение) с трансформирани данни (инхибиране на растежа + 0,06) за елиминиране на отрицателните точки от данни. Ефектът от 500 μg/ml MRJP1 върху EFB бактериите се определя чрез двойно сравнение на наклоните на кривата на растеж със и без MRJP1, използвайки Mann-Whitney U тест (MWU). Експериментите с реакция на доза се анализират с еднопосочен ANOVA, последван от post hoc тест на Scheffe. Данни за B. pumilus, Е. coli, и P. fluorescens обикновено се разпределяха, докато данните, събрани за E. faecalis са трансформирани съгласно следното уравнение f (x) = exp (x).
3 резултата
3.1 Физикохимичен анализ на екстракти от пчелно млечице
Приблизително половината от количествата захари, открити средно в чист RJ, бяха възстановени във водните екстракти с 3,44% глюкоза в сравнение с 6,83%, 2,98% фруктоза в сравнение с 5,85% и 0,45% захароза в сравнение с 1,09%, всички тегловни (Таблица SI ). Екстрактите съдържаха 4,62% общо протеини в сравнение с 11,71% в RJ. 10-HDA на мастната киселина показва само пределна разтворимост във вода (0,23% в сравнение с 1,70% в RJ). Стойностите за търговски проби от RJ са приети от (Pavel et al., 2014).
3.2 Ефект на екстрактите от пчелно млечице върху бактериалния растеж
За да се определи въздействието на RJ върху растежа на различните бактериални щамове, кривите на растежа бяха записани в стандартна среда и допълнени със захарен разтвор или RJ водни екстракти. Контролът на захарта не повлиява растежа на E. faecalis (ANOVA, MS = 0,006, F = 3,842, стр ≥ .080), засили растежа на B. pumilus с най-висока концентрация на захар (Kruskal – Wallis ANOVA, З. = 14,843, стр ≤ .03); и това на Б. латероспорус (ANOVA, MS = 0,001, F = 7,527, стр ≤ .02) и P. alvei при всички измерени концентрации на захар (ANOVA, MS = 0,007, F = 13,292, стр ≤ .02) (Таблица S2). По този начин силният инхибиторен осмотичен ефект на захарта върху бактериалния растеж, открит в меда (Erler et al., 2014), не се прилага при относително ниските концентрации на захар във водните екстракти RJ.
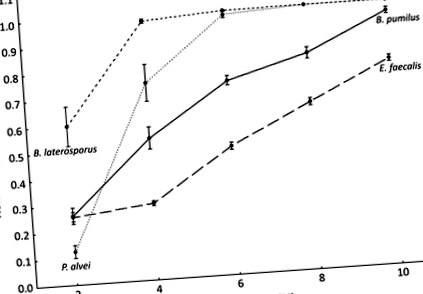
Екстрактите забавиха растежа на четирите свързани с EFB бактерии, като намалява наклона и удължава фазата на изоставане на растежа по зависим от концентрацията начин (Таблица S2). Поради микроаерофилната природа на М. плутоний неговият растеж едва се забелязва при положителната контрола. Добавянето на каквато и да е концентрация на RJ водни екстракти напълно предотвратява растежа на бактерии (Таблица S2). От М. плутоний растеж се наблюдава само при положителната контрола при различни настройки (измервания на OD за 72 часа без разклащане), отколкото при останалите бактерии, той е изключен от статистически анализи на останалите бактерии, използвайки GLM. Инхибирането на растежа по отношение на контрола на захарта се определя въз основа на наклоните на кривата на растеж по време на фазите на лога (фиг. 1). Бактериалните видове, процентът на водния екстракт от RJ и взаимодействието между двете имат огромен ефект върху инхибирането на растежа на бактериите (GLM; бактерии: W = 366,228, df = 3, стр
3.3 Ефект на MRJP1
Добавянето на MRJP1 (500 μg/ml) значително намалява наклоните за всички измерени криви на бактериален растеж (Фиг. 2; MWU, Z ≥ 2.611, стр ≤ .009) с напълно инхибирания растеж за P. alvei, Б. латероспорус, и М. плутоний и инхибиране на растежа в сравнение с положителната контрола от 0,67 ± 0,04 за E. faecalis и 0.69 ± 0.02 за B. pumilus.
За да се види дали ефектът на MRJP1 зависи от концентрацията, са проведени експерименти с серийно разреждане с 500–15 μg MRJP1 на ml среда с бързо нарастващите грам-положителни бактерии E. faecalis и B. pumilus. Освен това бяха проведени експерименти и с грамотрицателните видове Ешерихия коли и Pseudomonas fluorescens. Въпреки че тези бактерии не са свързани с нито едно пчелно заболяване, те хвърлят светлина върху ефекта на MRJP1 върху грам-отрицателните бактерии като цяло. Докато 15 и 30 μg/ml не оказаха ефект, 60 μg/ml значително забавиха растежа на всичките четири тествани бактериални вида (ANOVA, MS = 0,03–0,37, F = 48,86–188,69; Тест на Шефе стр ≤ .012) и 500 μg/ml показват относително инхибиране на растежа между 0.61 (Е. coli) и 0,80 (P. fluorescens) (Фигура 3).
4. Дискусия
Докато е доказано, че медоносният пчелен дефензин засяга само грам-положителни бактерии (Fujiwara et al., 1990), 10-HDA инхибира както грам-отрицателните, така и грам-положителните бактерии, но само при сравнително високи концентрации (минимална инхибиторна концентрация: 0,5–2 mg/ml за грам-положителни; не е определено за грам-отрицателни бактерии) (Blum et al., 1959; Garcia et al., 2013; Yousefi et al., 2012). По този начин относително ниските количества 10-HDA във водните екстракти 2-10% RJ (0,05-0,23 mg 10-HDA/ml) не добавят към антибиотичния ефект в това проучване. MRJP1 започва значително да инхибира растежа на двете бактерии от грам тип при концентрация от 60 μg/ml. Тази концентрация е приблизително 580 пъти по-ниска от концентрацията на MRJP1 в чист RJ, като се има предвид средното съдържание на протеин от 11,71% и MRJP1 от 30% (
35 mg MRJP1/g RJ) (Pavel et al., 2014; Schmitzová et al., 1998).
Нашите резултати обаче контрастират с два други доклада, които не откриват никакъв антибактериален ефект на MRJP1 (Bucekova & Majtan, 2016; Feng et al., 2015). Всъщност Bucekova и Majtan тестваха антибиотичния ефект на MRJP1 до концентрация от 47,5 μg/ml, доста под минималната инхибиторна концентрация от 60 μg/ml, установена в нашите експерименти. За съжаление, Feng et al. (2015) не определят концентрациите на MRJP1. Освен това и двете проучвания отчитат измерванията на крайните точки след инкубация съответно от 18 часа или 24 часа (Bucekova & Majtan, 2016; Feng et al., 2015), като не позволяват да се анализира динамиката на временния растеж във времето. Следвайки кривите на растеж за период от 24/72 часа, ние показваме, че добавянето на до 500 μg/ml MRJP1 наистина забавя растежа на E. faecalis, B. pumilus, Е. coli, и P. fluorescens чрез намаляване на наклоните на кривите на растеж, но не и измерванията на крайната точка. Само онези бактерии, които вече са показали слаб растеж в нормална среда (P. alvei, Б. латероспорус и М. плутоний) не започна да расте в присъствието на 500 μg/ml MRJP1 през измерения период от време.
Brudzynski and Sjaarda (2015) и Brudzynski et al. (2015) установяват антибактериален ефект на MRJP1 с минимални инхибиторни концентрации между 5 и 33 μg/ml, използвайки измервания в крайната точка. При тези проучвания обаче протеините са изолирани от меда чрез афинитетна хроматография на Concanavilin A, която не води до чист MRJP1, а до изолиране на гликозилирани протеини. В действителност, SDS-PA геловете показаха разнообразие от ленти в допълнение към MRJP1 (Brudzynski & Sjaarda, 2015). Затова се съгласяваме с тези автори, че активността на допълнителни протеини в меда може да е допринесла за антимикробните свойства. Например, доказано е, че кратките антимикробни пептиди, получени от С-края на MRJP1 (желеини), действат като антибиотици при ниски концентрации (2,5–30 μg/ml) (Fontana et al., 2004).
Като се има предвид разнообразието от антибактериални вещества в RJ, може да изглежда невъзможно бактериите да могат да провокират заболявания изобщо в присъствието на RJ. RJ обаче не винаги се доставя в равни и със сигурност не винаги в достатъчни количества. В М. плутонийзаразени колонии, повечето ларви умират, когато съотношението на ларвите сестра се увеличава и количеството предоставено желе от храна става недостатъчно за заразени ларви (Bailey, 1983). По този начин инфекцията с EFB може да причини смърт на ларви само ако количеството на полученото хранително желе е необичайно ниско. Както недохранването на ларвите, така и недостатъчното представяне на антибактериалните вещества могат да позволят М. плутоний клетки в средното черво да достигнат критични количества, причиняващи смърт на ларвите.
Благодарности
Благодарим на Силвио Ерлер за предоставяне на щамовете на EFB и за ползотворни дискусии по първата версия на ръкописа. Благодарни сме на Робин М. Крю за езиковата редакция.
Информация за финансиране
Този проект беше подкрепен от Германската изследователска фондация (Deutsche Forschungsgemeinschaft - DFG, грант MO 373/32‐1 на RFAM) и безвъзмездна помощ за програма за обмен ERASMUS + на TVV. Спонсорите нямаха роля в дизайна на проучванията; при събиране, анализ и интерпретация на данни; в написването на доклада и в решението за изпращане на статията за публикуване.
Конфликт на интереси
Моля, обърнете внимание: Издателят не носи отговорност за съдържанието или функционалността на която и да е поддържаща информация, предоставена от авторите. Всички заявки (различни от липсващо съдържание) трябва да бъдат насочени към съответния автор на статията.
- Хранителна чувствителна торбичка за котки - Royal Canin
- Ефект на нискоенергийна и ензимно допълнена диета върху растежа на пилета бройлери, белезите на трупа и
- Оценка на ефекта на отварата от трансфаст върху мишки със затлъстяване, индуцирани от хранителен вестник с високо съдържание на мазнини
- Ефект на диетичния кефир върху ефективността на растежа, използването на фуражите и профила на мастните киселини на
- Ефект на диетичното заместване на рибно брашно с червени водорасли, Gracilaria arcuata, върху ефективността на растежа и