Оливие Пиге
1 Невронаучни изследвания Австралия, Сидни, Австралия
2 Училище по медицински науки, Университет на Нов Южен Уелс, Сидни, Австралия
Аса Петерсен
3 Транслационно невроендокринно изследователско звено, Катедра по експериментална медицинска наука, Lund University, Lund, Швеция
Бони Ин Ка Лам
1 Невронаучни изследвания Австралия, Сидни, Австралия
2 Училище по медицински науки, Университет на Нов Южен Уелс, Сидни, Австралия
Саназ Габери
3 Транслационно невроендокринно изследователско звено, Катедра по експериментална медицинска наука, Lund University, Lund, Швеция
Карън Мърфи
1 Невронаучни изследвания Австралия, Сидни, Австралия
2 Училище по медицински науки, Университет на Нов Южен Уелс, Сидни, Австралия
Джон Р Ходж
1 Невронаучни изследвания Австралия, Сидни, Австралия
2 Училище по медицински науки, Университет на Нов Южен Уелс, Сидни, Австралия
Гленда М Холидей
1 Невронаучни изследвания Австралия, Сидни, Австралия
2 Училище по медицински науки, Университет на Нов Южен Уелс, Сидни, Австралия
Свързани данни
Резюме
Обективен
Поведенчески вариант фронтотемпорална деменция (bvFTD) е прогресивно невродегенеративно мозъчно разстройство, клинично характеризиращо се с промени в познанието, личността и поведението. Често се съобщават и за подчертани нарушения в хранителното поведение, като преяждане и предпочитание към сладки храни. Хипоталамусът играе критична роля в регулирането на храненето, но връзката между патологията в този регион и хранителното поведение при FTD е неизвестна. Това проучване имаше за цел да се справи с този проблем, използвайки 2 допълващи се подхода.
Методи
Първо, 18 пациенти с bvFTD в ранен стадий и 16 здрави контроли са подложени на структурно магнитно резонансно изображение с висока разделителна способност и оценка на хранителното поведение. Обемите на хипоталамуса се проследяват ръчно върху коронални изображения. Второ, бяха извършени анализи след смъртта на 12 bvFTD случая и 6 съвпадащи контроли. Фиксирани срезове на хипоталамусната тъкан се оцветяват за клетъчен маркер и за пептиди, регулиращи поведението на хранене, използвайки имунохистохимия. Извършени са стереологични оценки на обема на хипоталамуса и броя на невроните и глията.
Резултати
И в двата анализа е налице значителна атрофия на хипоталамуса при bvFTD. Пациенти с високо нарушение на храненето показват значителна атрофия на задния хипоталамус. Загубата на неврони, която се наблюдава само при bvFTD случаи с отлагане на протеин-43 на Tar DNA, също е преобладаваща отзад. За разлика от тях, орексин (хипокретин), невропептид Y, кокаин- и амфетамин-регулиращ транскрипт и вазопресин-съдържащи неврони, които регулират апетита, са били пощадени в задните ядра, за които е известно, че участват в регулирането на храненето.
Интерпретация
Дегенерацията и последващата дисрегулация в хипоталамуса са свързани със значително нарушение на храненето при bvFTD. Тези открития предоставят основа за разработването на терапевтични модели. Ann Neurol 2011
Фронтотемпоралната деменция (FTD) е прогресивно невродегенеративно мозъчно разстройство. Това е втората най-честа причина за деменция и е толкова често срещана, колкото болестта на Алцхаймер при лица с млада деменция. 1 Три основни клинични фенотипа на FTD обикновено се разпознават въз основа на клиничната симптоматика при представянето: FTD с поведенчески вариант (bvFTD), семантична деменция и прогресивна нефлуентна афазия. 2 Всяка презентация се характеризира със специфичен модел на мозъчна атрофия, която се концентрира във фронталния и предния темпорален лоб, въпреки че се случва припокриване в цялото представяне с прогресия на заболяването. Невропатологично, повечето случаи на фронтотемпорална лобарна дегенерация (FTLD) показват интрацитоплазматично отлагане на протеин или на свързания с микротубули фосфопротеин tau (FTLD-tau), или на TAR-DNA-свързващия протеин 43 (FTLD-TDP). 3 - 6 Клиничното представяне обаче остава несъвършен предиктор на основната невропатология.
Поведенческият вариант е най-често срещаният фенотип на FTD, представляващ> 50% от всички случаи на FTD. Характеризира се с промени в личното, социалното и междуличностното поведение, ранното емоционално притъпяване и загуба на прозрение. 2 Ненормално хранително поведение (напр. Повишен прием на храна, промени в хранителните предпочитания) 7 присъстват в> 60% от случаите при представяне, но засягат> 80% в хода на заболяването. 8 Наддаването на тегло е често срещано явление, въпреки че пациентите обикновено не стават болезнено затлъстяващи, което предполага промени в регулирането на метаболизма. Биологичните причини за нарушаване на храненето при FTD остават слабо разбрани.
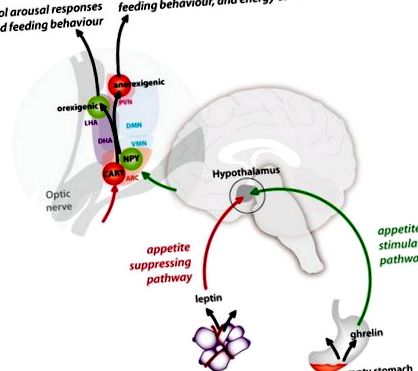
Диаграмно представяне на стимулиращите апетита (зелени) и потискащи апетита (червени) пътища между периферията и хипоталамуса и на техните връзки в ядрата на хипоталамуса. PVN = паравентрикуларно ядро; LHA = странична хипоталамусна област; DMN = дорзомедиално ядро; DHA = дорзална хипоталамусна област; VMN = вентромедиално ядро; NPY = невропептид Y; КАРТА = транскрипт, регулиран от кокаин и амфетамин; ARC = дъгообразно ядро.
Предмети и методи
Кохорти
МАСА 1
Клинични характеристики на кохортите за невроизобразяване и след смъртта (средно ± стандартно отклонение)
Характеристика на хранителното поведение
Промените в хранителното поведение бяха установени с помощта на Кеймбриджския поведенчески инвентар (CBI) 15 в невроизобразителната кохорта. Този въпросник за болногледачи определя присъствието и тежестта (честотата) на редица поведенчески характеристики, използвайки 5-степенна скала, варираща от 0 (никога) до 4 (постоянно). Съставен резултат за смущения в храненето е получен чрез сумиране на резултатите от съответните елементи на CBI.
Анализ на невроизображение и регион на интерес
Всички участници са подложени на структурно ядрено-магнитен резонанс (ЯМР) на мозъка. Беше получена последователност на изображението T1 с висока разделителна способност (размер на воксела: 1 × 1 × 1 mm) за провеждане на морфометрични анализи на хипоталамуса. Събрана е втора последователност (двойни T2 изображения) за измерване на вътречерепния обем, за да се коригират разликите в размера на главата между отделните индивиди (вж. Допълнителна информация за подробности за образната последователност). Хипоталамусът е проследен ръчно върху изображенията Т1 в короналната равнина, използвайки добре дефинирани граници. 16 Предвид своята структурна сложност и функционална специфичност, полученият хипоталамусен обем е разделен на 2 равни обема в предната и задната ос (вж. Допълнителна информация за подробно описание на протокола за проследяване и Допълнителна фигура 1). Първоначалното обучение беше проведено по независим набор от 5 случая. Постигнато е високо ниво на проследяване на възпроизводимостта на обема на хипоталамуса (вътрекласова корелация = 0.964). Предният и задният обем на хипоталамуса са изразени като дял от вътречерепния обем, за да се коригират индивидуалните и половите разлики в размера на мозъка.
Подготвяне на тъкани след смъртта
Нашите предишни проучвания не разкриха асиметрия в клетъчните компоненти на хипоталамуса. 17, 18 Като такива, коронарните тъканни блокове или на левия, или на десния хипоталамус бяха дисектирани за всеки случай за измервания. Липсата на лява/дясна хипоталамусна асиметрия е потвърдена в тази проба за всички обемни измервания и клетъчен брой (всички р стойности> 0,30). Всеки тъканен блок беше криозащитен в разтвор на захароза в продължение на 3 до 5 дни преди серийно секциониране на 50μm върху криостат. Всяка 15-та секция (на разстояние 750 μm) се монтира върху желатинизирани предметни стъкла и се оцветява с 0,5% воден крезил виолетово и 0,1% Luxol бързо синьо за клетъчно количествено определяне и разпознаване на влакнестите пътища. Шест други произволно избрани серии от разрези бяха имунохистохимично оцветени с антитела срещу тау, TDP-43, NPY, орексин, КАРТ и вазопресин (допълнителна таблица).
Регионален и клетъчен анализ
На всеки слайд хипоталамусът беше проследен ръчно, използвайки подобни регионални граници, определени в протокола за невроизображение. Предните и задните области бяха разделени, където паравентрикуларното ядро и форниксът бяха подравнени хоризонтално. Методът на оптичния фракционер е използван за преброяване на неврони с ядрени клетки и глиални клетки в серийните секции с дебелина 50 μm, оцветени по Нисл. 19 Всички измервания са извършени на диапозитиви със слепи кодове.
Статистически анализи
В кохортата за невроизобразяване са изследвани групови разлики между bvFTD и здрави контроли в хипоталамусните обеми, като се използват параметрични независими t проби. В групата на bvFTD връзките между обемите на хипоталамуса и нарушението на храненето бяха изследвани чрез контрастиране на обемите на хипоталамуса при високи и ниски резултати по съставния резултат на хранителното поведение, тъй като разпределението на резултатите беше бимодално. Няма информация за хранене за 1 пациент с bvFTD. В кохортата след смъртта, предвид малкия размер на извадката, груповите разлики бяха тествани, като се използва непараметрична статистика: или тестове на Ман-Уитни за 2 групи, или тест на Крускал-Уолис за 3 групи, последвани от последващи тестове на Ман-Уитни за определяне на разликите между подгрупите.
Резултати
Нарушения на храненето при FTD
Характеристики на хранителни смущения, като повишен апетит, предпочитание към сладки храни и повишена склонност към ядене на едни и същи храни, са налице само в групата на bvFTD и не са наблюдавани при здравите контроли (вж. Таблица Таблица 1). 1). В групата на bvFTD 10 пациенти, които проявяват най-честите и тежки черти, са групирани в група с висока степен на смущения в храненето (дефинирана от средното разделяне). 2-те bvFTD подгрупи не се различават по отношение на разпределението по пол, възраст, продължителност на заболяването или MMSE или ACE-R резултати.
Връзки с хипоталамусните промени In Vivo
Като цяло пациентите с bvFTD са имали по-малки обеми на хипоталамуса от контролите (Фиг. (Фиг. 2), 2), като атрофията е най-изразена отзад (намалена с 15%, p Фиг. 2). 2). Въпреки че разликата в разпределението по пол между пациентите и контролните групи се доближава до значимост, не са открити статистически разлики в ефекта на пола върху обемите на хипоталамуса (всички р стойности> 0,10).
Патологични промени в хипоталамуса при FTLD
Пациентите с FTLD-tau са имали по-необичайно отлагане на протеин в хипоталамуса в сравнение с пациенти с FTLD-TDP. При FTLD-TDP се наблюдават оскъдни TDP-имунореактивни неврити, с случайни интрацитоплазмени включвания в задните хипоталамусни неврони (вложка на фиг. Фиг. 3). 3). При пациенти с FTLD-tau, тау-имунореактивни неврони и неврити са наблюдавани в целия хипоталамус, с редки включвания на тялото на Pick (вж. Вмъкването на фиг. Фиг. 3 3).
Сравненията на задните хипоталамусни области (дорзомедиалните [DM] и страничните хипоталамусни [LH] ядра), участващи в стимулирането на апетита между контролите и случаите на фронтотемпорална лобарна дегенерация (FTLD) с патология на tau или TAR-DNA-свързващ протеин (TDP), разкриват невронална загуба в FTLD-TDP в сравнение с двете контроли и FTLD-tau (ред 1) в оцветени по Нисл участъци (0,5% воден крезил виолетово [CV] и 0,1% Luxol бързо синьо [LFB]). Вложките илюстрират тау (колона 2) и TDP-43 (колона 3) имунопозитивна патология на включване, наблюдавана в тези региони. Оцветяването с имунопероксидаза с транскрипт, регулиращ кокаин и амфетамин (CART, редове 2 и 4) и орексин (редове 3 и 5), не разкрива очевидни разлики в плътността или морфологията на невроните, съдържащи тези невропептиди, между групите в DM (редове 2 и 3) или LH (редове 4 и 5).
Сравнение с промените in vivo и оценка на центровете, участващи в регулирането на храненето
Сравнение на дъгообразното ядро (Arc) между контролите и случаите на фронтотемпорална лобарна дегенерация (FTLD) с патология на tau или TAR-DNA-свързващ протеин (TDP). Оцветяването по Нисл (0,5% воден крезил виолет [CV] и 0,1% Luxol бързо синьо) не разкрива забележими разлики в плътността на невроните в дъгата (ред 1). Оцветяването с имунопероксидаза за транскрипт, регулиращ кокаин и амфетамин (CART, ред 2) в потискащите апетита неврони и невропептид Y (NPY, ред 3) в невроните, стимулиращи апетита, не показва забележима дегенерация на тези неврони в групи. По същия начин няма видими разлики в оцветяването за вазопресин и CART в перивентрикуларното ядро (PVN) между групите.
ТАБЛИЦА 2
Хипоталамусни обеми и невронални и глиални количества при FTLD-TDP, FTLD-Tau и здравословни контроли (средно ± стандартно отклонение)
Дискусия
Предишни структурни невроизобразителни проучвания подчертават, че нарушението в орбитофронтално-островно-стриаталната мозъчна мрежа е в основата на появата на хранителни смущения при FTD. 20 - 22 Изненадващо, хипоталамусът, който играе критична роля в регулирането на храненето и регулира други функции, централни за нашите метаболитни нужди (телесна температура, воден баланс, цикъл на съня), не е замесен. Неуспехът да се открият промени в хипоталамуса в предишни проучвания беше почти сигурно методологичен. Тук използвахме идентификация на региона на интерес с вътречерепна корекция, за разлика от предишни работи, които са използвали морфометрия, базирана на воксел (VBM), автоматизиран метод, който изследва разликите между групите на нивото на отделните воксели. Въпреки че е мощен подход за изследване на ефектите върху целия мозък без априорни хипотези, VBM е податлив на артефакти, особено при популации със значителна корова атрофия, какъвто е случаят с FTD, и е намалил способността си да открива промени в малките мозъчни структури. 23.
Важното е, че наличието на хипоталамусна атрофия при FTD беше потвърдено във втора кохорта, използвайки различна методология. Изследванията на тъканите след смъртта показват, че моделът на атрофия, с по-изразена промяна в задната, отколкото предната хипоталамусна област, е идентичен с този, докладван при ЯМР. Тежестта на атрофията между двете проучвания обаче се различава; атрофията в кохортата след смъртта е била поне два пъти по-голяма от тази, установена в кохортата с ЯМР. В кохортата за невроизобразяване измерванията на хипоталамуса са получени в рамките на 2 години от поставянето на диагнозата, докато измерванията върху постмортната тъкан са проведени след продължителност на заболяването средно от 9 до 10 години. Това откритие предполага, че макар и да е ранна характеристика на заболяването, атрофията на хипоталамуса е продължителен процес в хода на заболяването, вместо да бъде ограничена до началната фаза на заболяването. Интересното е, че мястото на атрофия на хипоталамуса остава относително последователно и фокусирано отзад върху хода на заболяването.
Патологиите на включването, лежащи в основата на клиничното представяне на bvFTD, са променливи и остават трудно предвидими в живота, тъй като клиничните случаи са равномерно разпределени между тау- и TDP-положителни включвания. 24, 25 Нашите следсмъртни анализи обаче показаха, че хипоталамусната атрофия е много по-тежка в случаите с TDP-положителни включвания в сравнение с случаите с тау-положителни включвания. Тази атрофия също е била придружена от значителна невронална загуба само в групата на TDP и е концентрирана в ядра, за които е известно, че регулират хранителното поведение. 26, 27 Допълнителни доказателства за селективни промени в поведението на хипоталамусното хранене при FTLD-TDP, а не при FTLD-tau, идват от скорошно проучване на биомаркери, показващо повишаване на AGRP на цереброспиналната течност само в случаи на FTLD-TDP. 28 Въпреки че информацията за хранителното поведение не е била налична нито в кохортите след смъртта, тези резултати, заедно с констатациите от невроизобразяването, предполагат, че нарушението на храненето при FTD вероятно отразява присъствието на TDP, а не тау патология. Необходими са допълнителни проучвания, за да се потвърдят тези констатации.
Въпреки значителната загуба на задни клетки в хипоталамуса в групата на FTLD-TDP, в ядрата, които регулират поведението на хранене, не е имало очевидна загуба на неврони, съдържащи орексин или CART. Загубата на непептидергичните неврони в тези задни ядра на хипоталамуса може да предполага загуба на вътрешна инхибиторна регулация, водеща до свръхактивност на тези пептидергични пътища и последващи нарушения в храненето при bvFTD. Подобно разрушаване на дорзомедиалното ядро на хипоталамуса във връзка с хиперактивност на орексиновите неврони в LH е предложено в основата на преяждането при разстройство с дефицит на внимание/хиперактивност. 29 Комбинацията от специфична за патологията невронална загуба заедно със запазването на неврони, съдържащи пептиди, участващи в регулирането на храненето, може да има значителни клинични последици, тъй като се разработват целеви терапевтични интервенции.
В заключение, това проучване е първото, което свързва атрофията и патологията в хипоталамуса с нарушения на храненето при bvFTD. Поведенчески, пациентите с високо ниво на хранителни смущения показват значителна атрофия на задния хипоталамус. В комбинация с следкланичните изследвания, нашите открития показват, че това нарушение на храненето е свързано със загуба на неврони в този регион и е по-голямо при пациенти с патология на TDP-43. Неотдавнашно проучване 28 подкрепя виждането, че промените в хипоталамуса изглеждат специфични за FTLD-TDP. Необходими са по-нататъшни проучвания, за да се изясни приносът на други мозъчни региони за нарушаване на храненето при FTLD. Като цяло, настоящото проучване показва, че дегенерацията и последващата дисрегулация в хипоталамуса са свързани със значително нарушение на храненето при bvFTD, осигурявайки основа за разработването на терапевтични модели за тази клинична характеристика.
Потенциален конфликт на интереси
O.P. и J.R.H. имат безвъзмездни средства в очакване от Националния съвет за здравни и медицински изследвания на Австралия.
Благодарности
Този проект е подкрепен от безвъзмездна помощ по проект на Националния съвет за здравни и медицински изследвания (NHMRC) (# 510106). Мозъчните тъкани са получени от мозъчната банка в Сидни, която се подкрепя от NHMRC на Австралия, Университета на Нов Южен Уелс и Neuroscience Research Australia. O.P. се подкрепя от стипендия за награда за клинично развитие на NHMRC (# 510184). G.M.H. е главен старши научен сътрудник на NHMRC (# 630434). J.R.H. се поддържа от стипендия на Федерация на австралийския научен съвет (# FF0776229). ÅP се подпомага от безвъзмездни средства от Шведския изследователски съвет и провинция Скания.
Благодарим на участниците в това проучване, персонала на мозъчната банка в Сидни и д-р J. Kril за събирането и характеризирането на анализираните случаи след смъртта, д-р M. Kuhar за дарението на CART антитялото и H. Cartwright за фигурата работа.
- Деменция, ядеща изобилие от ябълки, плодове и чай, свързани с по-нисък риск
- Ефекти от промените в скоростта на хранене върху затлъстяването при пациенти с диабет вторичен анализ на
- Обяснено екстремно здравословно хранене, Моли Кимбъл, регистриран диетолог Мокси - ум
- Диета, която включва ядене на въглехидрати за рязане на мазнини и избягване краищата на отговорите на звездата
- Диетични тенденции 2017 г. Как популярният план за хранене 801010 влияе на отслабването, кръвната захар