Ана М. Адамо
Катедра по биологична химия, IQUIFIB (UBA-CONICET), Училище по фармация и биохимия, Университет в Буенос Айрес, Хунин 956, C1113AAD Буенос Айрес, Аржентина
Резюме
Въведение
Биологията на миелина датира от 1717 г., когато Leeuwenhoek установява съществуването на нерви, заобиколени от мастни части (Rosenbluth 1999). Два века и половина по-късно е доказано, че такива мастни части принадлежат към тясно специализирана мембрана, т.е. миелин, генериран от зрели олигодендроглиални клетки (OLs) в централната нервна система (ЦНС) и от Schwann клетки в периферната нервна система. Миелинът е много специална мембрана, с уникален молекулен състав и архитектура. Една от основните му функции е да изолира аксони и да натрупва натриеви канали в възли на Ранвие, като по този начин дава възможност за приветливо предаване на потенциала за действие между възлите (Waxman 2006). Развитието на миелина и проводящата нервна проводимост са основата за бърза обработка на информация в относително малко пространство.
Демиелинизацията е патологичен процес, състоящ се в загубата на миелинови обвивки около аксоните. В ЦНС демиелинизацията обикновено е следствие от увреждане на OL и се означава като първична демиелинизация, за разлика от тази, настъпваща като последица от първична аксонална загуба, разглеждана като вторична демиелинизация или дегенерация на Валериан (Franklin and Ffrench-Constant 2008).
Демиелинизиращи заболявания
От клинична гледна точка разстройствата на бялото вещество, включващи миелин, засягат приблизително милион души по света и включват широк спектър от патологии. Две ключови причини за първична демиелинизация са следните: (1) генетични аномалии, засягащи OL (левкодистрофии) и (2) възпалителни увреждания, засягащи миелина и OL.
Генетичните аномалии, засягащи глията, включват наследствени лизозомни заболявания за съхранение, включително метахроматична левкодистрофия и болест на Krabbe; пероксизомни нарушения, включително Х-свързана адренолевкодистрофия; и дефицит или неправилно сгъване на избрани миелинови протеини, включително болестта на Pelizaeus – Merzbacher, наред с други. Множествената склероза (МС) е най-изявената сред възпалителните демиелинизиращи заболявания и за разлика от левкодистрофиите се характеризира с наличие на фокални неврологични лезии. Това обаче е сложно заболяване, чиито клинични характеристики се различават при пациентите.
Клиничната прогресия на множествената склероза е променлива, като обикновено започва с обратими епизоди на неврологично увреждане между третото и четвъртото десетилетие от живота и прогресира до непрекъснато и необратимо неврологично увреждане между шестото и седмото десетилетие (Trapp and Nave 2008). Симптомите на МС са резултат от прекъсване на миелинизирания тракт в ЦНС. Няколко линии мишки, носещи нулеви мутации на миелинов протеин, доказаха, че дегенерацията на аксоните е следствие от хронична демиелинизация (Trapp and Nave 2008). В този контекст ремиелинизацията се определя като процес, чрез който миелиновите обвивки се възстановяват до демиелинизирани аксони, което е свързано с функционално възстановяване (Франклин 2002). Ремиелинизацията е отговор на демиелинизация и е необходима за оцеляването на аксоните. По този начин той трябва да се разглежда като регенеративен процес, подобен на други регенеративни процеси, протичащи в други тъкани. В модели на демиелинизация, базирани на токсични вещества, за разлика от експерименталния автоимунен енцефаломиелит (EAE) или индуцирана от вируса демиелинизация, пълната ремиелинизация се извършва спонтанно, което позволява задълбочено проучване на механизмите, участващи в процесите на демиелинизация/ремиелинизация.
Демиелинизацията несъмнено е част от патологията на МС; през последните години обаче е доказано, че невроналната загуба и аксоналната загуба са следствие от хронична демиелинизация и основната движеща сила за невродегенерацията (Trapp and Nave 2008) при демиелинизиращи нарушения.
Основни механизми в процесите на демиелинизация/ремиелинизация
Модулите, индуцирани от токсини, споменати по-горе, са доказали NG2-позитивно набиране на клетки от SVZ до демиелинизираната зона. Тези клетки се диференцират и стават зрели OLs, последователно експресиращи миелинови протеини като протеолипиден протеин (PLP), основен протеин на миелин (MBP) и 2 ′, 3′-цикличен нуклеотид 3′-фосфодиестераза. Тези открития доказват, че механизмите за ремиелинизация са строго регулирани и включват широк спектър от молекули, включително цитокини (Mason et al. 2001) и хемокини (Patel et al. 2010), транскрипционни фактори (Qi et al. 2001), растежни фактори (Aguirre et al. 2007; Murtie et al. 2005), микро-РНК (Junker et al. 2009) и различни сигнални пътища (John et al. 2002).
Цитокините медиират възпалителния отговор, който насърчава отстраняването на патогена и по този начин предотвратява прекомерното увреждане на тъканите. Прекомерното производство на цитокини обаче може да доведе до изострено възпаление и последваща клетъчна смърт. По-специално в ЦНС някои цитокини играят ключова роля в регенеративните процеси. Туморният фактор на некроза-α (TNFα) чрез TNFα рецепторите R1 и R2 активира клетъчната смърт, от една страна, и преживяемостта, медиирана от NFκB, от друга. Пациентите с МС са склонни да имат по-високи нива на TNFα, както в цереброспиналната течност, така и в серума, отколкото контролните пациенти. На свой ред тези стойности корелират с тежестта на заболяването (Beck et al. 1988; Maimone et al. 1991). Интерлевкин (IL) -1β е друг провъзпалителен цитокин, свързан с физиопатологията на демиелинизиращи заболявания като MS и, подобно на TNFα, е свързан с влошаването на патологията на ЦНС (de Jong et al. 2002).
Хемокините индуцират хемотаксис, който е необходим за привличане на клетките, за да участват в имунния отговор на заразеното или ранено място. Някои хемокини, като CXCL12 и CXCL1, се индуцират по време на развитието на ЦНС и координират разпространението, миграцията и диференциацията на невронни прекурсорни клетки (NPC) (Stumm et al. 2007; Tsai et al. 2002), което предполага, че те също могат да участват в регенеративни процеси на ЦНС. По този начин Patel et al. (2010) демонстрира, че активирането на CXCR4 (рецепторът на CXCL12) е важно за ремиелинизирането на демиелинизираната CPZ мишка чрез индукция на OPC диференциация.
Растежните фактори са биологично активни полипептиди, контролиращи растежа и диференциацията на целевите клетки и са важни по време на процеса на ремиелинизация. По този начин беше демонстрирано, че сигнализирането на рецептора на епидермалния растежен фактор участва както в повторното заселване от OPC, така и в ремиелинизирането на демиелинизацията на corpus callosum, предизвикано от лизолецитин (Aguirre et al. 2007).
Сигналните пътища, които евентуално участват в процеса на ремиелинизация, включват тези, медиирани от богат на левцин повторен и Ig домен, съдържащ NOGO рецептор взаимодействащ протеин 1 (LINGO-1), Wnt, Sonic hedgehog (Shh) и Notch1. LINGO-1 е идентифициран като отрицателен регулатор на диференциацията на OL (Mi et al. 2005). Съобщава се, че лечението на OPC култури с анти-LINGO-1shRNA генерира увеличение на клетъчната морфологична диференциация. От друга страна, мишки с дефицит на LINGO-1 или мишки, лекувани с анти-LINGO-1 антитяло, показват по-голяма ремиелинизация и функционално възстановяване, когато са представени на EAE (Mi et al. 2007). Същите наблюдения бяха направени, когато животните бяха подложени на демиелинизация, предизвикана от токсини (Mi et al. 2009). Що се отнася до сигналния път на Wnt, Fancy et al. (2009) идентифицират свързани с пътя гени, които се индуцират по време на ремиелинизация при мишки, подложени на експериментална демиелинизация. По време на ремиелинизация, Tcf4-медиираното активиране на Wnt отрицателно регулира OPC диференциацията (Fancy et al. 2009; Ye et al. 2009).
По време на развитието на ЦНС секретиращият протеин Shh е необходим за ангажирането на първата вълна на OPCs, произтичащи от вентралната област на гръбначния мозък и предния мозък (Fuccillo et al. 2006). В мозъка на възрастни доставката на Shh предизвиква увеличаване на популацията на OPC в мозъчната кора и мозолистото тяло (Loulier et al. 2006). Неотдавнашни проучвания с използване на индуцирана от лизолецитин демиелинизация на корпус калозум показаха, че Shh сигнализацията се активира по време на ремиелинизация и че медиираната от аденовирус Shh доставка стимулира пролиферацията и зреенето на OPC (Ferent et al. 2013).
В обобщение, ремиелинизацията, настъпила след демиелинизиращи наранявания, е много сложен процес, включващ различни клетъчни популации, регулиран от няколко молекули (напр. Растежни фактори, цитокини) и включващ множество сигнални каскади (напр. Notch сигнализация, Shh сигнализация). Познаването на тези събития значително напредна през последните десетилетия. Много аспекти обаче остават неизвестни, а ремиелинизиращите терапевтични подходи остават ограничени и представляват предизвикателна област на изследване.
Ремиелинизация и стареене
Взети заедно, горните констатации пораждат представата, че свързаната с възрастта неуспешна ремиелинизация може да включва не само фактори, свързани със стареенето на OL и техните присъщи способности, но и редица външни фактори, дори извън ЦНС, които влияят върху капацитета за диференциация на OPC и в крайна сметка въздейства на възстановяването на миелина (Redmond and Chan 2012).
Демиелинизация/ремиелинизация и хранителни вещества
Въпреки че връзката между хранителния прием на мазнини и риска от МС не е ясна, противовъзпалителните ефекти на омега-6 и омега-3 PUFA са добре известни. Както омега-6, така и омега-3 PUFA са конкурентни инхибитори на арахидоновата киселина, чиито метаболити участват в процеса на възпаление (Callegari and Zurier 1991; Gil 2002) и е доказано, че намаляват пролиферацията на Т-клетки (Rossetti et al. 1997). От друга страна, молекулите, получени от PUFAs, могат да имат положителен ефект върху лечението на MS: Липоксините могат да намалят възпалението чрез намаляване на неутрофилната активност (Yacoubian и Serhan 2007), докато резолвините и протектините, получени от омега-3 PUFA, изглежда контролират възпалението в нервната система (Serhan et al. 2002). Важна роля, възложена на PUFA, е тази на лигандите за активираните от пероксизома пролифератор рецептори (PPARs). PPAR са активирани от лиганд ядрени транскрипционни фактори, чиято PPARy изоформа присъства в човешки Т лимфоцити, а омега-3 PUFA, действащи като PPARγ агонисти, подобряват възпалението при плъхове EAE (Niino et al. 2001). Освен това, омега-3 PUFAs бяха демонстрирани да насърчават in vivo експресията на свързани с миелин протеини като PLP и MBP (Salvati et al. 2008).
Като се има предвид значението на целостта на кръвно-мозъчната бариера във физиопатологията на МС, Liuzzi et al. (2007) демонстрират, че in vitro лечението на микроглии с омега-3 PUFAs намалява LPS-индуцираното производство на матрична металопротеиназа-9, която участва в механизма на нарушаване на кръвно-мозъчната бариера, проникването на възпалителни клетки в ЦНС, и, следователно, демиелинизация.
И накрая и най-важното, през последните няколко години са проведени клинични проучвания при пациенти с МС, като резултатите подкрепят положителната роля на диетичните PUFA в прогресията на заболяването.
От друга страна, витамин В12 цианокобаламин също може да има положително влияние върху ремиелинизацията. B12, прилаган едновременно с интерферон-β, благоприятства узряването на OL както in vivo, при неавтоимунни първични демиелинизиращи ND4 (DM20) трансгеники, така и in vitro, в човешката клетъчна линия MO3-13 и в олигодендроцитите на гръбначния мозък на плъх. Тези действия включват намаляване на сигнализирането на Notch1 и увеличаване на експресията на Sonic таралеж и неговия рецептор, Patched, което предизвиква узряване на OL и спомага за подобряване на ремиелинизацията (Mastronardi et al. 2004).
Диетичните полифеноли също могат да смекчат демиелинизацията чрез модулиране на имунния отговор. В тази връзка епигалокатехин-3-галатът, флаван-3-ол, богат на зелен чай, намалява автоимунния отговор в ЕАЕ чрез инхибиране на имунната клетъчна инфилтрация и регулиране на про- и анти-автоимунния CD4 (+) T клетки (Wang et al. 2012).
В обобщение, последните експериментални доказателства сочат, че храненето може да повлияе на развитието на демиелинизиращи/ремиелинизиращи процеси, като смекчава демиелинизацията и благоприятства ремиелинизацията. Като се имат предвид хранителните дисбаланси, свързани със стареенето, по-нататъшният напредък в знанията за това как хранителните вещества въздействат на миелинизацията може да бъде от голямо значение при лечението на демиелинизиращи състояния.
Заключения
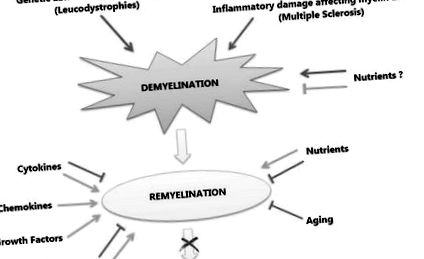
При демиелинизиращите разстройства като цяло и по-специално при МС, неуспехът на бързата ремиелинизация е свързан с аксонално нараняване и дегенерация, което се приема като основна причина за неврологично увреждане на заболяването. Процесът на ремиелинизация рекапитулира миелинизацията по време на развитието, но в патологична среда. В процеса на ремиелинизация участват различни молекули и сигнални пътища, които индуцират или инхибират пролиферацията и узряването на OPCs, ангажирани в генерирането на нови миелинови обвивки около аксоните. По същия начин фактори, които не са свързани с болести, като възраст и генетичен произход, и фактори на околната среда, като хранителни компоненти, могат да действат като фактори за предразположение или да упражняват защитен или дори терапевтичен ефект по време на определени стадии на заболяването, като правят или отрицателни положителни резултати (фиг. 1).
Първичната демиелинизация може да бъде причинена или от генетични аномалии, засягащи OL, или от възпалителни увреждания, засягащи миелина и OL, както е в случая с МС. Докато някои хранителни вещества могат да играят защитна роля срещу демиелинизация (зелена линия), други могат да играят отрицателна роля (червена стрелка). Ремиелинизацията е физиологичният отговор на демиелинизацията. По време на ремиелинизация някои молекули действат положително (зелени стрелки) върху процеса, като хемокини и растежни фактори, докато други могат да играят двойна роля (зелени стрелки за положителни, червени линии за отрицателни), като някои сигнални каскади и цитокини. Сред факторите на околната среда хранителните вещества също могат да играят двойна роля и накрая остаряването има недвусмислено отрицателно въздействие върху процеса. Взаимодействието на тези фактори определя съдбата на процеса на ремиелинизация, чийто неуспех води до невродегенерация
- Хранително управление на стомашно-чревни заболявания и разстройства
- Хранителни фактори, влияещи върху отлагането на мазнини в корема при птиците Преглед
- Изследване Някои възпалителни демиелинизиращи заболявания принадлежат към различна категория от множествените
- Нови перспективи за хранителните фактори, влияещи върху скоростта на растеж на Candida albicans при диабетици
- Хранителни рискови фактори за остеоартрит Анали на ревматичните заболявания