Кореспонденция на: д-р Костас Пантопулос, Институт за медицински изследвания Лейди Дейвис, еврейска болница, 3755 Cote Ste-Catherine Road, Монреал, Квебек H3T 1E2, Канада. [email protected]
Телефон: + 1-514-3408260-5293 Факс: + 1-514-3407502
Резюме
Основен съвет: Хроничният хепатит С е водеща причина за свързаната с черния дроб заболеваемост и смъртност и предразполага към чернодробна фиброза, прекомерното натрупване на извънклетъчни матрични протеини. Поставянето на чернодробна фиброза е от решаващо значение за лечението и прогнозата на пациентите. Този преглед предоставя актуална информация за епидемиологията на вируса на хепатит С (HCV), обобщава основните механизми на зависимата от HCV чернодробна фиброгенеза и обсъжда общи методи за оценка на чернодробната фиброза. Докато чернодробната биопсия доскоро се смяташе за златен стандарт, новите неинвазивни методи, включително серумни биомаркери, преходна еластография и комбинирани алгоритми, постепенно се включват в новите насоки и стават стандарт за грижи.
БРЕМ НА ХРОНИЧЕН ХЕПАТИТ С: ЕКРАНОВАТА ДИЛЕМА
Хроничният хепатит С (СНС) се причинява от инфекция с вируса на хепатит С (HCV) и представлява основна грижа за общественото здраве, засягайки около 200 милиона души по целия свят [1]. Той е водещата причина за хепатоцелуларен карцином (HCC) и основната индикация за чернодробна трансплантация в западните страни. Въпреки че някои данни показват, че HCV не увеличава смъртността от всички причини [2], други проучвания предполагат, че СНС може да намали продължителността на живота с 8 до 12 години [3,4]. По този начин се съобщава, че HCV причинява повече от 86 000 смъртни случая в Европа през 2002 г. [5]. Очаква се смъртността и заболеваемостта, свързани с СНС, да се увеличат драстично през следващите 50 години, като се има предвид, че процентът на новите инфекции с HCV е спаднал значително едва след 1989 г. [6]. Анализът на модела на Марков предполага, че до 2030 г. 30% от смъртните случаи, свързани с усложнения, свързани с HCV, ще бъдат предотвратими чрез увеличаване на 50% от пациентите, получаващи лечение с терапия с интерферон/рибавирин [7]. С развитието на нови анти-HCV агенти, включително NS3/4A, NS5A и NS5B инхибитори, се очакват по-високи нива на успех на лечението, дори при пациенти с цироза или след трансплантация.
Острата инфекция с HCV често не преминава спонтанно. Приблизително 80% от заразените лица стават хронични носители и могат да прогресират до тежко чернодробно заболяване. Въз основа на естествената история на СНС се изчислява, че 10% -20% от пациентите ще развият чернодробна цироза и 1% -5% ще развият HCC в рамките на 20-30 години [8]. След като се установи чернодробна цироза, HCC се развива с 5% -7% годишно [9]. Важно е, че епидемиологичните проучвания показват, че повечето пациенти не знаят за техния положителен статус на HCV антитела [6]. Доклад, поръчан от Института по медицина на Националните академии, подчерта недостатъци в грижите за вирусен хепатит и изчисли, че до 75% от пациентите с СНС остават недиагностицирани [10]. В този смисъл Центровете за контрол и превенция на заболяванията (CDC) изчисляват, че въпреки че хората, родени през 1945-1965 г., съставляват приблизително 27% от населението на Съединените щати, те представляват 75% от всички HCV инфекции, 73% от свързаната с HCV смъртност, и са изложени на по-голям риск от HCC и чернодробни усложнения в краен стадий.
Предвид факта, че ранната диагностика и лечение могат да предотвратят цироза на черния дроб и HCC, се смята, че еднократните тестове на лица, родени през 1945-1965 г. (бейби бумери), ще предотвратят повече от 120000 смъртни случая в САЩ. Въз основа на тези епидемиологични данни и на неотдавнашния напредък в лечението на СНС, CDC сега препоръчва обща скринингова стратегия с еднократно тестване, без предварително установяване на риска от HCV за бебешки бумери [6]. Неотдавнашно проучване показа, че по-широкият скрининг за HCV вероятно ще бъде рентабилен [11]. Независимо от това, значително намаляване на заболеваемостта и смъртността, свързана с HCV, също би изисквало подобряване на честотата на насочване, лечение и проследяване [11]. По този начин, след като пациентите с СНС бъдат разпознати от по-широк скрининг за HCV инфекция, трябва да им се предложи подходяща клинична помощ и терапия. В този смисъл оценката на стадия на чернодробна фиброза е ключовото събитие в клиничното лечение на СНС, което засяга както прогнозата на заболяването, така и показанията за лечение [12].
HCV И ФИБРОГЕНЕЗА НА ЧЪРНИЯТА: ОСНОВНИ КОНЦЕПЦИИ
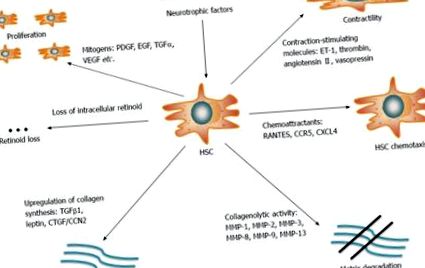
Изясняването на механизмите, залегнали в основата на чернодробната фиброгенеза, е от първостепенно значение за лечението и профилактиката на краен стадий на чернодробно заболяване. Чернодробната фиброза се определя от прекомерното натрупване на протеини на извънклетъчната матрица (ECM) като колаген, ламинин, еластин, фибронектин и др. И понастоящем се разглежда като отговор на зарастване на рани при хронично чернодробно увреждане [13]. HCV инфекцията директно модулира сигналните и метаболитните пътища от вирусни протеини. Освен това, той индиректно индуцира антивирусни имунни отговори на домакина, водещи до хронично възпаление. Заедно тези събития насърчават чернодробната фиброгенеза [14]. Чернодробната звездна клетка (HSC), витамин А (ретиноид) -съхраняваща клетка, пребиваваща в перисинусоидалното пространство на Disse, е ключовият фиброгенетичен елемент. Въпреки че са в покой при липса на възпалителни стимули, HSCs се активират в отговор на увреждане на черния дроб и се подлагат на трансформация в пролиферативни, контрактилни миофибробласти. Активираните HSC представляват преобладаващ източник на производство на ECM [15] и по този начин нарушават равновесието между отлагането и разтварянето на ECM протеини, което води до фиброзни белези и в крайна сметка до цироза на черния дроб (Фигура (Фигура 1 1)).
Чернодробните звездни клетки са клетки, съхраняващи ретиноиди, които играят ключова роля в чернодробната фиброгенеза. По време на чернодробно увреждане те претърпяват трансформация от състояние на покой в пролиферативни, контрактилни миофибробласти. Активираните HSC са основният източник за производство на колаген и други ECM протеини. Няколко молекули и пътища регулират равновесието между отлагане и разграждане на ECM протеини. HSC: Чернодробни звездни клетки; ECM: Извънклетъчен матрикс; PDGF: растежен фактор, получен от тромбоцити; EGF: Епидермален растежен фактор; TGF: Трансформиращ фактор на растеж; VEGF: Съдов ендотелен растежен фактор; CCR5: С-С хемокинов рецептор 5; MMP-2: Матрична металопротеиназа 2.
Разработването на клетъчна култура и животински модели, които рекапитулират основните аспекти на HCV инфекцията и увреждането на черния дроб, е от решаващо значение за разбирането на патогенезата на СНС [16,17]. Това включва пътища, които са замесени в инициирането и продължаването на активирането на HSC. Инициирането на HSC активиране се медиира от паракринни стимули от съседни клетки, реактивни кислородни видове (ROS), липополизахарид (LPS) или апоптотични тела. HSC поддържат своята активност в отговор на фиброгенетично, пролиферативно, хемотаксично и възпалително сигнализиране [14].
Директна HCV-зависима чернодробна фиброгенеза от вирусни протеини
HCV съдържа положително смислена едноверижна РНК, която се транслира до голям полипротеинов предшественик. Последният се подлага на протеолитично разцепване от вирусни и гостоприемни ензими, за да генерира зрели структурни протеини (ядро, Е1, Е2 и р7) и неструктурни протеини (NS2, NS3, NS4A, NS4B, NS5A и NS5B) [18]. Тези молекули могат да се насочат към множество клетъчни типове, включително хепатоцити, моноцити, лимфоцити и различни секреторни клетки [19-21], и по този начин модулират клетъчната пролиферация, апоптоза, оксидативен стрес и вроден имунитет [22].
Експериментални доказателства сочат, че основният протеин на HCV, както и неструктурните HCV протеини могат директно да задействат активирането на HSC и по този начин инициирането на фиброгенеза. Основният протеин активира за предпочитане промитогенни вътреклетъчни пътища в HSC, докато протеините NS3 и NS5 специфично стимулират провъзпалителни пътища чрез NF-κB и JNK [23]. Ядрото и NS3 протеините насърчават повишаване на вътреклетъчните нива на калций [Ca 2+] i и ROS; ефектите на основния протеин зависят от свързването му с рецептора C1q [23]. Индукцията на остеопонтин чрез калциево и ROS сигнализиране допринася за епителния към мезенхимен преход на хепатоцитите [24]. Е2 гликопротеинът на обвивката на HCV е друг потенциален фиброгенетичен фактор. Той насърчава активирането на матричната металопротеиназа 2 (MMP-2) при свързване с CD81 на HSC, което води до разграждане на нормалната ECM в области с висока плътност на HCV и може да доведе до инфилтрация на възпалителни клетки [25].
Трябва също така да се отбележи, че ядрото, NS3 и NS5A протеините индуцират оксидативен стрес в хепатоцитите и моноцитите чрез активиране на NADPH оксидазата [26-28] и репресия на хем оксигеназа 1 (HO-1) [29]. В допълнение, ядрото и NS3 протеините активират възпалителни пътища чрез Toll-подобен рецептор 2 (TLR2) в моноцити, които модулират вродения имунитет [30]. Освен това, проучвания с модели на HCV репликон демонстрират индукция на оксидативен стрес и активиране на трансформиращ растежен фактор β1 (TGFβ1) и други про-фиброзни сигнали в отговор на HCV репликация [31,32].
Индиректна HCV-зависима чернодробна фиброгенеза чрез имунни отговори и други пътища
Имунният отговор на HCV инфекция играе ключова роля за засилване на чернодробната фиброгенеза. Множество фактори на растежа, възпалителни цитокини и хемокини могат да регулират активирането на HSC и тяхната трансформация в миофибробласти [33]. По-специално, имуномодулираната индукция на растежния фактор, получен от тромбоцитите (PDGF) и последващото мобилизиране на вътреклетъчен калций предизвикват митогенни ефекти върху HSC [34,35]. Полученият от клетките на трансфериращия растежен фактор α (TGFα) [36] и индуцираната от жлъчните киселини активиране на рецептора на епидермалния растежен фактор (EGF) [37] насърчават пролиферацията на HSC. Освен това индукцията на съдовия ендотелен растежен фактор (VEGF) допринася за активиране и пролиферация на HSC, както и за чернодробна ангиогенеза, превръщайки тази молекула в ключов елемент от фиброгенния процес [38].
В допълнение към пролиферативните фактори, фиброгенните цитокини, които насърчават производството на ECM, са положително регулирани в контекста на имунния отговор на HCV инфекция. TGFβ1 е най-мощният про-фиброзен цитокин, стимулиращ производството на колаген чрез Smad сигнализация [39,40]. Освен това, допълнителни молекули като фактор за растеж на съединителната тъкан (CTGF/CCN2) [41] и адипокин лептин [42] насърчават чернодробната фиброгенеза чрез TGFβ1 сигнализиране. Фиброгенната активност на лептина е частично медиирана от TGFβ1 и изисква допълнителни стимули, получени от Kupffer клетки [43]. Лептинът също така действа като супресор на активирания от пероксизома пролифератор рецептор γ (PPARγ), антифибротичен ядрен рецептор, способен да отмени активирането на HSC и да запази неговото спокойствие [44].
Хемокините подобряват фиброгенезата чрез хемотаксис на фиброгенните клетки и усилване на възпалителния отговор. HSC произвеждат многобройни рецептори и секретират няколко цитокини [45]; тяхната роля в патофизиологията на фиброгенезата в момента е обект на изследване. Последните данни сочат, че индукцията на C-C хемокинов лиганд 5 (CCL5, известен също като RANTES) чрез NF-κB сигналния път насърчава хемотаксичните и митогенни ефекти върху HSC чрез своя C-C хемокинов рецептор 5 (CCR5) [46]. Освен това, полученият от тромбоцити хемокин (C-X-C мотив) лиганд 9 (CXCL9) проявява анти-фиброзни свойства, които зависят от неговия рецептор CXCR3 [47], докато CXCL4 упражнява про-фиброзна функция [48].
Неврохимичните и невротрофичните фактори също могат да засилят фиброгенетичната функция на HSC. Няколко клетъчни пътища на невроендокринната система се активират в отговор на хронично увреждане на черния дроб. Индуцирането на опиоидна сигнализация от ендогенни опиоиди стимулира пролиферацията на HSC и засилва отлагането на колаген [49]. По подобен начин, активирането на CB1 рецептора от HSC-получени канабиноиди [50], усилването на PDGF сигнализирането в HSC от серотонин [51] и активирането на HSC от тиреоидни хормони [52] насърчават фиброгенетичните пътища.
Директното взаимодействие на HSC с имунните клетки, чрез експресия на адхезионни молекули, води до двупосочна клетъчна стимулация и усилване на фиброзата. Туморният некрозисен фактор α и моноцитният хемоаттрактант протеин 1 (MCP-1), заедно с други провъзпалителни цитокини се секретират от Kupffer клетки в отговор на NF-κB активиране [53]. Това води отново до активиране на HSC и до секреция на фактори, които усилват възпалителния процес и поддържат активността на макрофагите, като стимулационен фактор на макрофагите колония [54], интерлевкин 6 [55], MCP-1 [56] и RANTES [ 46]. В допълнение, HSCs експресират клетъчни адхезионни молекули, включително съдова клетъчна адхезионна молекула 1 [57] и вътреклетъчна адхезионна молекула 1 [58]. Те участват в по-нататъшното набиране на възпалителни клетки в мястото на нараняване, което засилва фиброгенетичния процес. Други видове клетки, замесени в прогресията на фиброзата, включват лимфоцити [59], макрофаги [60] и ендотелни клетки [61]. Макрофагите насърчават оцеляването на активирани HSCs чрез NF-κB-зависими пътища [62]. За разлика от това, естествените клетки-убийци и Т-клетките от заразени с HCV пациенти насърчават апоптозата на HSC и по този начин упражняват анти-фиброзна функция [63].
Не на последно място, оксидативният стрес е ключов компонент на чернодробната фиброза [64]. Апоптотичните паренхимни клетки се фагоцитират от активирани HSC, което води до активиране на NADPH оксидазата [65]. Последният медиира генерирането на ROS, които са способни както да инициират, така и да поддържат фиброза чрез активиране на HSC, хепатоцити, Kupffer клетки и възпалителни клетки [66]. Този процес се засилва допълнително в присъствието на полиненаситени мастни киселини, етанол и желязо. Освен това, ДНК на апоптотичните хепатоцити може да взаимодейства с HSCs TLR9 и по този начин да подобри производството и отлагането на колаген [67].
Лекото до умерено чернодробно претоварване с желязо е често срещана проява на пациенти с СНС. Това до голяма степен се дължи на неправилно регулиране на железорегулаторния хормон хепцидин [68,69], който транскрипционно се инхибира от HCV-индуциран оксидативен стрес [70]. Въпреки че желязото антагонизира репликацията на HCV чрез инактивиране на вирусната полимераза NS5B [71,72], натрупване на чернодробно желязо [73], повишен серумен феритин [74] или намалени нива на серумен хепцидин [75] са свързани с прогресиране на чернодробно заболяване. Протеинът на хемохроматозата HFE, атипична основна молекула от хистосъвместимост от клас I, може също да допринесе за фиброгенезата на черния дроб като регулатор на хепцидин и/или като възможен имунологичен фактор.
ВЪЗДЕЙСТВИЕ НА ФИБРОЗАТА НА ЧЕРНИЯ ЧРЕЗ ВЪРХУ ПРОГНОЗАТА, УПРАВЛЕНИЕТО И СТРАНИГИРАНЕТО
Натрупването на чернодробна фиброза е важен инцидент с големи последици върху развитието на патологията на СНС [78]. Това показва началото на прогресиращо заболяване, което в крайна сметка може да доведе до цироза и краен стадий на чернодробни усложнения [79]. Пациентите с отсъстваща или лека фиброза при поставяне на диагнозата имат относително нисък риск (25% -30%) от развитие на цироза през следващите 20 години. Порталната и преградната фиброза причиняват цироза, макар и с различна степен на прогресия (съответно 18-20 години за пациенти с портална фиброза и 8-10 години за пациенти със септална фиброза) [80]. По този начин, стадият на чернодробна фиброза е критичен за клиничното лечение, особено в светлината на новата скринингова вълна на HCV-инфектирани пациенти [6].
Клиничното лечение на пациенти с СНС зависи от два различни етапа на чернодробна фиброза [81]: (1) значителна фиброза, хистологично класифицирана като септална фиброза (стадий F3 от METAVIR), представлява категорично указание за антивирусно лечение, а не отлагане; и (2) цироза (етап F4 от METAVIR) изисква специфично и редовно проследяване, което трябва да включва скрининг за HCC и варикозни разширения на хранопровода. Освен индикация за антивирусно лечение, по-напредналият стадий на чернодробна фиброза трябва да изисква интервенции за контрол на известни отрицателни кофактори за прогресиране на заболяването (Таблица (Таблица 1). 1). Те включват промени в начина на живот (диета, загуба на тегло, редовни физически упражнения), въздържание от алкохол и наркотици, насочване към специалисти (хепатолог, метаболитни клиники, диетолог, психолог), специфични лекарства (статини, сенсибилизиращи инсулина агенти). По този начин новите стратегии за скрининг, които се отварят за голяма група хора, бебешките бумери, трябва да бъдат свързани с диагностични и терапевтични интервенции за всички новооткрити пациенти.
маса 1
Фактори, допринасящи за прогресията на фиброзата при хроничен хепатит С
- Промени в микробиотата в кръвта при затлъстяване с чернодробна фиброза
- FDA одобрява Zepatier за лечение на хроничен хепатит С генотипове 1 и 4 FDA
- Промени в профилите на микробиотата в кръвта, свързани с чернодробна фиброза при пациенти със затлъстяване Пилот
- Кистозна фиброза Чернодробна болест Райли Детско здраве
- Ефект на Harvoni върху протеинурия и eGFR при хронична бъбречна болест, свързана с вируса на хепатит С