Шелби А. Пауърс
1 Катедра по физиология, Медицинско училище в Броди, Университет в Източна Каролина, Грийнвил, Северна Каролина, САЩ
Теренс Е. Райън
1 Катедра по физиология, Медицинско училище в Броди, Университет в Източна Каролина, Грийнвил, Северна Каролина, САЩ
2 Институт по диабет и затлъстяване в Източна Каролина, Университет в Източна Каролина, Грийнвил, Северна Каролина, САЩ
3 катедра по приложна физиология и кинезиология, Университет на Флорида, Гейнсвил, Флорида, САЩ
Елена С. Пак
1 Катедра по физиология, Медицинско училище в Броди, Университет в Източна Каролина, Грийнвил, Северна Каролина, САЩ
Матю О. Фрейзър
4 Катедра по хирургия, Медицински център на университета Дюк, Дърам, Северна Каролина, САЩ
5 Отдел за изследвания и развитие, Медицински център по въпросите на ветераните в Дърам, Дърам, Северна Каролина, САЩ
Джоузеф М. МакКлунг
1 Катедра по физиология, Медицинско училище в Броди, Университет в Източна Каролина, Грийнвил, Северна Каролина, САЩ
2 Институт по диабет и затлъстяване в Източна Каролина, Университет в Източна Каролина, Грийнвил, Северна Каролина, САЩ
Йохана Л. Ханан
1 Катедра по физиология, Медицинско училище в Броди, Университет в Източна Каролина, Грийнвил, Северна Каролина, САЩ
2 Институт по диабет и затлъстяване в Източна Каролина, Университет в Източна Каролина, Грийнвил, Северна Каролина, САЩ
Резюме
За да се оцени въздействието на хроничната диета с високо съдържание на мазнини (HFD) върху поведенческите модели на изпускане, контрактилитета на детрузора и митохондриалната функция на гладките мускули при мъжки мишки.
Методи:
Мъжки мишки C57BL/6J (6 седмици) са хранени с контролен или HFD в продължение на 20 седмици. Функцията на пикочния мехур се оценява чрез тестове за празно място. Бяха събрани пикочните мехури и беше измерена контрактилитета на детрузора към карбахол (10 -9 -10 -5 M) и стимулиране на електрическото поле (EFS, 0.5-32 Hz) в присъствието и отсъствието на атропин. Хомогенизирани проби от детрузор се поставят в оксиграфи, за да се оцени скоростта на консумация на кислород на митохондриите в детрузора в присъствието на различни субстрати. Излъчването на митохондриален водороден прекис (H2O2) беше измерено флуорометрично. Активността на Detrusor цитрат синтаза беше измерена чрез комплект за ензимна активност и Western blots оцениха съдържанието на протеин в електронната транспортна верига (ETC).
Резултати:
HFD значително повишава телесното тегло, затлъстяването и нивата на кръвната глюкоза. HFD мишките демонстрираха повишена честота на изпразване и повишена EFS-индуцирана свиваемост на детрузора. Няма промени в релаксацията на детрузора или контракцията с холинергични медикаменти. Митохондриалното дишане е намалено с HFD и емисията на H2O2 е увеличена. Относителното количество на митохондриите в детрузора е сходно между групите. Въпреки това, ETC комплексите V и III бяха увеличени след HFD.
Заключения:
Хроничната HFD увеличава затлъстяването, води до по-чести изпражнения и засилени EFS-медиирани детрузорни контракции. Митохондриалното дишане беше намалено и емисията на H2O2 се увеличи след HFD. Необходими са по-нататъшни изследвания, за да се определи дали промените в митохондриалната функция могат да играят роля в развитието на индуцирана от HFD дисфункция на пикочния мехур.
1. Въведение
Над 40% от възрастните в Съединените щати са със затлъстяване. 1 Настоящата лекота и наличност на бързо хранене с високо съдържание на наситени мазнини и заседнал начин на живот движат тази епидемия. Затлъстяването е рисков фактор за сърдечно-съдови заболявания, рак, мастна чернодробна болест и развитие на захарен диабет тип 2 (T2DM). Наднорменото тегло или затлъстяването е независим рисков фактор за уринарна инконтиненция. 2 Всяко увеличаване на индекса на телесна маса (ИТМ) с 5 единици е свързано с 20–70% повишен риск от уринарна инконтиненция. 2 Промените във физиологията на лигавичния слой (lamina propria, уротелиум) или гладкомускулния слой на детрузора, както и промените в инервацията могат да допринесат за дисфункция на пикочния мехур. Симптомите на индуцирана от затлъстяването дисфункция на пикочния мехур варират от свръхактивен пикочен мехур до стрес и/или неотложна инконтиненция. 3 Въпреки че се предполага, че затлъстяването повишава коремното налягане и допринася за инконтиненция, механизмите, лежащи в основата на патологичните промени, водещи до дисфункция на пикочния мехур, остават неизвестни.
Често срещан модел на затлъстяване, използван за изследване на дисфункция на пикочния мехур, са мишките, хранени с диета с високо съдържание на мазнини (HFD). Този модел на мишката е ценен за разбирането на развитието на индуцирана от затлъстяването дисфункция на пикочния мехур. Предишни проучвания установяват, че мъжките мишки, хранени с HFD в продължение на 10–12 седмици, развиват повишено телесно тегло, хиперлипидемия и инсулинова резистентност. 4,5 Освен това анестезираната цистометрия показва повишена честота на изпразване, непукащи контракции и ex vivo контрактилитет на пикочния мехур, докато релаксацията на пикочния мехур е нарушена. 4,5 Повечето от тези проучвания описват цялостната физиология на пикочния мехур в модели на HFD-индуцирано затлъстяване; Малцина обаче са определили какви основни механизми водят до дисфункция на пикочния мехур.
Затлъстяването и HFD често водят до повишен оксидативен стрес и възпаление; както системно, така и в пикочния мехур. Източник на HFD-индуцирано възпаление са свободните радикални реактивни кислородни видове (ROS), произведени от митохондриите, които могат да окисляват както липидите, така и протеините. 7 Митохондриите произвеждат АТФ, който е необходим за изразходването на енергия на пикочния мехур, е от решаващо значение за поддържането на клетъчната хомеостаза и е сигнален модел, участващ в свиването на пикочния мехур. При плъхове, на които е дадена богата на енергия диета с високо съдържание на фруктоза, е очевидно намаленото in vitro свиване на пикочния мехур и са открити подути, дегенериращи митохондрии в гладкомускулните клетки на пикочния мехур. 8 Маркери за митохондриална дисфункция на пикочния мехур са показани при заешки модели на частична обструкция на изхода на пикочния мехур и при HFD модел на плъх; въпреки това, митохондриалната функция и продукцията на ROS, получена от митохондрии, не са измерени при мишки с индуцирана от HFD дисфункция на пикочния мехур. 9,10
След 20 седмици HFD, настоящото проучване оценява поведението на хора при мишки и in vitro контрактилитет на гладката мускулатура на пикочния мехур. Специално се интересуваме от промени във функцията на гладката мускулатура на детрузора на пикочния мехур; следователно, лигавичният слой е отстранен за всички експерименти. Измерва се дитрузорното митохондриално дишане към различни субстрати и емисията на водороден пероксид (H2O2) и количественото изобилие от митохондриални комплекси в електронната транспортна верига. Активността на цитрат синтазата се използва за определяне на митохондриалното съдържание на детрузор. Целта на това проучване е да се изясни дали HFD променя митохондриалното дишане на детрузора в присъствието на различни субстрати, за да доразвие нашето разбиране за патологичните механизми, водещи до развитието на HFD-свързана дисфункция на пикочния мехур при мишки.
2. Материали и методи
2.1. Животни
Всички експерименти са проведени в съответствие с Институционалните указания на Комитета по грижа и употреба на животните в Медицинското училище в Броди за грижи и употреба на животните. Шестседмични мишки C57BL/6J (n = 32, лаборатория Jackson) бяха настанени на 12-часов цикъл светлина/тъмнина със свободен достъп до храна и вода. На мишките беше осигурена или стандартна диета (RMH3000: 14% мазнини, 60% въглехидрати, 26% протеин; Lab Diet, Сейнт Луис, МО, САЩ) или HFD (D12451: 45% мазнини, 35% въглехидрати, 20% протеин; Research Diets, New Brunswick, NJ, USA) за 20 седмици.
2.2. In vivo уринарна функция - анализ на празно място (VSA)
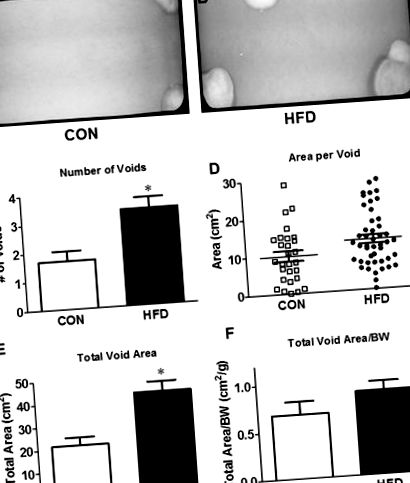
Една седмица преди жертвата всяка мишка беше поставена в стандартна клетка с телено мрежесто дъно върху трипластова филтърна хартия (Fisher Scientific, Pittsburgh, PA, USA). 11 Мишки бяха оставени необезпокоявани, за да изчезнат нормално в продължение на 4 часа (8:00 до 12:00) и филтърните хартии бяха събрани. Пустотните петна се визуализират под ултравиолетова светлина и се снимат (UVP ChemiDoc-ITS3, Upland, Калифорния, САЩ). Отделни кухини бяха преброени и техните площи бяха измерени с помощта на ImageJ (NIH, Bethesda, MD, USA). Ярки петна, по-малки от 0,06 cm 2, бяха елиминирани, за да се вземат предвид „спрей“ на решетката и частици без урина. 12 Измерените параметри на VSA бяха: броят на кухините, общата площ на кухините, средната площ на кухина и площта на първичната (най-голямата) кухина.
2.3. Измерване на физични и метаболитни параметри
След 20 седмици HFD, мишките са гладували цяла нощ и глюкозата в кръвта се измерва от опашната вена с помощта на глюкомер (Free Style Lite, Abbott Diabetes Care, Alameda, CA, USA). Мишките бяха евтаназирани чрез инжектиране на кетамин/ксилазин и торакотомия. Пикочните мехури бяха внимателно отстранени, изцедени от урина и измервани теглото на мокро. Освен това се събират и претеглят висцералните (ретроперитонеални, мезентериални и ингвинални) мастни депа.
2.4. Функционални изследвания на изолиран детрузор
2.5. Митохондриално дишане на пикочния мехур
2 часа тъканна хомогенизация. Консумацията на кислород беше коригирана за митохондриално съдържание, като се използва търговски наличен комплект за анализ на активността на цитрат синтаза (Sigma CS0720) съгласно инструкциите на производителя. Скоростта на митохондриалното дишане (JO2) се изразява като пикомоли на активност на цитрат синтаза.
2.6. Митохондриална емисия на H2O2 от пикочния мехур
Митохондриалната емисия на H2O2 от пикочния мехур се измерва флуорометрично при 37 ° C чрез Amplex Ultra Red (10 μmol/l)/система за откриване на пероксидаза от хрян. 13 Флуоресценцията се наблюдава с помощта на флуоресцентен четец за плочи (BioTek Synergy, Winooski, VT, САЩ). Митохондриалната емисия на H2O2 се оценява в състояние 4 с добавяне на 10 mM сукцинат. За всеки експеримент флуоресценцията на резоруфин се превръща в пикомоли H2O2 чрез стандартна крива H2O2, генерирана при идентични субстратни условия и нормализирана към цитрат синтазна активност.
2.7. Western blot анализ
Общият протеин от мускула на детрузора, отделен от лигавичните слоеве (n = 8/група), се екстрахира с помощта на RIPA буфер (150 mM NaCl, 1% Triton, 0,5% натриев дезоксихолат, 0,1% SDS и 50 mM Tris; рН 7,65) и протеин (20 μg) се зарежда върху 4–12% Bis-Tris SDS-полиакриламиден гел (Thermo Fisher, Waltham, MA, USA). Протеиновата електрофореза се провежда при 160 V (60 минути), протеините се прехвърлят в нитроцелулозна мембрана и се инкубират с общия коктейл от първични антитела OXPHOS (1: 250; ab110413, Abcam) за измерване на всички 5 ETC комплекса. Лентите се откриват чрез хемилуминесценция (Pierce ECL, Thermo Fisher) и се изобразяват с Bio-Rad ChemiDoc Touch (Bio-Rad Laboratories, Hercules, CA, USA). Мембраните бяха отстранени и експресията на ß-актин (1: 500; PA1–183, Thermo Fisher) беше използвана за нормализиране на протеиновата експресия на всеки комплекс. Денситометрията на лентите се анализира с помощта на софтуера ImageJ (NIH).
2.8. Статистически анализ
Данните бяха изразени като средна стойност ± стандартна грешка на средната стойност. Групите бяха сравнени с помощта на двустранен студентски t-тест. Непараметричният тест на Ман-Уитни беше използван за определяне на разликите между броя на кухините между групите. За всички тестове стойностите на P по-малко от 0,05 се считат за статистически значими (Prism 5.0, GraphPad, La Jolla, CA, USA).
3. Резултати
3.1. Хронична HFD повишена висцерална затлъстяване и честота на кухини
Мишките, хранени с 45% kcal HFD в продължение на 20 седмици, са имали значително по-високо телесно тегло и висцерално затлъстяване в сравнение с мишки, хранени с контролна диета (Таблица 1). Глюкозата в кръвта на гладно е била повишена
40% при HFD мишки. Предишно проучване на съавтори извърши тестове за толерантност към глюкоза и инсулин при друга кохорта мишки на 16 седмици и демонстрира непоносимост към глюкоза в цялото тяло и намалена инсулинова чувствителност. 13 Теглото на пикочния мехур не се различава между двете групи, но е значително по-ниско спрямо телесното тегло с HFD. Анализът на празното място показва удвояване на броя на кухините и увеличаване на общата обща площ на кухините при HFD мишки (Фиг. 1C, E). Д). Интересното е, че няма разлика в средната площ на кухина или общата площ на кухината, нормализирана спрямо телесното тегло (Фиг. 1D, F F).
Данните са средни ± SEM.
40% инхибиране в HFD детрузора (Фиг. 2F).
Хроничната диета с високо съдържание на мазнини (HFD) не повлиява индуцираните от калий карбахол съкратителни отговори (A) или релаксация към норепинефрин (NE) в детрузорни ленти (B). Стимулираните от електрическото поле (EFS) съкратителни отговори бяха увеличени при HFD детрузор (C). Инхибирането на мускариновите рецептори с атропин води до по-голямо инхибиране на карбахола в контролния детрузор (D) в сравнение с HFD (E). Процентът на инхибиране при 32 Hz е обобщен в панел F. Данните са средни ± SEM. п = 8/група; * p Фиг. 3А). За разлика от това, при условия на състояние 4 (т.е. ниско енергийно търсене), няма разлика в сложното I- или сложно II-поддържано дишане при HFD детрузори. Комплексно IV поддържано дишане от TMPD в детрузора също беше намалено с HFD. Митохондриалната плътност в детрузора е постоянна при контролните и HFD мишки, както е показано от анализа на активността на цитрат синтазата (Фиг. 3В). Хроничният HFD значително повишава субмаксималната митохондриална емисия на H2O2 от детрузор при условия 4 (фиг. 3C). Интересното е, че докато активността на цитрат синтазата се променя от HFD, протеиновата експресия на комплекси III и V е значително повишена в детрузора от хронично HFD хранени мишки (Фиг. 4).
В допълнение към производството на енергия, митохондриите участват и в поддържането на клетъчната хомеостаза. Те преобразуват гориво в и електрохимичен потенциал, като предават електрони от въглеродни източници към митохондриалната електронно-транспортна система (ETS) и впоследствие използват електрохимичната потенциална енергия за генериране на АТФ в АТФ синтазата. Все пак е добре установено, че ETS може също да изпуска електрони, създавайки ROS, които могат да стимулират развитието на възпаление. Възпалението е широко изследвано при различни заболявания на дисфункция на пикочния мехур. Провъзпалителните цитокини като TNF-алфа и интерлевкин-1β са повишени при HFD-индуцирана дисфункция на пикочния мехур. 15 Демонстрираме, че хроничната HFD води до увеличаване на емисиите на H2O2 от митохондриите на детрузора.
5. Заключения
Хроничната HFD води до повишено затлъстяване, по-голяма честота на уриниране и повишено нервно-медиирано детрузорно свиване с вероятно пуринергичен произход. Освен това митохондриалното дишане на детрузора е намалено и емисиите на H2O2, получени от митохондриите, са високи при HFD. Тези данни предполагат, че промените в митохондриалната биоенергетика могат да играят роля в развитието на индуцирана от HFD дисфункция на пикочния мехур. Необходими са бъдещи проучвания, за да се потвърди причината за митохондриалната дисфункция, водеща до нарушена физиология на пикочния мехур.
Благодарности
Тази работа беше подкрепена от безвъзмездни средства от (NIH)/Национален институт за сърце, белия дроб и кръв (NHLBI) R01-HL-125695 (JMM) и F32-HL-129632 (TER). Допълнително финансиране беше осигурено от Фондове за стартиране на Медицинско училище в Броди (JLH).
- Диета при панкреатит и холецистит Менюта и рецепти за хроничен холецистит и
- Диета за хронично бъбречно заболяване в етапи 1-3 - Здраве на забележителност
- Диета за пациенти с хроничен епидидимит
- Диета при хроничен стомашен катар - хроничен гастрит
- Промяната на диетата ми подобри хроничната ми умора, кандида и хипотиреоидизъм