Резюме
Заден план
Хиперурикемията е основен риск за безалкохолни мастни чернодробни заболявания. Механизмите за това явление обаче не са напълно изяснени. Това проучване има за цел да изследва дали микроРНК медиират патогенните ефекти на пикочната киселина върху безалкохолната мастна чернодробна болест.
Методи
Microarray се използва за определяне на чернодробните профили на експресия на miRNA на мъжки мишки C57BL/6, хранени със стандартна диета с чау, диета с високо съдържание на мазнини (HFD) и HFD, комбинирана с терапия за понижаване на пикочната киселина от алопуринол. Валидирахме експресията на най-значимите диференциално експресирани микроРНК и изследвахме нейната роля и целта надолу по веригата в липидното натрупване на хепатоцити, индуцирана от пикочна киселина.
Резултати
Анализът на микрочиповете и последващото валидиране показват, че miR-149-5p е значително регулиран нагоре в черния дроб на HFD-хранени мишки, докато експресията е регулирана надолу чрез терапия с алопуринол. Експресията на MiR-149-5p също беше значително регулирана в хепатоцитите, стимулирани с пикочна киселина. Свръхекспресията на miR-149-5p значително агрегирано натрупване на триглицериди, предизвикано от пикочна киселина в хепатоцитите, докато инхибирането на miR-149-5p подобрява натрупването на триглицериди. Анализът на доклада за луцифераза потвърждава, че FGF21 е целеви ген на miR-149-5p. Заглушаването на FGF21 премахва мелиоративните ефекти на инхибитора на miR-149-5p върху индуцирана от пикочна киселина липидна акумулация на хепатоцити, докато свръхекспресията на FGF21 предотвратява липидното натрупване, индуцирано от имитации на miR-149-5p.
Заключения
Пикочната киселина значително регулира експресията на miR-149-5p в хепатоцитите и индуцираното натрупване на липиди в хепатоцитите чрез регулиране на оста miR-149-5p/FGF21.
Заден план
Безалкохолната мастна чернодробна болест (NAFLD) е група от чернодробни заболявания, характеризиращи се с прекомерно натрупване на чернодробни липиди без излишен прием на алкохол [1]. Тя варира от проста стеатоза до стеатохепатит, фиброза, цироза и в крайна сметка чернодробен карцином [2]. NAFLD е най-често срещаното хронично чернодробно заболяване в световен мащаб, разпространението на NAFLD в Азия се увеличава и разпространението му в Китай бързо се е повишило до 29,2% през 2019 г. [3, 4]. NAFLD е силно свързана със затлъстяването, захарния диабет тип 2 и сърдечно-съдовите заболявания, което води до сериозни проблеми в областта на общественото здраве в световен мащаб [5,6,7]. Въпреки интензивните изследвания през последните десетилетия, точната патогенеза на NAFLD остава слабо разбрана.
Пикочната киселина е крайният ензимен продукт на пуриновия метаболизъм. По-рано идентифицирахме, че високото ниво на серумна пикочна киселина е основен рисков фактор за NAFLD [8, 9], а пикочната киселина индуцира чернодробно натрупване на липиди чрез активиране на NLRP3 инфламазома [10]. Пикочната киселина може също да индуцира чернодробно натрупване на липиди чрез индуциране на ендоплазмен стрес на ретикулума и митохондриален оксидативен стрес [11, 12]. Въпреки че се появяват все повече изследвания за изследване на механизма, чрез който пикочната киселина индуцира чернодробно натрупване на липиди, основните молекулярни механизми в него все още не са напълно изяснени. По-доброто разбиране на механизмите може да помогне за разработването на нова терапевтична стратегия за NAFLD.
Алопуринолът, прототипният инхибитор на ксантиноксидазата (XO), се счита за крайъгълен камък в клиничното лечение на подагра или хиперурикемия в продължение на няколко десетилетия [20]. В предишното проучване ние също установихме, че понижаването на нивата на серумната пикочна киселина с алопуринол значително облекчава индуцираната от HFD чернодробна стеатоза при мишки [10]. В това проучване имахме за цел да изследваме чернодробните профили на експресия на miRNA на мишки, хранени с HFD, третирани със или без терапия с алопуринол. Установихме, че miR-149-5p участва в ефектите на пикочната киселина върху натрупването на липиди в хепатоцитите чрез регулиране на нейния целеви ген FGF21.
Методи
Животни и лечение
Мъжки мишки C57BL/6, на възраст 8–10 седмици, с тегло 18–20 g, са закупени от медицинската научна институция в провинция Zhejiang (Hangzhou, Китай). Преди експеримента на мишките беше позволено да се аклиматизират за 1-2 седмици достъп до храна и вода. Мишките бяха разделени на случаен принцип в 3 групи, включително по 6 животни на група и хранени със стандартна чау диета (SCD), HFD или HFD, комбинирана с алопуринол (120 mg/L) в питейната вода (HFD + A) в продължение на 8 седмици . HFD (D12492, Research Diets, New Brunswick, NJ) съдържа 60% ккал от мазнини, 20% от въглехидрати и 20% от протеини. Мишките се поддържат в 12-часов цикъл светлина/тъмнина при контролирана стайна температура и им се предоставя свободен достъп до храна и вода.
След интраперитонеално инжектиране на 5% хлоралхидрат, мишките се умъртвяват чрез цервикална дислокация. Черният дроб на всяка мишка се отстранява и претегля. След изплакване със студен PBS, съдържанието на черния дроб се фиксира в неутрален буфериран формалин. Всички експерименти с животни са одобрени от Комитета за грижи и употреба на животните към Първа свързана болница, Медицински колеж, Университет в Жеджианг (Референтен номер: 2019–1096).
Хистологичен анализ
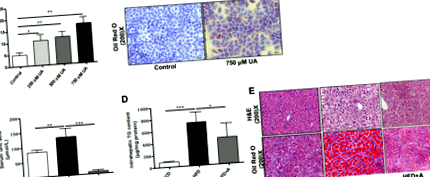
Чернодробните секции бяха фиксирани в неутрален буфериран формалин за една нощ и след това вградени в парафинови блокове. Разрезите бяха изрязани и оцветени за хематоксилин и еозин (H & E). За определяне на чернодробното натрупване на липиди, 8 μm замразени чернодробни секции бяха последователно оцветени с Oil Red O и хематоксилин (Jiancheng Biology, Nanjing, Китай). Клетките, отглеждани в кораби със стъклено покритие в плаки с 12 ямки, се промиват с PBS и се последва от оцветяване с Oil Red O и хематоксилин. Секциите са изобразени с увеличение 200 × (Олимп, Токио, Япония).
Клетъчна култура и лечение с пикочна киселина
Клетъчната линия на мишките хепатоцити (AML-12) и клетъчната линия на човешкия хепатобластом (HepG2) са получени от Китайската академия на науките (Шанхай, Китай). Клетките AML-12 се отглеждат в среда DMEM/F12, допълнена с 10% FBS и 1% пеницилин/стрептомицин, ITS добавка с течна среда и дексаметазон (40 μg/ml). HepG2 клетки се отглеждат в DMEM среда, допълнена с 10% FBS и 1% пеницилин/стрептомицин. Клетките се инкубират при 37 ° С в 5% СО2. За установяване на стимулирани с пикочна киселина клетъчни модели, клетките AML-12 и HepG2 бяха третирани с различни концентрации на пикочна киселина (250, 500 и 750 μmol/L) в продължение на 48 часа.
miRNA масив
Общата РНК беше изолирана и целостта на РНК беше оценена с помощта на Agilent Bioanalyzer 2100 (Agilent Technologies, Санта Клара, Калифорния). Общата РНК се транскрибира в двуверижна cDNA, след това се синтезира в cRNA и се маркира с цианин-3-CTP. Белязаните сРНК първо се хибридизират върху микрочипа, които се сканират от Agilent Scanner G2505C (Agilent Technologies). Масивните изображения бяха анализирани, за да се получат сурови данни чрез софтуер за извличане на функции (версия 10.7.1.1, Agilent Technologies). Genespring (версия 14.8, Agilent Technologies) бяха проведени за основния анализ на суровите данни. Суровите данни бяха нормализирани с квантилния алгоритъм. Прагът, зададен за нагоре и надолу регулирани гени, е кратната промяна ≥1,5.
Трансфекция на клетки
Mmu/hsa-miR-149-5p инхибитор (100 nM), mmu/hsa-miR-149-5p (50 nM) и съответните им отрицателни контроли са закупени от RiboBio (Гуанджоу, Китай). SiRNA олигонуклеотидите и свръхекспресионните плазмиди на миши или човешки FGF21 и съответните им отрицателни контроли също са получени от RiboBio. MiRNAs, siRNAs и плазмидите бяха трансфектирани в хепатоцити чрез използване на Lipofectamine3000 (Invitrogen, Carlsbad, CA) съгласно инструкциите на производителя. След 24 h трансфекция, хепатоцитите бяха изложени на пикочна киселина за допълнителни 48 h.
РНК изолация и PCR в реално време
Общата РНК се приготвя от клетки или замразени черен дроб, използвайки РНК плюс (Takara, Dalian, Китай). Общата РНК от 2,5 μg беше обратно транскрибирана с One Step PrimeScript ™ RT-PCR комплект (Takara). PCR анализът в реално време се извършва с помощта на SYBR Premix-Ex Tag Kit (Takara) върху система за откриване на последователност ABI призма 7500 (Applied Biosystems, Foster City, CA). Последователностите на грунда са изброени в таблица S1.
Western blot анализ
Клетките и чернодробните тъкани се хомогенизират чрез използване на RIPA буфер (Applygen Technologies Inc., Пекин, Китай), допълнен с протеаза и инхибитор на фосфатаза (Pierce Biotechnology, Rockford, IL). Равно количество протеин беше подложено на 12% SDS-PAGE, последвано от трансфер в PVDF мембрани (Millipore, Inc., Дармщат, Германия). Мембраните бяха блокирани с 5% обезмаслено сухо мляко в TBST, последвано от инкубация през нощта със следните първични антитела: анти-FGF21 (Abcam, ab17194, 1: 1000), анти-β-актин (CST, 3700 s, 1: 1000). Болтовете бяха допълнително инкубирани с конюгирани с HRP вторични антитела: козя анти-заешка (Sigma, sc-2004) или козя анти-мишка (Sigma, sc-2005). Протеините се визуализират с ECL плюс (Fudebio, Ханджоу, Китай).
Анализ на триглицеридите
Съдържанието на интрахепатални и вътреклетъчни триглицериди се открива с помощта на търговски комплект (Applygen Technologies Inc., Пекин, Китай) съгласно инструкциите на производителя. Стойностите на триглицеридите се нормализират според общото съдържание на протеин.
Анализ на луцифераза
За да се извърши репортерът на луцифераза, бяха генерирани плазмиди, съдържащи или див тип, или мутирала 3’UTR последователност (Hanyin, Шанхай, Китай). Плазмидите бяха трансфектирани в клетки HEK293T, използвайки Lipofectamine 3000 (Invitrogen, Carlsbad, CA). Клетките също бяха ко-трансфектирани или с отрицателна контрола, или с имитация на miR-149-5p (50 пМ). След 24 часа трансфекция, клетките се събират в съответствие с инструкциите на производителя (Promega Dual Luciferase Assay Kit, Promega). Стойностите на луциферазата на светулка са нормализирани до тези на Renilla луцифераза.
статистически анализи
Статистическите анализи бяха извършени с помощта на SPSS 18.0 за прозорци (SPSS, Чикаго, IL). Статистическите сравнения бяха направени с помощта на т-тест или ANOVA, когато е подходящо. Всички данни бяха изразени като средно ± стандартно разделение (SD), със статистически значима разлика, определена като P
Резултати
Пикочната киселина предизвиква натрупване на липиди в хепатоцитите
Диференциално експресирана miRNA в HFD и HFD + A хранени мишки
Микрочипове са приложени за изследване на ефекта на пикочната киселина върху експресията на чернодробна miRNA при мишки, хранени със SCD, HFD и HFD + A. Установихме, че 47 miRNAs са диференцирано експресирани поне 1,5 пъти между групите HFD и SCD, включително 28 надолу регулирани и 19 регулирани нагоре miRNAs. Освен това 26 miRNAs бяха диференцирано експресирани най-малко 1,5 пъти в HFD + A група в сравнение с HFD групите, включително 5 регулирани надолу и 21 miRNA регулирани нагоре. Първо идентифицирахме, че 12 miRNAs са едновременно диференцирано изразени в HFD срещу SCD и HFD + A срещу HFD (Фиг. 2а, Таблица S2), което показва, че тези 12 miRNAs могат да участват в развитието на високостепенна чернодробна стеатоза и понижаване на подобрената на пикочната киселина чернодробна стеатоза.
PCR в реално време се извършва, за да се потвърди експресията на диференциално експресирани miRNAs. В съответствие с анализа на miRNA масиви, открихме, че експресията на miR-149-5p е регулирана нагоре около 2,5 пъти в черния дроб на HFD-хранени мишки в сравнение с SCD-хранени мишки, докато експресията е регулирана надолу приблизително с 20 % при HFD + A мишки в сравнение с HFD-хранени мишки (Фиг. 2b). Също така установихме, че miR-149-5p се регулира значително нагоре около 1,5 пъти в AML-12 клетки, изложени на 500 μmol/L и 750 μmol/L пикочна киселина в продължение на 48 часа (фиг. 2в). Подобни резултати са наблюдавани в HepG2 клетки (фиг. S2). Тези резултати показват, че miR-149-5p може да бъде свързан с натрупване на липиди от хепатоцити, индуцирана от пикочна киселина.
Ефект на miR-149-5p върху натрупването на липиди в хепатоцитите
За да се провери дали miR-149-5p медиира регулаторните ефекти на пикочната киселина върху натрупването на липиди в хепатоцитите, се анализира загуба или печалба на функция на miR-149-5p върху стимулирани с пикочна киселина хепатоцити. miR-149-5p беше свръхекспресиран в AML-12 клетки чрез трансфекция на имитиращ miR-149-5p (Фиг. 3а). Установихме, че свръхекспресията на miR-149-5p значително агрегира индуцирано от пикочна киселина вътреклетъчно натрупване на триглицериди в AML-12 клетки (Фиг. 3b). От друга страна, инхибирането на експресията на miR-149-5p от инхибитора на miR-149-5p значително подобрява натрупването на триглицериди, индуцирано от пикочна киселина в AML-12 клетки (Фиг. 3в и d). Маслено червено O оцветяването на хепатоцитите потвърждава промененото вътреклетъчно натрупване на липиди (фиг. 3д). Подобни резултати са наблюдавани в стимулирани с пикочна киселина HepG2 клетки, третирани с имитация или инхибитор на miR-149-5p (Фиг. S3). Тези резултати предполагат, че miR-149-5p е участвал в регулаторните ефекти на пикочната киселина върху натрупването на липиди в хепатоцитите.
FGF21 е целеви ген на miR-149-5p, участващ в индуцирана от пикочна киселина хепатоцитна липидна акумулация
Чрез търсене в базата данни за прогнозиране на miRwalk открихме, че FGF21 се предвижда да бъде целеви ген на miR-149-5p. FGF21 е добре известен протеин, който играе ключова роля в липидния метаболизъм [21, 22]. За да се определи дали FGF21 е целеви ген на miR-149-5p, ренила луцифераза репортер плазмиди са конструирани с вмъкване на предвидени места за свързване на miR-149-5p вътре в човешки FGF21 (Фиг. 4а). Ко-трансфекцията на имитация на miR-149-5p доведе до 30% намаляване на активността на луциферазата от FGF21 WT 3’UTR в 293 Т клетки (Фиг. 4b). Мутацията на предвидените места за свързване възстановява загубата на луциферазна активност, медиирана от излишък на miR-149-5p (фиг. 4Ь). Освен това изследваме също дали miR-149-5p регулира ендогенно FGF21. Установихме, че трансфекцията с имитация на miR-149-5p значително потиска нивата на протеин на FGF21 в AML-12 клетки (фиг. 4в). Стимулирането на пикочна киселина също потиска нивата на протеин на FGF21 в клетки AML-12, докато инхибиторът на miR-149-5p възстановява експресията на FGF21 в стимулирани с пикочна киселина хепатоцити (Фиг. 4г). Подобни резултати са наблюдавани и при стимулирани с пикочна киселина HepG2 клетки (фиг. S4a и b). Тези резултати предполагат, че miR-149-5p целенасочено регулира FGF21 чрез инхибиране на транслацията.
Освен това приложихме FGF21 siRNA и свръхекспресионни плазмиди, за да определим ефекта на FGF21 върху натрупването на липиди в хепатоцитите. Установихме, че заглушаването на FGF21 премахва мелиоративния ефект на инхибитора на miR-149-5p върху индуцираното от пикочна киселина натрупване на триглицериди в хепатоцитите (Фиг. 4д). Напротив, свръхекспресията на FGF21 значително предотвратява натрупването на триглицериди, индуцирано от имитация на miR-149-5p в AML-12 клетки (Фиг. 4f). Подобни резултати са наблюдавани в HepG2 клетки, третирани с FGF21 siRNA и свръхекспресионни плазмиди (фиг. S4c и d). Тези резултати предполагат, че FGF21 е мишена надолу по веригата на miR-149-5p и медиира регулаторните ефекти на пикочната киселина върху натрупването на липиди в хепатоцитите.
Дискусия
В това проучване ние предоставяме нови доказателства, че индуцирана от пикочна киселина липадна акумулация на хепатоцити чрез механизъм, зависим от miR-149-5p/FGF21. Първо, стимулирането на пикочна киселина значително регулира експресията на miR-149-5p в хепатоцитите, като същевременно понижава пикочната киселина чрез алопуринол, значително регулира експресията на черния дроб miR-149-5p при мишки, хранени с HFD. Второ, проучванията за загуба или печалба на функция установяват, че miR-149-5p е отговорен за патогенния ефект на пикочната киселина върху натрупването на липиди в хепатоцитите. Трето, потвърдихме, че FGF21 е мишена надолу по веригата на miR-149-5p и FGF21 медиира регулаторните ефекти на пикочната киселина върху липидното натрупване на хепатоцити.
Нашите предишни проучвания показват, че нивата на SUA са значително повишени при пациенти с NAFLD и че повишените нива на SUA са свързани с повишен риск от инцидент на NAFLD [9, 23]. Други големи популационни кохортни проучвания също установяват, че високите нива на SUA са положително свързани с риска от NAFLD [24, 25]. Хистологичните проучвания показват, че нивата на SUA са били значително свързани с тежестта на хистологичното заболяване на NAFLD [26,27,28]. Освен това, терапията за понижаване на пикочната киселина с алопуринол значително облекчава индуцирана от HFD чернодробна стеатоза при животински модел на NAFLD [29]. Тези изследвания предполагат, че високото ниво на пикочна киселина може да е причина за развитието на NAFLD, докато нейният основен молекулярен механизъм остава неясен.
MiRNA е замесена като решаващ регулатор в метаболитните заболявания чрез заглушаване на гени на пост-транскрипционно ниво. Нарастващите доказателства демонстрират, че голям брой miRNAs, като miR-122, miR-378 и miR-34a, участват в патогенезата на NAFLD [30, 31]. Не е ясно обаче дали miRNAs участват в индуцираното от пикочна киселина липидно натрупване на хепатоцити. В това проучване имахме за цел да изследваме чернодробните профили на експресия на miRNA на мишки, хранени с HFD, третирани със или без терапия с алопуринол. В това проучване анализирахме профилите на miRNA, променени в отговор на HFD и HFD, комбинирани с понижаване на терапията с пикочна киселина. Установихме, че 47 miRNAs са диференцирано изразени между HFD и SCD групите, включително 19 miRNA регулирани нагоре и 28 miRNA регулирани надолу. Тази констатация е частично съгласувана с наблюдаваното по-рано при ob/ob мишки [17, 32], MCD-хранени мишки [33] и пациенти с NASH [34]. Нашето проучване потвърди, че miRNAs участват в патогенезата на NFALD.
Освен това, ние също изследвахме механизма надолу по потока на miR-149-5p върху натрупването на липиди в хепатоцитите. FGF21 е член на ендокринното семейство FGF, главно експресиран и секретиран в черния дроб и мастната тъкан. FGF21 е важен регулатор на метаболизма на липидите и глюкозата и играе ключова роля в развитието на NAFLD [39, 40]. Някои клинични проучвания съобщават, че серумното ниво на FGF21 е повишено при пациенти с NAFLD и се счита за предиктор за NAFLD [41]. Последните проучвания обаче съобщават различни резултати, че дефицитът на FGF21 индуцира чернодробна стеатоза [42] и свръхекспресията на FGF21 успява да подобри натрупването на мазнини в черния дроб [43]. В нашето проучване потвърдихме, че FGF21 е мишена надолу по потока на miR-149-5p в процеса на индуцирана от пикочна киселина липидна акумулация на хепатоцити. Нашите резултати предполагат нов механизъм на индуцирана от пикочна киселина липадна хепатоцити.
В това проучване имаше няколко ограничения. Първо, функцията и регулирането на miRNA са сложни, FGF21 може да не е единственият и главният целеви ген, регулиран от пикочната киселина, необходими са допълнителни изследвания, за да се изяснят подробните механизми на miR-149-5p надолу по веригата при индуцирана от пикочна киселина чернодробна стеатоза . Второ, въпреки че резултатите от нашите in vitro клетъчни линии ясно показаха, че пикочната киселина регулира натрупването на хепатоцитни липиди чрез зависим от miR-149-5p/FGF21 механизъм, са необходими експерименти с първични хепатоцити и експерименти in vivo за допълнително потвърждаване на регулаторните механизми.
Заключения
В заключение, нашето проучване представи доказателства за първи път, че пикочната киселина индуцира натрупване на липиди в хепатоцитите чрез механизъм, зависим от miR-149-5p/FGF21.
- Пикочна киселина - общ преглед на ScienceDirect теми
- Пикочна киселина в кръвта Kaiser Permanente
- Теми за здравето на пикочната киселина
- Пикочна киселина, Blood Davis s Lab; Диагностични тестове
- Съвети за подагра и високи нива на пикочна киселина Nestlé Wellness