Нитин Пури
1 Катедра по физиология и фармакология, Университет в Толедо, Медицински колеж, Толедо, OH 43614, САЩ
Евгений Арефиев
2 Медицински отдел, Weill Cornell Medicine/NYP Brooklyn Methodist Hospital, Бруклин, NY 11215, САЩ
Робърт Чао
2 Медицински отдел, Weill Cornell Medicine/NYP Brooklyn Methodist Hospital, Бруклин, NY 11215, САЩ
Дейвид Сасердоти
3 Катедра по клинична и експериментална медицина, Университет в Падуа, Падуа, Италия
Хиба Чадри
4 Катедри по медицина и физиология, Медицински факултет на университета Маршал, Хънтингтън, WV, САЩ
Александра Никълс
4 Катедри по медицина и физиология, Медицински факултет на университета Маршал, Хънтингтън, WV, САЩ
Критика Срикантан
4 Катедри по медицина и физиология, Медицински факултет на университета Маршал, Хънтингтън, WV, САЩ
Атар Наваб
4 Катедри по медицина и физиология, Медицински факултет на университета Маршал, Хънтингтън, WV, САЩ
Дана Шарма
4 Катедри по медицина и физиология, Медицински факултет на университета Маршал, Хънтингтън, WV, САЩ
Вишал Хари Лахани
4 Катедри по медицина и физиология, Медицински факултет на университета Маршал, Хънтингтън, WV, САЩ
Ребека Клуг
4 Катедри по медицина и физиология, Медицински факултет на университета Маршал, Хънтингтън, WV, САЩ
Комал Содхи
4 Катедри по медицина и физиология, Медицински факултет на университета Маршал, Хънтингтън, WV, САЩ
Стивън Дж. Питърсън
2 Медицински отдел, Weill Cornell Medicine/NYP Brooklyn Methodist Hospital, Бруклин, NY 11215, САЩ
Резюме
3.2. Редокс баланс в чернодробните тъкани на слаби и затлъстели мишки, в отсъствието или присъствието на CoPP
3.3. Хомеостаза на желязото при слаби и затлъстели мишки, лекувани със и без CoPP
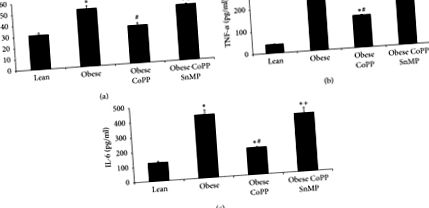
Както е показано на Фигура 3 (а), експресията на чернодробен хепцидин е значително (р Фигура 3 (б)). Намаленият феропортин улеснява клетъчното претоварване с желязо, като по този начин активира транслацията на реагиращите на желязо гени, включително феритин. Въпреки това, контраинтуитивно, нивата на чернодробния феритин са значително по-ниски при затлъстели мишки (p 3 (c) и 3 (d)). Спасено лечение на CoPP (p 3 (a) - 3 (d)).
Ефект на индуцирането на HO-1 върху нивата на хепцидин, феропортин и феритин в черния дроб на слаби и затлъстели мишки. (а) Нива на иРНК на хепцидин, (б) нива на ферропортинов протеин и нива на феритин иРНК и протеини в (в) и (г), съответно. Резултатите са средни ± SEM. n = 3-4, ∗ p # p + p Фигура 4 (а)). Това намаление е блокирано от администрирането на CoPP, докато съвместното администриране на CoPP и SnMP връща нивата им към нетретирания израз на затлъстяването (Фигура 4 (а)). Подобни резултати са наблюдавани при експресията на чернодробен инсулинов рецептор, фосфорилиран при тирозин 1466 и при тирозин 1322 (Фигури 4 (b) и 4 (c)).
Ефект от прилагането на CoPP и SnMP върху нивата на UCP-1 и UCP-2 и Mfn-1 и Mfn-2 в черния дроб на слаби и затлъстели мишки. Представителни петна и свързани графики, изобразяващи денситометричен анализ по отношение на β-актина на (a) UCP-1, (b) UCP-2, (c) Mfn-1 и (d) Mfn-2. Резултатите са средни ± SEM, n = 3-4, ∗ p # p •), реакцията на Фентън. Хидроксилният радикал е един от най-реактивните свободни радикали в биологичните системи и реагира близо до своята дифузионна граница. Той може да причини увреждане на мембраната, фрагментация на ДНК и РНК и липидна пероксидация, като същевременно допринася за редокс дисбаланса [34].
В клетка, пълна с желязо, излишъкът от желязо се изнася от клетката чрез трансмембранен протеин, феропортин. При хронични възпалителни състояния, като затлъстяване, индуциран от хепцидин цитоплазмен рециклиране и лизозомно разграждане на феропортина улавя излишното желязо в клетката [5–7]. Това свободно желязо образува [4Fe-4S] клъстер с железен регулаторен протеин 1 (IRP1), като по този начин го отделя от елементите за реакция на желязото (IRE) [35]. IRP1 контролира транслацията и/или стабилността на няколко иРНК на гени, отговарящи на желязото, чрез свързване с елементи, отговарящи на желязото, в техните нетранслирани области. Феритинът има способността да свързва хиляди железни йони, като по този начин ги предпазва от разтвор. Вътреклетъчното претоварване с желязо, следствие от регулирането на ферропортина, посттранскрипционно активира експресията на феритин, като го освобождава от инхибиторния ефект на IRP1 [36]. Прооксидантните свойства на желязото обаче предразполагат претоварената с желязо клетка към окислително-възстановителен дисбаланс. Този индуциран от желязо оксидативен стрес може да дестабилизира кубанските [4Fe-4S] клъстери [37].
Повишеното регулиране на феритина, успоредно с натрупването на желязо, е от основно значение за поддържането на хомеостазата на желязото. Освен че държи желязото извън разтвора в цитозола, феритинът има и антиоксидантни [38] и противовъзпалителни свойства [39].
Втората ключова констатация, представена в това проучване, очертава ролята на HO-1 за подпомагане в клетъчните нива на феритин. Спасяването на експресията на феритин при мишки, лекувани с CoPP, подчертава ролята на медиирания от HO-1 антиоксидантен ефект при позволяването на регулиране на феритина при претоварване с клетъчно желязо. Антиоксидантните свойства на HO-1 до голяма степен се дължат на генерирането на BV, което намалява оксидативния стрес чрез отслабване на липидната пероксидация. BV-зависимото възстановяване на окислително-редукционната хомеостаза може да компенсира инхибиторния ефект на ROS върху IRP- [4Fe-4S] комплекс, като по този начин позволява разединяването на IRP-1 от и транслацията на феритиновата иРНК. Следователно, този обикновен цикъл на индуциран от желязо оксидативен стрес, потискащ феритина, водещ до повишено количество свободно желязо, което от своя страна подобрява генерирането на ROS, се прекъсва от регулирането на HO-1.
Друга възможност за намалена експресия на феритин може да бъде възпалителната среда на затлъстяването. Вероятно е, че възпалителните цитокини, по все още неизвестен механизъм, могат да нарушат регулирането на феритина. Това може да бъде и взаимодействие на окислително редокс състояние и възпалителната среда. Във всеки случай, предизвиканото от HO спасяване на феритин е доста забележително и може да бъде свързано или с антиоксиданта, или с противовъзпалителния, или с несвързан ефект на HO. Въпреки че CoPP може да е повлиял на други сигнални пътища в клетките, нашите заключения за медиирано от НС феритин се подсилват от факта, че НО-инхибиторът е в състояние да блокира спасяването на феритин при затлъстели мишки, лекувани с CoPP. Друго потенциално ограничение на тези заключения е фактът, че не сме измервали плазмените нива на феритин или трансферин. Малко вероятно е, но е възможно клетъчните нива да се различават от тези в плазмата.
Подобреното генериране на ROS допринася за инсулинова резистентност и нарушаване на регулирането на метаболитните цели надолу по веригата, т.е. AMPK, LKB1 и AKT. Известно е, че P-AMPK действа в регулирането на клетъчното оцеляване, предпазва от оксидативен стрес и, когато се активира, допринася за транспорта на глюкоза, окисляването на мастните киселини и повишената митохондриална функция. LKB1 е серин-треонин киназа, която директно фосфорилира AMPK и подобрява глюкозния толеранс. Чернодробното активиране на AMPK улеснява [40] инсулинозависимото инхибиране на глюконеогенезата. Редокс-зависимото затихване на фосфорилирането на LKB1 [41] предотвратява активирането на AMPK при затлъстели мишки. Липсата на активиране на AMPK увеличава отделянето на чернодробна глюкоза и допринася за хипергликемия, като същевременно повишава инсулиновата резистентност.
Изглежда, че това не се превръща в представянето на NAFLD при хората. Две трети от населението на САЩ са с наднормено тегло или затлъстяване [54]. 30% от населението на САЩ има NAFLD. Серумният феритин е независим предиктор за напреднала фиброза и дори хистологична тежест при NAFLD [55, 56]. Изглежда, че метаболизмът на желязото е променен при NAFLD. Повечето храни съдържат глюкоза и желязо, което води до хипергликемия, диабет и претоварване с желязо [57]. Това претоварване с желязо стимулира секрецията на хепцидин. Не е ясно дали повишената секреция на хепцидин е от възпалението на затлъстяването или възпалителните ефекти на претоварването с желязо, или и двете. Само 20% от тези пациенти имат повишени нива на феритин, което е свързано с напреднала чернодробна фиброза [55].
Ясно е, че резултатите от нашето проучване показват, че метаболизмът на желязото се променя при NAFLD. Неясно е как феритинът преминава от защитна роля в нормалния черен дроб до независим предиктор за напреднала фиброза. Трябва да се свърши повече работа, за да се разкрие дилемата с промените в метаболизма на желязото при NAFLD.
По този начин нашите резултати показват, че хроничното нискостепенно възпаление и оксидативният стрес стимулират чернодробната секреция на хепцидин, която след това отслабва клетъчните нива на феропортин. Тези събития могат да създадат претоварване с желязо в клетката, чиито прооксидантни свойства влошават метаболитния дисбаланс и пречат на регулирането на феритина. Индукцията с HO-1 отслабва чернодробния синтез на хепцидин и възстановява редокс баланса. Следователно, спасяването на експресията на феропортин и феритин противодейства на клетъчното претоварване с желязо и намалява индуцирания от желязо оксидативен стрес. Патофизиологичното въздействие на индуцирането на HO-1 включва подобрена митохондриална енергия и цялостно подобряване на метаболитния профил на мишката. Бъдещите проучвания върху миши модели на безалкохолен мастен черен дроб и неалкохолен стеатохепатит могат да предоставят допълнителни доказателства в подкрепа на ролята на НО-индукцията при лечението на тези метаболитни нарушения.
Благодарности
Тази работа беше подкрепена от Медицинския колеж на Университета в Толедо, Медицинското училище на Университета Маршал и Нюйоркската презвитерианска методическа болница в Бруклин. Всички автори са прочели и са съгласни с ръкописа, както е написан. Авторите благодарят на г-жа Дженифър Браун за нейното редакторско съдействие при подготовката на ръкописа. Авторите благодарят на д-р. Шайлендра П. Сингх и Ларс Белнер за изключителната им помощ.
Разкриване
По-ранна версия на тази работа беше представена като плакат на Съвета на Американската асоциация на сърдечните асоциации по хипертония 2016 Научни сесии и на 29-ия годишен изследователски ден в Университета Маршал, 2017 г.
- Опасни хранителни добавки, свързани с Garcinia cambogia, чернодробна недостатъчност, изискващи трансплантация
- Здравословно отслабване Sanyasi Ayurveda Отслабване Медицина Странични ефекти на хинди 📊 потиска
- Лаборатория за бързо отслабване 🌠 Потиска апетита и осигурява бързо отслабване 🍦 - CREA-RS
- Непрекъснатият прием на воден екстракт от гъба Chaga (Inonotus obliquus) потиска рака
- Електрическата мускулна стимулация действа ли E-Stim