Страници
10.02.2014
Влиянието на кетогенната диета върху метаболизма на кортизола
Един от митовете около кетогенните диети идва от неразбирането на ролята на кортизола - „хормона на стреса“.
В предишна публикация разгледахме един от аргументите зад този мит: идеята, че за да се активира глюконеогенезата (за да се направи глюкоза от протеини), трябва да се наеме допълнителен кортизол. Това е просто фактически неправилно, както показахме в публикацията.
Другият аргумент, който разглеждаме тук, е по-сложен.
Подобно на предишния мит за кортизола, той включва дефектна верига от разсъждения. Ето стъпките:
- Кетогенните диети могат да повишат някои мерки за кортизол.
- Хронично повишеният кортизол корелира с метаболитния сидром и следователно по-високите мерки на кортизола могат да показват началото на метаболитен синдром.
- Следователно кетогенните диети могат да причинят метаболитен синдром.
Метаболитният синдром е ужасен и преобладаващ проблем днес. Това е този набор от симптоми, най-силно идентифицирани с диабет - излишни коремни мазнини, висока кръвна захар и определен холестеролен профил - но също така корелират с други животозастрашаващи състояния като сърдечни заболявания и рак.
В този пост ще обясним някои от спецификите на метаболизма на кортизола. Ще покажем как този аргумент е неясен и как изясняването му води до обратното заключение. Объркването може да произтича от неразбиране на един важен факт: различните мерки на кортизола не са еквивалентни.
Първо обаче има важна причина, поради която аргументът няма смисъл.
Вече знаем, че кетогенната диета ефективно лекува метаболитния синдром. Както ще опишем по-долу, се оказва, че определени модели на кортизол са силно свързани с метаболитния синдром и може дори да са причина за метаболитен синдром. Ако моделът на кортизол, който се развива в отговор на кетогенна диета, е този, който е свързан с метаболитен синдром, тогава бихме очаквали хората на кетогенна диета да показват признаци на наддаване на мазнини в корема, повишаване на кръвната захар и влошаване на профила на холестерола, но ние вижте обратното. Това само по себе си прави малко вероятно кетогенните диети да повишават кортизола по вреден начин.
С други думи, тъй като регулирането на кортизола е толкова дълбоко свързано с метаболитния синдром, фактът, че кетогенните диети обръщат симптомите на метаболитния синдром, е силното доказателство, че те подобряване метаболизъм на кортизол.
Накратко
- Има много различни мерки за кортизол, тъй като изследователите са идентифицирали много различни процеси в метаболизма на кортизола.
- Увеличенията на някои от тези измервания са последователно свързани с метаболитния синдром, а други не.
- Някои изследователи смятат, че дисрегулацията на кортизола е ключов фактор в основата на метаболитния синдром.
- Основният камък на тази връзка може да бъде активността на ензим, 11β-HSD1. Той се превръща от неактивната форма на кортизон в активния кортизол.
- При метаболитен синдром 11β-HSD1 е недостатъчно активен в чернодробната тъкан и свръхактивен в мастната тъкан. Това води до висока степен на клирънс на кортизол и ниска скорост на регенерация.
- Установено е, че тези симптоми на дисрегулация на кортизола, свързани с метаболитен синдром, са обърнати от кето диета в проучване, което прави необходимите измервания.
Кетогенната диета повишава ли кортизола?
Графика на детската болница в Бостън (с нашата маркировка в черно). Щракнете за оригинала.
В широко цитирано проучване [1] от свързаната с Харвард детска болница в Бостън, публикувано в Journal of American Medical Association, бяха тествани три различни диети: диета с ниско съдържание на мазнини, диета с ниско съдържание на въглехидрати и ниско съдържание на въглехидрати -диета с гликемичен индекс. Изследването показа, че различните диети имат значително различни метаболитни ефекти, като диетата с ниско съдържание на въглехидрати има най-добри резултати. За наша изненада изследователите препоръчаха вместо това диета с нисък гликемичен индекс. Както обясниха в придружаващото съобщение за пресата:
„Диетата с много ниско съдържание на въглехидрати доведе до най-големи подобрения в метаболизма, но с важно предупреждение: Тази диета увеличи нивата на кортизол на участниците, което може да доведе до инсулинова резистентност и сърдечно-съдови заболявания.“
След това Бостънската детска болница продължи да създава графичен съвет, който съветва пациентите да спазват диета с нисък гликемичен индекс и дава това като основна причина да не избират диета с ниско съдържание на въглехидрати. Ето тази графика, която сме маркирали (в черно), за да покажем несъгласието си. (Щракнете за пълната версия без нашето маркиране.)
Нивата на кортизол са разбираема загриженост, тъй като високият кортизол в урината е епидемиологично свързан със значително повишен риск от смърт от инфаркти [2].
Тъй като обаче кетогенната диета ефективно третира метаболитния синдром, трябва да очакваме, че тя също така намалява онези специфични модели на кортизол, които са свързани с метаболитния синдром (и следователно сърдечни заболявания). Както показваме по-долу, това всъщност е намерено.
Как се свързва кортизолът с метаболитния синдром?
Точно както сега разбираме, че измерването на общия холестерол на индивида, без да се разглеждат съставните му части, е недостатъчно за оценка на сърдечно-съдовото здраве, има различни начини за измерване на кортизола и с метаболитен синдром се откриват само специфични модели на измервания.
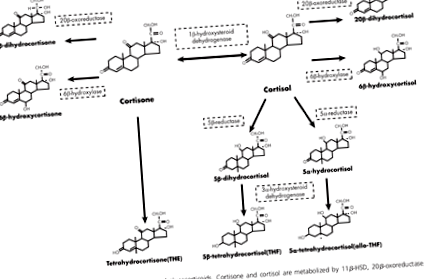
Кортизолът може да се измери в течности, като урина, слюнка или кръв. В рамките на тези течности може да се измери количеството свободен кортизол, но също така може да се измери кортизон, неактивната форма или метаболитите, които са резултат от действието на ензима, и съотношенията на който и да е от тях към останалите (вж. Фигура 1 ). Освен това тези измервания имат дневен ритъм, като са по-високи и по-ниски в различно време на деня.
Ензимът 11β-хидроксистероид дехидрогеназа (11β-HSD) може да се превръща напред-назад между кортизол и кортизон. 11β-HSD1 - подтип на 11β-HSD - преобразува кортизон в кортизол. Когато неактивният кортизон се превръща в активен кортизол, това се нарича регенерация. Другите ензими на илюстрацията разграждат кортизон или кортизол до метаболити. Този процес се нарича разрешение. Оказва се, че измерванията на тези ензими са важни за оценка на метаболизма на кортизола.
Профилът на кортизола, който е свързан с метаболитен синдром, включва следните характеристики:
- високи нива на производство на кортизол [3].
- високи нива на клирънс на кортизол [4], [5].
- висока експресия на 11β-HSD1 в мастните клетки и ниска експресия на 11β-HSD1 в черния дроб [6], [7], която определя кога и къде се регенерира кортизолът.
Подобно на начина, по който измерването на общия холестерол е свързано със сърдечно-съдови заболявания, но само защото е грубо корелирано с по-информативни измервания на холестерола, 24-часовият кортизол в урината може да бъде пълномощник за производство или изчистване, но лош [3], [4 ], [7].
Нивата на кортизол се влияят от производството, но се влияят и от регенерацията и клирънса. С други думи, ако регенерацията се увеличи или клирънсът намалее, нивата могат да се повишат, дори ако производството остане същото или спадне. (По-рано обсъждахме подобна ситуация с кръвната глюкоза и неправилното заключение относно нивата на производство на глюкоза.) Това означава, че нивата могат да изглеждат сходни, дори когато метаболизмът на кортизола е много различен.
Последици за тези, които следват хипотезата за „надбъбречната умора“: ако измервате кортизола си и той е висок, не можете да заключите, че надбъбречните жлези работят съответно усилено. Това може да се дължи на повишена регенерация и намален клирънс от ензимната активност. По-високият кортизол всъщност може да означава, че надбъбречните жлези работят по-малко!
При затлъстяването изглежда, че производството нараства, за да компенсира високия клирънс и нарушената регенерация, макар понякога да не е достатъчно, за да компенсира; кортизолът в кръвта понякога всъщност е по-нисък при пациенти със затлъстяване [8].
Как кетогенната диета влияе върху съответните мерки за кортизол?
В [9] изследователите поставят затлъстелите мъже на диета с високо съдържание на мазнини/ниско съдържание на въглехидрати (мазнини 66%, въглехидрати 4%) или на диета с умерено съдържание на мазнини/с умерено съдържание на въглехидрати (мазнини 35%, въглехидрати 35%) (libitum) ядат колкото искат). Имайте предвид, че и двете диети са имали еднакъв процент на протеини и и двете са били с по-ниско съдържание на въглехидрати от стандартната американска диета, но само диетата с високо съдържание на мазнини/ниско съдържание на въглехидрати е била на кетогенно ниски нива.
За групата с високо съдържание на мазнини и ниско съдържание на въглехидрати, „моделът на метаболитен синдром“ е обърнат: кортизолът в кръвта се покачва, клирънсът намалява и регенерацията се повишава. Това очевидно се дължи на увеличаване на активността на 11β-HSD1 в чернодробната тъкан.
(Активността на 11β-HSD1 не намалява в мастната тъкан на тези субекти, но авторите посочват, че активността в мастната тъкан има тенденция да намалява, когато се яде повече мазнини и групата с високо съдържание на мазнини/ниско съдържание на въглехидрати не е била всъщност яде повече мазнини в абсолютно изражение, отколкото в началото, само по-ниски въглехидрати.)
Това обръщане не се е случило в групата с умерени мазнини/умерени въглехидрати, въпреки че те са загубили подобно количество тегло.
Така че кетогенната диета всъщност подобри профила на кортизол на участниците, правейки го по-малко подобен на профила на кортизол, наблюдаван при метаболитен синдром.
Обобщение
Има някои основания да се смята, че дисрегулацията на кортизола е ключов фактор в основата на метаболитния синдром [10], [11]. Дисрегулацията има специфичен модел, който изглежда е причинен от тъканно-специфична експресия на ензима 11β-HSD1.
Има мнение сред някои изследователи, че кетогенните диети влошават метаболизма на кортизола (което може да доведе до метаболитен синдром и сърдечни заболявания), но изследването на специфичния модел на метаболизма на кортизола, свързан с метаболитния сидром, показва обратното.
Това е, което би трябвало да се очаква на първо място, тъй като вече е доказано, че кетогенните диети подобряват инсулиновата чувствителност (определящият симптом на метаболитния синдром) в многократни рандомизирани контролирани проучвания.
Един механизъм, чрез който кето диетата подобрява метаболитния синдром, може да бъде нейният благоприятен ефект върху метаболизма на кортизола.
Допълнителна информация
За преглед на 11β-HSD1 вижте:
Препратки:
Тип доказателство: контролиран експеримент
"Участници с наднормено тегло и затлъстяване, млади възрастни (n = 21).
„Интервенции След постигане на 10 до 15% загуба на тегло при наложена диета, участниците консумират ниско съдържание на мазнини (LF; 60% енергия от въглехидрати, 20% мазнини, 20% протеин; висок гликемичен товар), ниско гликемичен индекс ( LGI; 40% -40% -20%; умерен гликемичен товар) и много нисковъглехидратни (VLC; 10% -60% -30%; нисък гликемичен товар) диети в произволен ред, всеки за 4 седмици.
"Хормони и компоненти на метаболитния синдром (Таблица 3)
„Серумният лептин беше най-висок при LF диета (14,9 [12,1 до 18,4] ng/mL), междинен при LGI диета (12,7 [10,3 до 15,6] ng/mL) и най-нисък при VLC диета (11,2 [9,1 до 13,8] ng/mL; P = 0,0006). Екскреция на кортизол, измерена с 24-часово събиране на урина (LF: 50 [41 до 60] μg/d; LGI: 60 [49 до 73] μg/d; VLC: 71 [58 до 86] μg/d; P = 0,005 ) и серумен TSH (LF: 1,27 [1,01 до 1,60] μIU/mL; LGI: 1,22 [0,97 до 1,54] μIU/mL; VLC: 1,11 [0,88 до 1,40] μIU/mL; P = 0,04) също се различават по линеен начин чрез гликемично натоварване. Серумът T3 е по-нисък с VLC диета в сравнение с другите две диети (LF: 121 [108 до 135] ng/dL; LGI: 123 [110 до 137] ng/dL; VLC: 108 [96 до 120] ng/dL; P = 0,006).
Тип доказателство: епидемиологично наблюдение
„Контекст: Хормонът на стреса кортизол е свързан с неблагоприятни сърдечно-съдови рискови фактори, но надлъжните проучвания, изследващи дали високите нива на кортизол предсказват сърдечно-съдова смъртност, липсват до голяма степен.
Цел: Целта на това проучване е да се изследва дали нивата на кортизол в урината предсказват обща смъртност и сърдечно-съдова смъртност в продължение на 6 години проследяване в обща популация от възрастни хора.
Проектиране и настройка: Участниците бяха част от проучването InCHIANTI, проспективно кохортно проучване сред по-възрастната обща популация с 6 години проследяване.
Участници: Проучихме 861 участници на възраст 65 години и повече.
Основна мярка за резултат: Двадесет и четиричасовите нива на кортизол в урината бяха оценени на изходно ниво. През следващите 6 години смъртността от всички причини и сърдечно-съдовата смърт беше установена от смъртните свидетелства. Сърдечно-съдовата смъртност включва смъртни случаи поради исхемична болест на сърцето и мозъчно-съдова болест.
Резултати: По време на средно проследяване от 5,7 (sd = 1,2) години, 183 души са починали, от които 41 са починали от сърдечно-съдови заболявания. След корекция за социодемография, здравни показатели и изходно сърдечно-съдово заболяване, кортизолът в урината не повишава риска от не-сърдечно-съдова смъртност, но увеличава риска от сърдечно-съдова смъртност. Хората в най-високия тертил на кортизола в урината са имали пет пъти повишен риск от смърт от сърдечно-съдови заболявания (коефициент на риск = 5,00; 95% доверителен интервал = 2,02–12,37). Установено е, че този ефект е последователен при хора със и без сърдечно-съдови заболявания в началото (p взаимодействие = 0,78).
Заключения: Високите нива на кортизол силно предсказват сърдечно-съдова смърт сред лица както със, така и без предварително съществуващи сърдечно-съдови заболявания. Специфичната връзка със сърдечно-съдовата смъртност, а не други причини за смъртност, предполага, че високите нива на кортизол могат да бъдат особено вредни за сърдечно-съдовата система. "
Тип доказателство: експеримент
"Предишни проучвания показват, че в сравнение с жените мъжете са повишили CPR (29), нивата на кортизол (29, 44) и висцералното затлъстяване (9, 13). Като се има предвид, че хиперкортизолемията може да предизвика централно затлъстяване при болестни състояния като синдрома на Кушинг, повишената ендогенна секреция на кортизол се счита за потенциален механизъм, който допринася за изразяването на висцерално затлъстяване при хората.Обаче от четири предишни доклада, в които се използват 24-часови нива на екскреция на кортизол в урината като заместител за производството на кортизол, само един установява значителни връзки между секреция на урина с обща глюкокортикоиди, мазнини на ствола и инсулинова чувствителност при мъже и жени (39), докато три други проучвания при мъже не са показали връзки между секрецията на глюкокортикоиди в урината и WHR (16, 26) или висцералната мастна тъкан (48). Тези проучвания обаче не измерват директно производството на кортизол, не включват кръвен FC и не тестват за разлики в циркадните вариации на кръвните нива на корта изол и само в едно проучване е висцерална мазнина, специално измерена.
"В обобщение, открихме при мъжете, че повишената CPR и циркулиращата FC са свързани с натрупване на IAF, но не и SQF, както и с инсулинова резистентност и нарушена островна β-клетъчна компенсация (DI)."
Тип доказателство: наблюдение
"ЦЕЛИ/ХИПОТЕЗА: Регулирането на метаболизма на кортизола in vivo не е добре разбрано. Оценихме връзката между метаболизма на кортизола и чувствителността към инсулин, като коригирахме общото и регионалното съдържание на мазнини и безалкохолното мастно чернодробно заболяване.
„МАТЕРИАЛИ И МЕТОДИ:“ Бяха наети двадесет и девет здрави мъже на средна възраст с широк спектър на ИТМ. Измерихме съдържанието на мазнини чрез двуенергийна рентгенова абсорбциометрия и ядрено-магнитен резонанс (ЯМР), чернодробна мастна тъкан чрез ултразвук и ЯМР, оста на хипоталамус-хипофиза-надбъбречна жлеза чрез надбъбречна реакция към ACTH (1-24), неконюгирана екскреция на кортизол в урината, кортикостероид-свързващ глобулин и клирънс на кортизол от МС. Оценихме инсулиновата чувствителност чрез хиперинсулинемично-евгликемична скоба и чрез OGTT.
"РЕЗУЛТАТИ:" Клирънсът на кортизол е силно обратно корелиран с инсулиновата чувствителност (М стойност) (r = -0,61, p = 0,002). Клирънсът на кортизол е увеличен при хора с мастен черен дроб в сравнение с тези без (средно +/- SD: 243 +/- 10 срещу 158 +/- 36 ml/min; p = 0,014). Моделирането с множество регресии показа, че връзката между клирънса на кортизола и чувствителността към инсулин е независима от телесните мазнини. Връзката между мастната чернодробна чувствителност и инсулиновата чувствителност е повлияна значително от телесните мазнини и клирънса на кортизол.
"ЗАКЛЮЧЕНИЯ/ТЪЛКУВАНЕ:" Клирънсът на кортизола е силно свързан с инсулиновата чувствителност, независимо от количеството телесни мазнини. Връзката между затлъстяването на черния дроб и инсулиновата чувствителност се медиира отчасти както от затлъстяването, така и от изчистването на кортизола.
"Тъй като не показахме силни връзки между измерванията на инсулиновата чувствителност и нивата на кортизол в 09.00 часа, стимулираните с АСТН концентрации на кортизол и неконюгираната екскреция на кортизол в урината, тези открития предполагат, че връзката между тези други аспекти на метаболизма на кортизола и инсулиновата чувствителност е относително слаба. "
Тип доказателство: експеримент
Тип доказателство: преглед на експерименти с хора и нечовеци върху животни
„По-голямата част от доказателствата сочат както към свръхекспресия, така и към повишена активност от 11bHSD1 в подкожната (SAT) и висцералната мастна тъкан (ДДС) на затлъстели лица, въпреки че са проведени биопсии на салника в само няколко проучвания. Няколко групи са показали по-високи 11bHSD1 експресия на иРНК при затлъстели в сравнение с лица със затлъстяване (29-32), въпреки че не всички изследвания са съгласни (33). Директните in vivo измервания с помощта на микродиализа в SAT също предполагат увеличаване на степента на конверсия на кортизон в кортизол (34). Освен това, експресията на иРНК на 11bHSD1 положително корелира със затлъстяването (индекс на телесна маса и коремна обиколка), телесен състав, инсулинова резистентност (30-32), резистини и други цитокини, като TNFa, IL-6 и лептин (35).
"Активността на цялото тяло 11bHSD1 отразява предимно чернодробната експресия. Първоначалните проучвания, които разчитат на измервания на метаболити на кортизол към кортизон в урината (23,36), трябва да се вземат с повишено внимание, като показател за активността на 11bHSD1, тъй като няколко други кортизол и кортизон метаболизиращи ензими са дерегулирани при затлъстяване (36). От по-голямо значение е установяването на намалена чернодробна активност 11bHSD1, измерена чрез превръщането на перорално приложен кортизон в кортизол (23,37). По този начин, регулирането на 11bHSD1 при затлъстяване изглежда не е генерализиран процес. както в цялото тяло, така и в спланхничната циркулация, няма разлики между затлъстелите и слабите субекти по отношение на скоростта на регенерация на кортизола (измерена чрез [2H4] -кортизолов индикатор), вероятно защото регулирането на мастната тъкан се компенсира от понижаване на регулирането в черния дроб (15 ).
"Полиморфизмите в гена 11bHSD1 са идентифицирани в опит да се изясни основата за повишената активност на мастната тъкан 11bHSD1 при затлъстяване. При две популации полиморфизмите са свързани с повишен риск от диабет и хипертония, но не и затлъстяване (38,39) Беше открит и полиморфизъм, който предсказва по-ниска експресия на 11bHSD1 и защита срещу диабет (40). "
- Кетогенната диета за здраве Кето-адаптирана, но без кетони
- Кетогенната диета и мозъчно здраве Когнитивно FX
- Вашата диета влияе върху здравето на устната кухина - 1-800-DENTIST®
- Какви са кетогенните диетични рискове и ползи Mercy Health Blog
- Кетогенната диета ми помогна да преосмисля мазнините и да отслабна като резултат от ежедневното здраве