Агата Брониш
1 Ендокринология и диабетология, Медицински факултет, Ludwik Rydygier Collegium Medicum в Бидгошч, Университет Николай Коперник в Торун, ул. Skłodowskiej-Curie 9, 85-094 Бидгошч, Полша
Матеуш Озоровски
1 Ендокринология и диабетология, Медицински факултет, Ludwik Rydygier Collegium Medicum в Бидгошч, Университет Николай Коперник в Торун, ул. Skłodowskiej-Curie 9, 85-094 Бидгошч, Полша
Магдалена Хагнер-Деренговска
2 Клинична невропсихология, Факултет по здравни науки, Ludwik Rydygier Collegium Medicum в Бидгошч, Университет Николай Коперник в Торунь, ул. Skłodowskiej-Curie 9, 85-094 Бидгошч, Полша
Резюме
Глюкозата е основният източник на енергия за човешкия мозък, който от своя страна използва кетонни тела като добавка за енергиен дефицит при условия на дефицит на глюкозни клетки. Бременността, усложнена от гестационен диабет, е състояние, свързано със значително повишен риск от развитие на кетонемия. Наличните данни доказват променящо се влияние на кетоните върху централната нервна система по време на живота на плода, както и при възрастни. Кетонните тела свободно преминават през плацентата. Те могат да повлияят на растежа на плода и развитието на увреждане на органи, особено на централната нервна система. Както е договорено в настоящата препоръка на асоциациите за диабет, не е задължително лекуващият лекар да провежда рутинна проверка на кетонните тела по време на лечението на диабета по време на бременност. Тази статия е литературен преглед на ефекта на кетоните върху централната нервна система и опит за започване на дискусия дали трябва да обмислим включването на оценката на кетонемията в стандартния пакет за грижи за бременни жени с диабет и да започнем някои изследвания за обяснението на нейното влияние върху плода развитие.
1. Кетогенеза
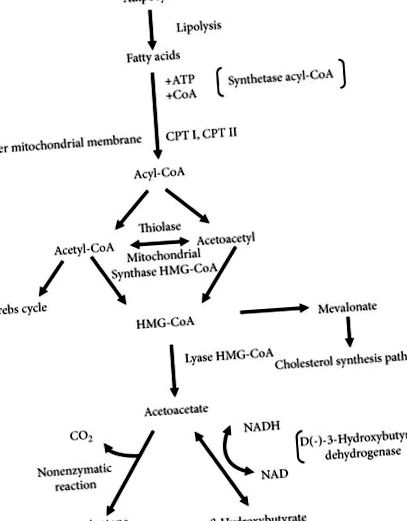
β-хидроксибутират, ацетоацетат и ацетон кетони са междинни метаболити на окисляване, главно на мастни киселини. Някои аминокиселини, наречени кетогенни аминокиселини, могат да действат като друг изходен материал за производството на гореспоменатите. Сред тях могат да бъдат изброени фенилаланин, изолевцин, левцин, лизин, триптофан и тирозин [1]. Синтезът на кетони се осъществява главно в черния дроб, в митохондриалната матрица на хепатоцитите и се регулира хормонално. Хормони, стимулиращи липолизата (глюкагон, епинефрин, норепинефрин, адренокортикотропен хормон, тиреостимулиращ хормон и растежен хормон, вазопресин, естрадиол и тестостерон), които причиняват повишена кръвна концентрация на свободни мастни киселини (FFA) - изходните материали за производството на кетонни организми - подобряват образуване на кетони. Глюкагонът е първият хормон стимулиращ освобождаването на FFA от мастната тъкан и неговото моларно съотношение към инсулина се увеличава в началото на гладуването [2]. Инсулинът, от друга страна, инхибира липолизата и намалява синтеза на кетони [3–5].
FFA, освободен от мастната тъкан по протежение на кръвоносните съдове, достига черния дроб и преминава в хепатоцитната цитоплазма, където от своя страна те са конюгирани с коензим А, което води до образуването на ацил-коензим А (ацил-КоА), който преминава в митохондриалната матрица с участието на карнитин транспортер. Интензификацията на транспорта се предизвиква от влиянието на активирането на ядрени пероксизомни пролифератор-активирани рецептори (PPAR). Активирането на техните алфа изоформи (PPARa) причинява, наред с други, увеличаването на експресията на гени, кодиращи палмитоилтрансферази I и II, които са ензими, отговорни за транспорта на амино ацил-КоА от цитоплазмата до митохондрия [4, 6-8]. В митохондриите, в процеса на β-окисление, ацил-КоА се окислява в няколко молекули ацетил-КоА, които могат да бъдат използвани в цикъла на Кребс. За да получи достъп до цикъла на Кребс, ацетил-КоА се нуждае от присъствието на оксалоацетат, чиято концентрация намалява, когато въглехидратите не са налични. Излишъкът от ацетил-КоА, който не е метаболизиран в цикъла на Кребс, не може да се използва за производство на обратна глюкоза [2]. Той се метаболизира последователно в 3-хидрокси-3-метилглутарил-КоА и след това в ацетоацетат (Фигура 1) [9].
При митохондрия ацетоацетатът се превръща в β-хидроксибутират под въздействието на D (-) - 3-хидроксибутират дехидрогеназа, която зависи от никотинамид аденин динуклеотид (NAD). Съотношението и на двете съединения е равно при физиологични условия и споменатият по-горе ензим превръща двете съединения едно в друго, докато зависи от баланса на оксиредукция в митохондрията [1]. При състояния на глюкозен дефицит, когато редуцирана форма на никотинамид аденин динуклеотид (NADH) доминира, има промяна на реакцията към образуването на β-хидроксибутират [9-11]. В тези състояния съотношението на β-хидроксибутират към ацетоацетат в кръвта варира от 3: 1 до 10: 1. Освен това ацетоацетатът се превръща в ацетон в резултат на спонтанна (неензимна) и необратима реакция [12]. Кетоните, които действат като киселинни съединения, свързват бикарбонатите в кръвта и допринасят за понижаване на серумното рН [2].
1.1. Кетонни тела като алтернативен източник на енергия
FFA се превръщат в основен субстрат на телесната енергия в състоянието, описано като вътреклетъчен дефицит на глюкоза. Кетонните тела, които се образуват от FFA, стават основният източник на енергия за органите и тъканите. Ацетоацетатът и β-хидроксибутиратът като вещества, които са разтворими във водни разтвори, лесно се транспортират от черния дроб до периферните тъкани, тъй като не се нуждаят от албумин или липопротеин за този процес [2]. Кетоните преминават в неврони и глиални клетки чрез конвейера монокарбоксилни киселини (МСТ (транспортери на монокарбоксилна киселина)). Основната изоформа за този процес е изоформа 1, локализирана в астроцити, олигодендроцити и ендотелни клетки [13]. В целевите клетки ацетоацетатът се превръща обратно в две молекули ацетил-КоА, които са включени в цикъла на Кребс (Фигура 2). Ензимът, отговорен за този процес - кетоацил-коензим трансфераза - не присъства в митохондриите на черния дроб; следователно кетоните не могат да бъдат източник на енергия в хепатоцитите [2]. От друга страна, β-хидроксибутиратът действа по-скоро като „резервна мощност“, която изисква превръщането му в ацетоацетат с участието на описаната по-горе β-хидроксибутират дехидрогеназа [1, 12].
Използване на тъкани на кетонни тела.
Повишена кетогенеза във физиологични условия се наблюдава не само на гладно, но и по време на енергийно балансирана диета, която включва високо съдържание на мазнини и ниско съдържание на въглехидрати, както и след тренировка, по време на бременност и в неонаталния период. При патологични състояния често се наблюдава повишен синтез на кетонни тела при алкохолни заболявания и неконтролиран диабет [12, 14-16]. Кетоните се метаболизират във важни жизненоважни органи като мозъка, сърцето и бъбреците. Те са енергиен материал и за скелетните мускули. И все пак, както е описано по-горе, черният дроб няма способността да ги използва като източник на енергия [1, 17].
Кетоните вземат важно участие в централната нервна система (ЦНС), където се превръщат в единствения източник на енергия в състоянията на вътреклетъчен глюкозен дефицит поради факта, че преминават свободно през кръвно-мозъчната бариера, докато FFA не [2]. В животинския модел Blázquez et al. доказа, че кетоните в ЦНС идват не само от чернодробния синтез, но и астроцитите, които регулират метаболизма на глюкозата в мозъка, са способни да произвеждат кетони [18]. β-хидроксибутиратът и ацетоацетатът, които бяха споменати по-горе, са енергийни субстратни клетки. Stenerson et al. доказа, че β-хидроксибутират и лактат се натрупват в мозъчните базални ганглии при деца с кетоацидоза [19]. Ограниченото използване на ацетон през клетката се дължи на неговите физични свойства. Ацетонът се отстранява от издишания въздух и урината поради високата си летливост [1, 11, 20].
1.2. Кетонен метаболизъм в тялото при бременни жени
Кетоните преминават свободно през плацентата и могат да бъдат използвани като източник на енергия и от плода [1, 28]. Seccombe et al. обслужва бременни плъхове с белязан с радиоизотоп бета-хидроксибутират през феморалната вена и доказва, че този изотоп е открит във феталната плазма вече след пет минути. Въглероди, получени от белязан β-хидроксибутират, присъстват в ацилоглицерините, фосфолипидите и холестерола [29].
2. Кетони и централната нервна система
Наблюдателните и експериментални проучвания върху животни разкриват, че кетонните тела в ЦНС не само са източник на енергия, но и оказват влияние върху нейното функциониране. И все пак обхватът и механизмът на влияние на кетоните върху ЦНС все още не са напълно изяснени. Документирано е въздействието на кетонемията върху възбудимостта на ЦНС. Първите клинични описания на използването на кето диета като ефективно лечение на припадъци датират от началото на ХХ век. Този метод, оттеглен след въвеждането на дифенилхидантоин за лечение на епилепсия, беше използван отново като алтернативен начин в случаите на резистентни на лекарства гърчове в края на 90-те години. Ефективността му не корелира с нивото на кетон в серума [30]. Също така могат да бъдат намерени някои доклади за полезните ефекти на кетонните тела при болестта на Хънтингтън [7].
Има няколко теории, обясняващи механизмите на въздействие на кетоните върху функционирането на ЦНС. Според един от тях метаболизмът на кетоните причинява повишен синтез на аденозоно-5′-трифосфат (АТФ) в митохондриите. Повишените енергийни резерви в клетките водят до намаляване на производството на АТФ чрез гликолиза. Ензимите за гликолиза са свързани с мембранните протеини. Това води до понижаване на АТР отделенията, разположени в клетъчната мембрана. Тази ситуация може да намали активността на АТР-зависимите помпи в мембранните канали, което може да допринесе за стабилизирането на клетъчните мембрани и да повлияе на невронната активност [31].
Според друга теория, ацетоацетатът директно инхибира активността на съдовия глутамат транспортер в хипокампалните синаптични везикули, които са отговорни за синаптичния транспорт на този важен невротрансмитер. Ацетоацетатът няма инхибиторен ефект върху транспорта на различен невротрансмитер - гама аминомаслена киселина (GABA). Доказано е обаче, че кето диетата инхибира активността на substantia nigra pars reticulata, където се намират основните GABAergic неврони. Според друга хипотеза кетоните стимулират синтеза на GABA, който е инхибиторен невротрансмитер на мозъчната възбудимост [31]. Съобщава се, че β-хидроксибутиратът не показва описани инхибиторни действия.
Друга теория обяснява инхибирането на substantia nigra от G протеин на АТР-зависим мембранен канал, който е свързан с GABA рецепторите или А1 аденозиновите рецептори. Аденозинът намалява невронната активност посредством А1 рецептора. Кетогенната диета причинява повишени нива на аденозин, които изчезват след консумацията на въглехидрати. Идея, според която липсата на глюкоза може да има по-голямо значение за функционирането на невроцитите, отколкото кетонната активност, също е взета под внимание [31].
Glaser et al. сравнява ефектите на хипергликемията и кетонемията върху функциите на шестте зони на кората на кората и две ядра на стриатума при плъхове. Авторите са оценили три параметъра и в двете състояния: церебрално разпределение на водата, мозъчен кръвен поток и съдържание на избрани клетъчни метаболити, включително високоенергийни съединения чрез магнитно-резонансна спектроскопия. Установено е значително намален мозъчен кръвен поток, променено разпределение на водата в мозъчната кора и при кетоза и намалено съдържание на високоенергийни съединения и при двете: хипергликемия и кетонемия. Авторите също така предполагат възможното влияние на инсулиновия дефицит и ниските нива на IGF-1 с изключение на самите кетони върху намаляването на мозъчния кръвоток [34].
2.1. Кетони и централната нервна система на плода
Съществуват и проучвания, които предполагат връзка между кетонемията при бременни жени и развитието на умствени деца. Изследването върху 223 бременни жени (35 здрави, 89 с прегестационен диабет и 99 с гестационен диабет) е публикувано в NEJM през 1991 г. β-хидроксибутират и FFA плазмени нива, както и ацетон в урината по време на бременност при майки и коефициент на интелигентност на потомството на възраст 2 години и отново между 3 и 5 години на възраст бяха оценени. Установено е, че децата на майки с по-високи концентрации на β-хидроксибутират и FFA показват по-ниско ниво на интелигентност. Нямаше такава връзка с ацетонурия [36].
В животинския модел запазването на кетогенната диета след раждането е свързано с риск от диабетна кетоацидоза, главно през първите три седмици, и води до забавяне на по-нататъшния растеж на потомството [37]. От друга страна, като възрастни, те се характеризират с повишена физическа активност и намалена податливост на тревожност и депресия. Предполага се, че нивата на кетон пречат на допаминовите и серотониновите метаболити, които са невротрансмитери, участващи в процесите на тревожност и депресия. Не може да се изключи, че тези анатомични мозъчни промени, причинени от повишени нива на кетони във феталния живот, могат да бъдат причина за поведенчески проблеми и в по-късния живот. Дългосрочно проучване на ефектите на кетогенната диета предполага възможни вредни ефекти върху паметта и други когнитивни функции при плъхове и хора [34].
Въглехидратните нарушения са най-честото усложнение на бременността в днешно време. Според Атласа на Международната федерация по диабет от 2017 г., дори 16,2% от бременните жени изпитват тези нарушения. По-голямата част от 75–90% са гестационен диабет [38]. Наличните данни за ефектите от нарушенията на въглехидратите върху развитието на плода дават противоречива информация. Първият мета-анализ на този проблем беше публикуван през 2015 г. - бяха одобрени 12 изследвания (нито едно от тях не беше рандомизирано клинично изпитване); 9 от които са проспективни кохортни проучвания и 2 от тях са ретроспективни изследвания. Въпреки че авторите подчертават високата хетерогенност на резултатите, е доказано, че въглехидратните нарушения на майката могат да повлияят неблагоприятно на развитието на потомството. Установено е, че децата на възраст 1-2 години се характеризират с 41% по-ниско умствено развитие, 31% по-лошо психомоторно развитие и дори до 78% по-нисък коефициент на интелигентност в сравнение с техните физиологични аналози по време на бременност [39].
Въпреки подобни наблюдения, Полската, Британската или Американската диабетна асоциация не разглежда контрола на кетоните като рутинна препоръка при пациенти с гестационен диабет.
3. Контрол на кетоните при пациенти с диабет
Методите, използвани за контрол на кетонните тела, могат да се използват при самоконтрол. Те определят кетони в урината чрез лентови тестове или измерват концентрацията на β-хидроксибутират в капилярната кръв.
Тази оценка може да се извърши с помощта на така наречените кетометри. Устройството Abbott Precision Xceed Pro® е одобрено от Американската администрация по храните и лекарствата (FDA) като устройство за измерване на нивата на β-хидроксибутират у дома и в болница. Това устройство може да измери количеството на β-хидроксибутират в кръвта между 0 и 8 mmol/l. Тестът включва прилагане на капка кръв върху лента за еднократна употреба, поставена в устройство. Лентата е наситена с β-хидроксибутират дехидрогеназен ензим. Благодарение на този ензим, β-хидроксибутиратът се превръща в ацетоацетат, който едновременно намалява NAD до NADH. По време на тази реакция възниква електрически поток с ток, чиято стойност е пропорционална на концентрацията на β-хидроксибутират в кръвта.
Неправилно събраната кръвна проба може да повлияе на тези резултати. Следователно артериалната кръв, новородената кръв, плазмата и серумът не трябва да се използват. Нещо повече, нивото на хематокрит трябва да варира от 30% до 70%, за да се направи точно измерването. Трябва да се поддържа допълнително внимание при тежко дехидратирани пациенти с тежка хипотония, шок или с хиперосмоларен хипергликемичен синдром [11, 47]. В момента Асоциацията на британските клинични диабетолози определя определянето на концентрацията на β-хидроксибутират в кръвта като най-добрия начин за проследяване на отговора на лечението на диабетна кетоацидоза [48]. И все пак Американската диабетна асоциация и Полската диабетна асоциация не подкрепят нито един от тези методи [49, 50].
По време на бременност, усложнена от диабет до значително увеличение на кетонното ниво в сравнение със здрави бременни жени. Настоящите насоки за асоцииране на диабетици не препоръчват кетонна рутинна оценка при бременни жени с диабет. Вярваме, че информацията, описана в статията, оправдава започването на дискусия по този проблем.
Разкриване
Ръкописът е извършен като част от заетостта в Collegium Medicum в Бидгошч, Университет Николай Коперник в Торунь.
- Хранене и централна нервна система SpringerLink
- Факти за нервната система, функция; Болести Жива наука
- Хранене и автономна нервна система Научните основи на протокола от Гонсалес
- Преглед на нарушения на нервната система Медицина Джон Хопкинс
- Чувствителност към глутен при бременност и развитие на мозъка на вашето дете