1 Болница по традиционна китайска медицина Ксиамен, Ксиамен, Фуджиан 361009, Китай
Обществена здравна служба на улица Jinshan Street, Ксиамен, Фуджиан 361000, Китай
3 Академия по интегративна медицина, Университет по традиционна китайска медицина Фуджиан, Фуджоу, Фуджиан 350122, Китай
4 Ключова лаборатория по интегративна медицина по гериатрия, Фуджиан, Университет по традиционна китайска медицина Фуджиан, Фуджоу, Фуджиан 350122, Китай
5 Катедра по интегративна медицина, Фуджоу, Фуджиан 350122, Китай
Резюме
Общо алкалоиди в Rubus aleaefolius Poir (TARAP) е народна лечебна билка, която се използва клинично в Китай за лечение на безалкохолна мастна чернодробна болест (NAFLD) в продължение на много години. Въпреки това, механизмът на неговия анти-NAFLD ефект е до голяма степен неизвестен. В това проучване разработихме модел на плъхове NAFLD, като предоставихме модифицирана диета с високо съдържание на мазнини (mHFD) ad libitum за 8 седмици и оценява терапевтичния ефект на TARAP при плъхове NAFLD, както и основния молекулен механизъм. Установихме, че TARAP може да намали нивата на серумните триглицериди (TG), общия холестерол (TC) и нивата на липопротеините с ниска плътност (LDL-C) и да увеличи нивото на серумен липопротеин с висока плътност (HDL-C) при плъхове NAFLD. В допълнение, лечението с TARAP намалява експресията на синтетаза на мастни киселини (FAS) и ацетил-CoA карбоксилаза (ACC) и повишава регулирането на експресията на карнитин палмитоилтрансфераза (CPT). Нашите резултати показват, че регулирането на липидния метаболизъм може да бъде механизъм, чрез който TARAP лекува NAFLD.
1. Въведение
Безалкохолната мастна чернодробна болест (NAFLD) нараства в световен мащаб и в момента е най-често диагностицираното чернодробно заболяване в западните страни [1–4]. Смята се, че NAFLD се среща при 10–24% от населението [5–7]. Въпреки повишеното разпространение, патогенезата на NAFLD остава слабо разбрана. Анормалният липиден метаболизъм и особено прекомерното натрупване на липиди са критични за патогенезата на NAFLD [8]. Инсулиновата резистентност, оксидативен стрес и локална дисфункция на микроциркулацията също могат да допринесат за развитието на NAFLD [9]. Предишни проучвания демонстрират, че експресията на гени, кодиращи ацетил-КоА карбоксилаза (ACC), синтетаза на мастни киселини (FAS) и карнитин палмитоилтрансфераза (CPT), е значително променена в NAFLD [10], допълнително свързваща появата на NAFLD с нарушения на чернодробните липиди метаболизъм.
Поради ключовата роля на натрупването на липиди в прогресията на NAFLD, инхибирането на натрупването на липиди е основен фокус при разработването на лекарства против NAFLD. Разнообразие от средства против NAFLD в момента са в предклинично развитие, като някои в момента се използват в клинични изпитвания. За съжаление, широкото използване на тези агенти води до неблагоприятни резултати; следователно, най-ефективните агенти с минимални странични ефекти са силно желани.
Естествените продукти, включително традиционната китайска медицина (ТКМ), показват сравнително малко странични ефекти и се използват клинично от хилядолетия, което прави такива терапии важни алтернативни лекарства за различни заболявания [11]. Въпреки че механизмът на действие е неизвестен, билкови лекарства, като глог, Radix bupleuri, и суха кора от мандарина [12], отдавна се използват за успешно лечение на NAFLD.
Рубъс (Rubus L.), принадлежаща към семейство Розови (Rosaceae), е лечебна билка, широко разпространена по целия свят. Rubus aleaefolius Poir (R. aleaefolius) е едно Рубъс видове, използвани за изчистване на топлината, спиране на кървенето, насърчаване на кръвообращението и отстраняване на застой на кръв. Той е бил използван за лечение на различни видове хепатит в окръг Anxi на провинция Фудзиен, Китай и е показал значителни терапевтични ефекти върху NAFLD. Нашите предишни проучвания в модел на остро увреждане на черния дроб при плъхове, предизвикан от тетрахлорид, показват, че общите алкалоиди в Rubus aleaefolius Poir (TARAP) подобрява мастната дегенерация, което предполага, че TARAP може да бъде ефективна терапия за NAFLD [13]; въпреки това, механизмът на неговата анти-NAFLD активност все още остава неизвестен. За по-нататъшно разбиране на механизмите, чрез които TARAP упражнява анти-NAFLD ефекти, разработихме модел NAFLD на плъхове и оценихме ефекта от терапията с TARAP върху експресията на гени, свързани с липидния метаболизъм.
2. Материали и методи
2.1. Приготвяне на общо алкалоиди от Rubus aleaefolius Poir (ТАРАП)
TARAP е изготвен, както е описано по-рано [14]. Накратко, коренът на R. alceifolius Poir се събира от Anxi от провинция Fujian и алкалоидите се екстрахират съгласно следната процедура. Билковият прах (1 g) се екстрахира с 50 ml разтвор хлороформ: метанол: амоняк (15: 4: 3) в продължение на 2 часа в ледена баня, последвано от 30 минути обработка с ултразвук и филтриране. Филтрираният разтвор се събира и суши. Полученият остатък се разтваря в 2 ml 2% разтвор на сярна киселина и се филтрува. Филтърната хартия и остатъкът се промиват повторно с 2 ml 2% разтвор на сярна киселина и буферен разтвор (рН 3.6). След това се добавя буфер до краен обем от 50 ml и разтворът се запазва за бъдеща употреба. За измерване на общото съдържание на алкалоиди се използва колориметрия с киселинно багрило. Общият добив на алкалоиди е 0,81 mg алкалоид на грам първоначален билков прах.
2.2. Реактиви
Полиен фосфатидилхолин (PP) е закупен от Sanofi-Aventis Ukraine Company Liability Company. Комплект Trizol, комплект за синтезиране на cDNA от първа верига M-MLV и Taq ДНК-полимераза са закупени от Life Technologies (Карлсбад, Калифорния, САЩ); Обратната транскриптаза SuperScript II е закупена от Promega (Madison, WI, САЩ); Гелът Biowest Agarose е закупен от Испания. Комплекти за измерване на триглицериди (TG), общ холестерол (TC), липопротеин с висока плътност (HDL-C) и активност на липопротеини с ниска плътност (LDL-C) са получени от Института по биотехнологии Jiancheng (Нанкин, Китай). Всички други химикали, освен ако не е посочено друго, са получени от Sigma-Aldrich Chemicals (Сейнт Луис, Мисури, САЩ).
2.3. Разработване на NAFLD животински модел
Мъжки 8-седмични плъхове Sprage-Dawley (SD) (Slike Co. Ltd, Шанхай, Китай), с тегло 180
200 g, бяха настанени по пет на клетка в контролирана от околната среда стая с температура от
° C, относителна влажност 40–60%, вентилация на въздуха 12–18 пъти/час и цикъл изкуствена светлина/тъмнина 12:12 часа от 150–300 lux. Плъховете бяха снабдени с храна и вода ad libitum. Всички проучвания върху животни са одобрени от Комитета по етика на животните от Института по традиционна китайска медицина Фуджиан (Фуджоу, Китай). Експерименталните процедури бяха в съответствие с Насоките за експериментиране с животни на Университета по традиционна китайска медицина Фуджиан (Фуджоу, Китай).
2.4. Хистологично изследване
Малки парченца чернодробна тъкан бяха събрани от една и съща позиция на всеки плъх и фиксирани с 10% формалин за 24 часа. Пробите се влагат в парафин и след това се приготвят участъци от 4-5 mm. Впоследствие срезовете бяха оцветени с хематоксилин и еозин (H&E). Хистологичната оценка е извършена два пъти от патолог, който не е знаел за леченията в два отделни случая. Използвана е полуколичествена система за оценка, за да се оцени тежестта на чернодробната стеатоза и възпалителната клетъчна инфилтрация в 10 микроскопични полета, както е описано по-рано [15]. Накратко, за оценка на чернодробната стеатоза бяха използвани следните критерии: степен 0 (-), без мазнини; степен 1 (+), мастни хепатоцити, заемащи 33% от чернодробния паренхим; степен 2 (++), мастни хепатоцити, заемащи 33–66% от чернодробния паренхим; и степен 3 (+++), мастни хепатоцити, заемащи> 66% от чернодробния паренхим.
2.5. Биохимични анализи
Кръвосъдържащите епруветки се оставят да престоят при стайна температура в продължение на 2 часа. Серумите се получават чрез центрофугиране при 3000 × g в продължение на 20 минути при 4 ° С и се съхраняват при -20 ° С. Нивата на серуми TG, TC, HDL-C и LDL-C бяха измерени от комплектите в съответствие с инструкциите на производителя.
2.6. Екстракция на РНК и RT-PCR анализ
Общата РНК се изолира от прясна чернодробна тъкан, използвайки реактив Trizol. РНК с първоначална олиго (dT) (1 μж) е транскрибирана обратно с SuperScript II обратна транскриптаза в съответствие с инструкциите на производителя. Получената сДНК се използва за PCR. GAPDH се използва като вътрешен контрол. Праймерите, използвани за амплификация на гени FAS, ACC, CPT и GAPDH, са както следва: FAS F: 5′-CCT TAG TAC TGC GTG GTC GTA T-3 ′, R3: 5′-CAG AGG GTG CTT GTT AGA AAG AT -3 ′ (301 BP); ACC F: 5′-TGA GGA GGA CCG CAT TTA TC-3 ′, R: 5′-GAA GCT TCC TTC GTG ACC AG-3 ′ (565 bp); CPT F: 5′-TAT GTG AGG ATG CTG CTT CC-3 ′, R: 5′-CTC GGA GAG CTA AGC TTG TC-3 ′ (629 bp); GAPDH F: 5′-AGA TCC ACA ACG GAT-3 ′, R: 5′-TCC CTC AAG ATT GTC AGC AA-3 ′ (308 bp). Усилването на всеки ген се извършва с термичен циклер (GE9600, САЩ), като се използват следните параметри на циклиране: денатуриране, 95 ° C за 5 минути, 30 цикъла от 95 ° C за 30 s и температура на отгряване за 30 s и 72 ° С за 1 min, последвано от окончателно удължаване от 10 min при 72 ° C. Експресията на гена се определя за 6-8 проби, произволно избрани от всяка група и всяка проба се репликира 3 пъти. PCR продуктите се разделят чрез електрофореза върху 1,5% агарозен гел. ДНК лентите бяха изследвани с помощта на система за гел документация (BioRad, Model Gel Doc 2000, САЩ).
2.7. Имунохистохимичен анализ
Блок от тъкан 0,5 cm × 0,5 cm × 0,1 cm се събира от чернодробна тъкан на всеки плъх. Тъканните блокове бяха изплакнати с разтвор на фосфатен буфер (PBS), фиксирани с 10% формалдехид за 12–24 часа и впоследствие вградени в парафин, архивирани и след това разделени. Парафиновите секции бяха използвани за FAS, ACC и CPT имунохистохимично оцветяване. Първичните антитела са поликлонални заешки анти-плъхове FAS, ACC и CPT (всички в разреждане 1: 200, биотехнология Santa Cruz). PBS се използва за заместване на първичното антитяло като отрицателна контрола. След измиване с PBS, предметните стъкла се инкубират с биотинилирано вторично антитяло, последвано от конюгирана хрянова пероксидаза (HRP), белязана стрептавидин (Dako) и след това се промиват с PBS. Цветът е разработен с помощта на DAB хромоген в съответствие с инструкциите на производителя. След оцветяване във всеки слайд бяха избрани на случаен принцип пет мощни полета (400x) и средните пропорции на положителни клетки във всяко поле бяха преброени с помощта на истинската цветна многофункционална система за управление на анализ на изображения на клетки (Image-Pro Plus, Media Cybernetics, USA ).
2.8. Статистически анализи
Всички данни са средството за три измервания и данните са анализирани с помощта на пакета SPSS за Windows (Версия 11.5, САЩ). Статистическият анализ на данните беше извършен с Student’s
-тест и ANOVA с post hoc анализ на значимостта. Разлики с
се считат за статистически значими.
3. Резултати
3.1. TARAP Подобрена чернодробна стеатоза при плъхове NAFLD
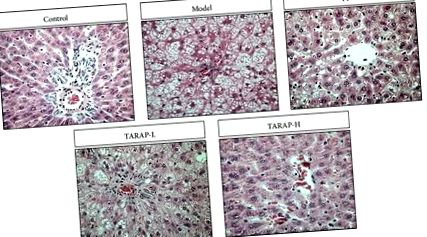
Хистологичното изследване се разглежда като „златен стандарт“ за определяне на наличието и тежестта на NAFLD [16]. Поради това оценихме терапевтичната ефикасност на TARAP, като изследвахме неговия ефект върху хистологичните промени в чернодробните тъкани на плъхове NAFLD. В сравнение с контролната група плъхове с нормална чернодробна хистология, плъховете в моделната група развиват чернодробен стеатохепатит, характеризиращ се с натрупване на мазнини, балониране на хепатоцити, разпръснато лобуларно възпалително клетъчно инфилтриране и възпалителни огнища (Фигура 1) Лечението с TARAP значително подобрява чернодробната стеатоза и възпаление по зависим от дозата начин.
3.2. TARAP променя нивата на серуми TG, TC, HDL-C и LDL-C при плъхове NAFLD
За да потвърдим допълнително анти-NAFLD ефекта на TARAP, ние изследвахме нивата на серумите TG, TC, HDL-C и LDL-C. Плъховете от групата на модела са имали значително по-високи серумни нива на TC, TG и LDL-C и по-ниско ниво на HDL-C в сравнение с нормалните плъхове () (Фигури 2 (а) и 2 (b)). Повишаването на нивата на TC, TG и LDL-C и намаляването на HDL-C при плъхове NAFLD бяха неутрализирани чрез лечение с TARAP ().
(модел спрямо контрол), #
(висок или нисък спрямо модел), ANOVA и post hoc тест.
3.3. TARAP потиснат израз на ACC, FAS и CPT при плъхове NAFLD
За да изследваме механизма на анти-NAFLD активност на TARAP, ние оценихме експресията на mRNA и протеина на ACC, FAS и CPT в чернодробните тъкани, използвайки RT-PCR анализ и имунохистохимичен анализ (IHC), съответно. Резултатите показаха, че нивата на mRNA и протеини на ACC и FAS са значително повишени, докато нивата на CPT са значително намалени в чернодробните тъкани на моделната група в сравнение с контролната група () (Фигура 3) Лечението с TARAP значително неутрализира промяната на нивата на мРНК на ACC, FAS и CPT и протеини при плъхове NAFLD () (Фигури 4 и 5).
- Лечение на мастна чернодробна болест Безалкохолна мастна чернодробна болест
- Естествено лечение във Ванкувър за дебел черен дроб Vitalia Healthcare Naturopath
- Какво е мастна чернодробна болест и какво правим, за да я лекуваме Храносмилателна UT Southwestern Medical
- Какви са усложненията на мастната чернодробна болест POZ
- Кой трябва да лекува мастна чернодробна болест Първична помощ или хепатология