Tawfeek Altawaty
1 Институт по животновъдни науки, Китайска академия на земеделските науки, Пекин 100193, Китай; moc.liamxof@keefwat (T.A.); moc.621@0902ululuil (L.L.); nc.saac@gnocoat (C.T.); nc.saac@auhoahsuoh (S.H.); nc.saac@iukil (К.Л.)
Лулу Лиу
1 Институт по животновъдни науки, Китайска академия на земеделските науки, Пекин 100193, Китай; moc.liamxof@keefwat (T.A.); moc.621@0902ululuil (L.L.); nc.saac@gnocoat (C.T.); nc.saac@auhoahsuoh (S.H.); nc.saac@iukil (К.Л.)
2 Катедра по животновъдство, Китайски земеделски университет, Пекин 100193, Китай
Хонгйонг Джанг
3 Държавна ключова лаборатория по репродуктивна биология, Институт по зоология, Китайска академия на науките, Пекин 100101, Китай; moc.361@648gnoygnohgnahz
Конг Тао
1 Институт по животновъдни науки, Китайска академия на земеделските науки, Пекин 100193, Китай; moc.liamxof@keefwat (T.A.); moc.621@0902ululuil (L.L.); nc.saac@gnocoat (C.T.); nc.saac@auhoahsuoh (S.H.); nc.saac@iukil (К.Л.)
Шаохуа Хоу
1 Институт по животновъдни науки, Китайска академия на земеделските науки, Пекин 100193, Китай; moc.liamxof@keefwat (T.A.); moc.621@0902ululuil (L.L.); nc.saac@gnocoat (C.T.); nc.saac@auhoahsuoh (S.H.); nc.saac@iukil (К.Л.)
Куй Ли
1 Институт по животновъдни науки, Китайска академия на земеделските науки, Пекин 100193, Китай; moc.liamxof@keefwat (T.A.); moc.621@0902ululuil (L.L.); nc.saac@gnocoat (C.T.); nc.saac@auhoahsuoh (S.H.); nc.saac@iukil (К.Л.)
Янфанг Уанг
1 Институт по животновъдни науки, Китайска академия на земеделските науки, Пекин 100193, Китай; moc.liamxof@keefwat (T.A.); moc.621@0902ululuil (L.L.); nc.saac@gnocoat (C.T.); nc.saac@auhoahsuoh (S.H.); nc.saac@iukil (К.Л.)
Свързани данни
Резюме
1. Въведение
Лимфотоксин бета рецепторът (LTβR) принадлежи към суперсемейството на рецептора на туморния некротичен фактор (TNF) (TNFRSF), което включва повече от 25 рецептора, които взаимодействат с близо 20 лиганда за регулиране на имунния отговор, и се активира от възпалителните цитокини лимфотоксин α1β2 или TNF член на суперсемейство 14 (TNFSF14, наричан още ЛЕКЛО) [1]. LTβR се експресира на повърхността на повечето клетъчни типове, с най-висока експресия върху клетки от епителни и миелоидни линии [2].
Наскоро бяха използвани условни нокаутиращи модели мишки, за да разкрият нови клетъчни функции на LTβR. Въздействията на LTβR върху развитието на лимфните възли (LN) и микросредата на съдовата LN бяха разкрити от специфични за ендотелните клетки клетъчни мишки LTβR и това проучване идентифицира ендотелните клетки като важен организатор на лимфоидна тъкан, зависим от LTβR [9]. Освен това е демонстрирано, че LTβR сигнализирането в чревните епителни клетки е от съществено значение за производството на епителни IL-23 и защита срещу епителни увреждания [10]. Изследването на макрофаги/неутрофилни LTβR-специфични нокаутиращи мишки, които са генерирани от системата flox/LysM-cre, предполага, че LTβR активирането върху макрофаги от лимфотоксин α1β2, получен от Т-клетки, контролира провокативните реакции чрез трипартитния мотив протеин 30α (TRIM30α ) път за защита срещу обострящи се възпалителни реакции [11].
Свинският епидемичен вирус на диария (PEDV) се репликира ефективно в тънките черва [12], а PEDV инфекцията причинява остър, тежък атрофичен ентерит, включително лека до тежка водниста диария, дехидратация и повръщане при свинете. Съобщава се за тежки огнища на PEDV инфекции в Китай през 2010 г. [13] и в Северна Америка през 2013 г. [14], което води до висока смъртност сред заразените прасенца и огромни икономически загуби. Епителните клетки осигуряват първата линия на защита срещу лигавичните патогени, а IPEC-J2 клетките и LTβR сигнализирането в чревните епителни клетки са необходими за набирането на неутрофили до мястото на инфекцията по време на ранната инфекция чрез производството на лиганд хемокин (CXC мотив) 1 (CXCL1) и CXCL2 [15]. Понастоящем обаче значението на LTβR за регулирането на PEDV инфекцията в клетки IPEC-J2 е неизвестно. В това проучване генерирахме LTβR нокаут клетки, използвайки техниката CRISPR/Cas9 и изследвахме ефекта на LTβR върху клетъчната пролиферация на IPEC-J2, клетъчния цикъл и апоптозата. По-конкретно, въздействието на LTβR върху PEDV инфекцията в клетки IPEC-J2 също беше изследвано.
2. Материали и методи
2.1. Проби от свински черва
Тъканите на свинските черва, включително дванадесетопръстника, йеюнума, илеума, апендикса, дебелото черво, ректума и лимфните възли, бяха събрани от четири възрастни мъжки големи бели прасета (n = 4). Всички експерименти с животни са извършени съгласно процедурите, одобрени от Институционалния комитет по грижа и употреба на животните към Института по зоология на Китайската академия на науките (CAS) (Етичен номер на одобрение: IOZ20160047).
2.2. Клетъчна култура
Клетки от бъбреци на африканска зелена маймуна (Vero E6) се съхраняват в лабораторията на Shaohua Hou от Института по наука за животните (IAS), Китайската академия на земеделските науки (Пекин, Китай) и клетките IPEC-J2 са закупени от Jennio Biotech Co., Ltd. (Гуанджоу, Китай). И двете клетки бяха култивирани в Dulbecco’s Modified Eagle’s Medium (DMEM, Gibco BRL, Grand Island, NY, USA), допълнени с 15% фетален говежди серум (FBS, HyClone, Logan, UT, USA) и 1% пеницилин-стрептомицин. И двата клетъчни типа се инкубират при 37 ° С с 5% СО2. Адаптираният към клетките Vero щам PEDV CV777, съхраняван в лабораторията на Hou от IAS, се размножава, както е описано по-рано [16].
2.3. Насочване на гени от системата CRISPR/CAS9
2.4. PCR с обратна транскрипция (RT-PCR)
В това проучване са използвани две различни RT-PCR, PCR в реално време и полуколичествена PCR. Общата РНК от тъкани и клетки се изолира чрез реагент TRIzol и концентрациите на РНК се определят с апарат NanoDrop (NanoDrop Technologies, Wilmington, DE, USA). Два милиграма от обща РНК бяха обратно транскрибирани с помощта на комплект за синтезиране на cDNA от първа верига (Thermo Fisher Scientific, Waltham, MA, USA). PCR в реално време се извършва с помощта на SYBR Green master mix (Applied Biosystems, Foster City, CA, USA) и 7500 Fast PCR система в реално време (Applied Biosystems, Foster City, CA, USA). Експресионните нива бяха нормализирани до тези на домакинския ген, глицералдехид-3-фосфат дехидрогеназа (GAPDH). Праймерите, използвани за PCR в реално време, са показани в таблица 1. Относителната генна експресия се изчислява, използвайки метода на сравнителния праг на цикъла (2 -DDCt). Параметърът за полуколичествена PCR беше 4 минути при 94 ° C, последвани от 26 цикъла от 45 s при 94 ° C, 30 s при 60 ° C, 45 s при 72 ° C и окончателно удължаване от 5 минути при 72 ° C . PCR продукти (10 uL) бяха използвани за откриване на експресията.
маса 1
Грундове, използвани в това проучване.
| Лимфотоксин бета рецептор (LTβR) | CACTCATGCTGGGCCTCT | GAGCAGCAGACGTGATGTTT |
| Молекула на адхезия на съдови клетки 1 (VCAM1) | ATCCAAGCTGCTCCAAAAGA | GGCCCTGTGGATGGTATATG |
| Интерлевкин-22 (IL-22) | TTGCTCAAGTTCGTGTCGTC | GGTCAAGCTTGCAGTGATGA |
| Интерлевкин-23 (IL-23) | TAGGGGTCGAGTCAGAGGTG | GAGTGCCATCCTTGAGCTGT |
| Интерлевкин-6 (IL-6) | CCACCGGTCTTGTGGAGTTT | AGTCGGGTTGTCTAGGCTGA |
| Интерлевкин-8 (IL-8) | TGCAAGCTTTGTTATGCAGTG | GCCTGGTGAATTTTTGCTGT |
| Пролифериращ клетъчен ядрен антиген (PCNA) | GATTCCACCACCATGTTCGAG | GATTCCACCACCATGTTCGAG |
| Каспаза 3 (CASP3) | GCCATGGTGAAGAAGGAAAA | GTCCGTCTCAATCCCACAGT |
| Туморен фактор на некроза Superfamily member 10 (TNFSF10) | ACCCAAAGGCTCAACAC | CCCACCTGAGATGGATCACT |
| Глицералдехид 3-фосфат дехидрогеназа (GAPDH) | GTGAAGGTCGGAGTGAACG | CTCGCTCCTGGAAGATGGTG |
| Вирус на свинска епидемична диария (PEDV) | GCACTTATTGGCAGGCTTTGT | CCATTGAGAAAAGAAAGTGTCGTAG |
2.5. Западно петно
Клетките се измиват два пъти със студен фосфатно буфериран физиологичен разтвор (PBS) и пробите от лизат се приготвят в 350 μL T-PER Tissue Protein Extraction Reagent (Thermo Scientific Pierce, Rockford, IL, USA) в присъствието на протеазен инхибиторен коктейл (Roche, Индианаполис, IN, САЩ) и се центрофугира при 20 000 × g в продължение на 20 минути при 4 ° C.
Протеините (20–50 μg) и белтъчните маркери се разделят чрез SDS-полиакриламидна електрофореза в 10% полиакриламидни гелове и се прехвърлят в мембрани от поливинилиден дифлуорид (PVDF) (Millipore, Madison, WI, USA). Петната бяха блокирани в 5% мляко в 0,1% буфериран с Tris физиологичен разтвор-Tween 20 (TBST) за 1 h при стайна температура. След това петна се инкубират с антитела срещу LTβR (1: 1000, Abcam, Cambridge, МА, САЩ) и β-актин (1: 2000, CST, Danvers, МА, САЩ) за една нощ при 4 ° С. Имунореактивните ленти бяха открити с помощта на Western Blotting Substrate с усилена хемилуминесценция (ECL) (Thermo Scientific Pierce, Rockford, IL, USA).
2.6. Клетъчно разпространение
За да се изследва клетъчната пролиферация, LTβR +/+ и LTβR -/- клетките се поставят в 96-гнездови плаки при 5 × 10 3 клетки на гнездо в 100 µL среда за клетъчна култура и се поддържат при 37 ° С в овлажнен инкубатор, съдържащ 5% CO2 . Пролиферацията се анализира на всеки 24 часа с комплект за преброяване на клетки-8 (комплект CCK-8, Beyotime Biotechnology, Шанхай, Китай) следвайки протокола на производителя.
2.7. Анализ на клетъчния цикъл
LTβR +/+ и LTβR -/- клетките се посяват в 6-ямкови плаки и серум гладуват за една нощ за синхронизация. На следващия ден се добавя серум към клетките и след 24 часа стимулация клетките се трипсинизират и фиксират в студен 70% етанол. След това клетките се инкубират при 4 ° С за минимум 45 минути до максимум една нощ. Впоследствие те се центрофугират при 1500 × g в продължение на 10 минути при 4 ° C и се суспендират отново в 0,4% пропидиев йодид (PI: съдържащ 50 μg/mL пропидум йодид със 100 μg/mL RNase A) за оцветяване. След това клетките бяха анализирани с цитометър LSR II (BD Biosciences, Сан Диего, Калифорния, САЩ) и интензивността на PI оцветяване беше определена от софтуера ModFit (BD Biosciences, Сан Диего, Калифорния, САЩ). Този анализ дава процента на клетките във фазите G1, S и G2.
2.8. Цифрова холомониторна микроскопия
Микроскопията HoloMonitor M4 (Phase Holographic Imaging AB, Лунд, Швеция) е цитометър със закъснителен образ, базиран на холографска микроскопия, осигуряващ изображения и количествено определяне на незацапани живи клетки директно в техните културни съдове. LTβR +/+ и LTβR -/- клетки се посяват в 6-ямкови плаки и се наблюдават в продължение на 72 часа. Апоптозата е анализирана от софтуера за проследяване Hstudio M4 (Scheelevägen, Швеция).
2.9. Статистически анализ
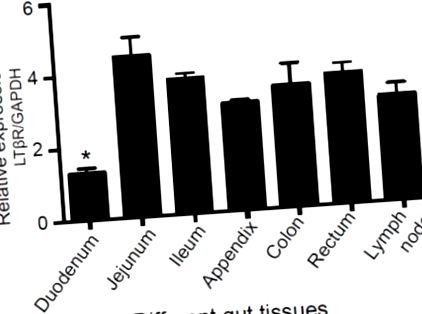
Експресия на лимфотоксин бета рецептора (LTβR) в различни свински тъкани на червата. Тъкани, включително дванадесетопръстника, йеюнума, илеума, апендикса, дебелото черво, ректума и лимфните възли, бяха събрани от възрастни мъжки големи бели прасета (n = 4) и PCR в реално време беше използван за измерване на нивото на експресия на LTβR. * p -/- Клетки, използващи CRISPR/Cas9
За да генерираме LTβR нокаут IPEC-J2 клетки, ние проектирахме две различни sgRNAs (L1 и L3), които са насочени към 32 bp области в екзон 2 на свинския LTβR ген (Фигура 2 A). Плазмидът pCAG-GFP се трансфектира съвместно с плазмидите pX330-L1 и pX330-L3 и единичните клетки се сортират в 96-ямкови плаки чрез поточна цитометрия. За определяне на мутации, медиирани от CRISPR-CAS9, бяха избрани 96 колонии и подложени на RFLP анализ (Фигура 2 Б). Нашите данни показват, че 10 клетъчни клонинги са билиалелно мутирани и ефективността на насочване е 10,4% (Фигура 2 B, C). За по-нататъшно валидиране на биалелната мутация, пет клетъчни клонинги, 1-10 #, 1-19 #, 1-22 #, 2-3 # и 6-18 #, бяха произволно избрани за ДНК секвениране (допълнителна фигура S1) и резултатите потвърдиха тези на RFLP. Освен това бяха сравнени аминокиселинните последователности от дивия тип 1-10 # клетъчен клон и нашите резултати демонстрираха изместена мутация в двата алела (допълнителна фигура S2).
3.3. LTβR нокаут инхибира разпространението на клетки IPEC-J2
За да се изследва потенциалният ефект на LTβR върху клетъчната пролиферация, се използва комплект CCK-8 за анализ на клетъчната пролиферация както в LTβR +/+, така и в LTβR -/- клетки. Както е показано на Фигура 3А, in vitro пролиферацията на LTβR -/- клетки беше значително инхибирана на 48 h (0.387 ± 0.023 срещу 0.189 ± 0.018 за LTβR +/+ и LTβR -/- клетки, съответно, p +/+ и LTβR -/- клетки, съответно, p -/- клетки (Фигура 3 Б). Тези резултати предполагат, че нокаутът на LTβR намалява клетъчния растеж in vitro.
3.4. LTβR нокаут предизвиква IPEC-J2 клетъчна апоптоза
Цифровата холографска микроскопия предлага предимство при изучаване на наблюденията в реално време на критични събития, като показва непрекъсната двумерна (2D) и 3D визуална картина на клетъчната активност на втори интервали. Голямо портфолио от количествени морфологични параметри, включително обем на оптичната клетка, дебелина, площ, неравномерност, ексцентричност и проследяване на единични клетки, могат да бъдат записани и анализирани [20]. Тук е използвана цифрова холографска микроскопия за проследяване на динамични дейности и морфологични промени на LTβR +/+ и LTβR -/- клетки в реално време в продължение на 72 часа. Резултатите показаха, че тези клетки показват различни характеристики на растеж. По-конкретно, много повече LTβR нулеви клетки от LTβR +/+ клетки показват увеличен клетъчен обем (вертикална ос) и намалена дебелина на клетъчната мембрана (хоризонтална ос) (Фигура 4 А, клетки между червените линии). Фигура 4 B показва 3D структурите на наблюдаваните живи LTβR +/+ клетки (Фигура 4 B, вляво) и LTβR -/- клетки (Фигура 4 B, вдясно). Ясно е, че LTβR -/- клетките с бял цвят са апоптотични, тъй като потокът от течности през апоптотичните клетъчни мембрани (неизправност в пропускливостта) води до увеличен обем на клетките и следователно изсветлените клетъчни мембрани отразяват различни цветове.
Ефектът на LTβR върху апоптозата на IPEC-J2. LTβR +/+ и LTβR -/- клетки се посяват в 6-ямкови плаки и апоптозата се проследява в продължение на 72 часа чрез HoloMonitor®M4 микроскопия. (A) Точкови график на LTβR +/+ и LTβR -/- IPEC-J2 клетки след 72 h култура. Оста x е средната дебелина (µM) на клетките, а оста y представлява повърхността на клетките (µM2). Апоптотичните клетки с по-малка дебелина и по-голяма повърхност са между червените линии. Забележете, че почти няма апоптотични клетки между червените линии за групата LTβR +/+ (вляво), докато значително повече апоптотични клетки се намират в LTβR -/- клетъчната популация (вдясно). (Б.) Триизмерни структури на живи LTβR +/+ (вляво) и LTβR -/- (вдясно) клетки след 72 часа. Броят на високите клетки значително се увеличава в LTβR -/- клетките. (° С) PCR данни в реално време на член на TNF от суперсемейство 10 (TNFSF10) и Caspase 3 (CASP3) в LTβR +/+ и LTβR -/- клетки, * p -/- клетки (Фигура 4 В).
3.5. LTβR нокаут IPEC-J2 клетки са податливи на PEDV
В обобщение, това проучване изследва ефекта на LTβR върху пролиферацията и апоптозата на IPEC-J2, както и неговата роля за PEDV инфекцията. Липсата на LTβR повишава чувствителността към PEDV инфекция в IPEC-J2 клетки, което може да бъде причинено от значително потиснати NFκB целеви гени (IL-6 и IL-8) и свързани с целостта на лигавицата бариери гени (VCAM1 и IL-22). Нашият in vitro клетъчен модел ще бъде полезен за по-доброто разбиране на биологичната функция на LTβR и клетъчните реакции на PEDV инфекцията.
- JC Virus Какво трябва да знаете за тази мозъчна инфекция
- Ако смятате, че аутопсията на дебела жена по телевизията ще реши епидемията от затлъстяване, вие; греши The
- Сокове за прочистване на клетките FOOD MATTERS®
- Високо ниво на хемоглобин, бели кръвни клетки и затлъстяване сред суданските жени в ранна бременност a
- Слушайте вашите чревни диарии Needed Gastroenterology Associates