Катедра по вътрешни болести, Югозападен медицински център на Тексаския университет, Далас, Тексас, САЩ
Изследователски медицински център, Канзас Сити, Мисури, САЩ
Отдел по кардиология, Югозападен медицински център на Тексаския университет, Далас, Тексас, САЩ
Адрес за кореспонденция: Ian J. Neeland, д-р, Югозападен медицински център на Тексаския университет, 5323, бул. Хари Хайнс, Далас 75390‐8830, Тексас, САЩ. E-mail: [email protected] Потърсете още статии от този автор
Катедра по вътрешни болести, Югозападен медицински център на Тексаския университет, Далас, Тексас, САЩ
Изследователски медицински център, Канзас Сити, Мисури, САЩ
Отдел по кардиология, Югозападен медицински център на Тексаския университет, Далас, Тексас, САЩ
Адрес за кореспонденция: Ian J. Neeland, д-р, Югозападен медицински център на Тексаския университет, 5323, бул. Хари Хайнс, Далас 75390‐8830, Тексас, САЩ. E-mail: [email protected] Потърсете още статии от този автор
Обобщение
Обективен
Да се направи преглед на ефикасността, безопасността и клиничната приложимост на лираглутид за управление на теглото от фаза III клинични изпитвания.
Методи
Извършено е търсене на литературата на английски език, като се използват термини за търсене в PubMed: „лираглутид“, „глюкагон-подобен пептид-1 рецепторен агонист“ и „рандомизирано клинично изпитване“. Прегледани бяха статии и библиографии, свързани с темата, и бяха включени допълнителни препратки, известни на авторите.
Резултати
Идентифицирани са пет рандомизирани, плацебо-контролирани проучвания на лираглутид за контрол на теглото. В допълнение към препоръчаната диета и физическа активност, лираглутидът постоянно води до загуба на тегло от 4 до 6 kg, като по-голям дял от пациентите постигат поне 5 и 10% загуба на тегло в сравнение с плацебо. Най-честите нежелани реакции са стомашно-чревни и се появяват предимно в началото на курса на лечение. Сравнителните данни показват, че загубата на тегло при лираглутид е по-голяма от тази, наблюдавана при орлистат или лоркасерин, но малко по-малка от тази при фентермин/топирамат. Наскоро беше доказано, че Liraglutide 1,8 mg има сърдечно-съдови ползи в голямо проучване на резултатите; понастоящем не е известна приложимостта на тези резултати за формулировката от 3,0 mg при по-разнообразна популация за отслабване с висок сърдечно-съдов риск. Пречките пред реалната клинична употреба като средство от първа линия включват стомашно-чревни странични ефекти, висока цена и нужда от инжектиране.
Заключения
Лираглутид помага да се предизвика и поддържа загуба на тегло при пациенти със затлъстяване. Ефективността му е сравнима с други налични средства, но предлага уникалната полза от подобрения гликемичен контрол. Необходими са допълнителни проучвания, за да се определи неговият дългосрочен профил на ефикасност и безопасност.
Въведение
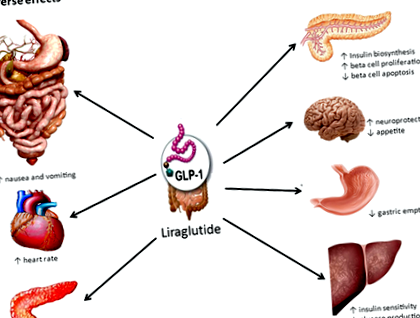
Лираглутид е глюкагон подобен на пептид-1 (GLP ‐ 1) рецепторен агонист, предлаган на пазара като Saxenda® и Victoza®. Victoza® е 1,8 mg дневно подкожно инжектиране на лираглутид, което първоначално е одобрено от FDA през 2010 г. като допълнителна терапия към диета и упражнения за лечение на диабет тип 2. Резултати от клинични изпитвания многократно демонстрираха способността на GLP ‐ 1 аналозите да предизвикват загуба на тегло 2. В резултат на това лираглутидът също е разработен като средство за отслабване и неговата доза от 3,0 mg дневно показва обнадеждаващи резултати в множество клинични изпитвания фаза III (вж. По-долу) 3-8 Saxenda® (лираглутид 3.0 mg дневно подкожно инжектиране) е най-новото одобрено от FDA лекарство за хронично управление на теглото при пациенти със затлъстяване или с наднормено тегло с ИТМ ≥27 kg/m 2 и свързано с теглото коморбидно състояние 9 .
Ефикасност и безопасност на лираглутид във фаза III клинични изпитвания
Проведени са пет широкомащабни рандомизирани многоцентрови проучвания фаза III за оценка на ефикасността на лираглутид като средство за отслабване 3-8. Четири от тях са част от доказателствата за ситост и клинично затлъстяване - лираглутид при недиабетни и диабетици (SCALE). Съответните характеристики на проучването, интервенциите и резултатите за ефикасност и безопасност за петте проучвания са представени в таблица 1.
Astrup et al 3 2009
Продължителност: 20 седмици
Лираглутид 1,2 mg (N = 95)
Лираглутид 1,8 mg (N = 90)
Лираглутид 2,4 mg (N = 93)
Лираглутид 3,0 mg (N = 93)
Телесно тегло: -4,4 kg (95% CI: -6,0 до -2,9 kg, p 4 2012
(Резултатите са цензурирани след 1 година)
Лираглутид 1,2 mg (N = 95)
Лираглутид 1,8 mg (N = 90)
Лираглутид 2,4 mg (N = 93)
Лираглутид 3,0 mg (N = 93)
Телесно тегло: -5,8 kg (95% CI: -8,0 до -3,7 kg, p ≤ 0,001)
≥5% загуба на телесно тегло: 73% спрямо плацебо 28% (p ≤ 0,001)
≥10% загуба на телесно тегло: 37% спрямо плацебо 10% (p ≤ 0,001)
Болка в горната част на корема (5,4%)
Продължителност: 56 седмици
Лираглутид 3,0 mg (N = 212)
Телесно тегло: -5,9 кг (95% ДИ: -7,3 до -4,4 кг, стр. 6
Продължителност: 56 седмици
Лираглутид 3,0 mg (N = 2487)
Плацебо (N = 1244)
Телесно тегло: -5,6 кг (95% ДИ: -6,0 до -5,1 кг, стр. 7
Продължителност: 56 седмици
Лираглутид 3,0 mg (N = 423)
Лираглутид 1,8 mg (N = 211)
Телесно тегло: -4,2 кг
Телесно тегло: -4,0% (95% ДИ: -5,1 до -2,9%, стр. 8
Продължителност: 32 седмици
Лираглутид 3,0 mg (N = 180)
Телесно тегло: -4,9 кг (95% ДИ: -6,2 до -3,7 кг, стр
NN8022‐1807 - Първото клинично изпитване фаза III
Първото голямо проучване на фаза III за изследване на лираглутид е проведено при пациенти с индекс на телесна маса (ИТМ) между 30 kg/m 2 и 40 kg/m 2 в осем европейски страни 3. Проучването сравнява ефектите на четири различни дози лираглутид (1,2 mg, 1,8 mg, 2,4 mg и 3,0 mg, инжектирани подкожно веднъж дневно) с плацебо (веднъж дневно подкожно инжектиране) и отворен активен компаратор, орлистат (120 mg три пъти на ден през устата) 3. Лица с диабет тип 1 или 2, основни медицински проблеми, индуцирано от наркотици затлъстяване, тези, които използват друга фармакотерапия за понижаване на теглото, включени в клинично проучване за контрол на теглото през последните 3 месеца и получатели на бариатрична хирургия са изключени 3. Проучването се състои от скринингово посещение, двуседмичен период на еднократно сляпо плацебо, период на титриране на дозата от 4 седмици, последван от период на постоянна доза от 16 седмици 3. На всички участници беше предписана интервенция за начин на живот по време на периода на лечение (включително 2-седмичната фаза на въвеждане), за да се включи диета с енергиен дефицит от 500 kcal на ден (въз основа на прогнозни 24-часови енергийни разходи) и консултации за повишена физическа активност с помощта на крачкомери. Първичната крайна точка е промяна в телесното тегло сред популацията с намерение за лечение (ITT) в края на 20 седмици 3 .
Очакваната средна загуба на тегло в популацията с ITT е значително по-голяма при всички дози лираглутид в сравнение с плацебо (4,8 kg, 5,5 kg, 6,3 kg и 7,2 kg за лираглутид съответно 1,2 mg, 1,8 mg, 2,8 mg и 3,0 mg, съответно срещу 2,8 kg за плацебо; p 3 Участниците, получаващи 2,4 mg и 3,0 mg лираглутид, са загубили значително повече тегло от тези, получаващи орлистат (6,3 kg и 7,2 kg спрямо 4,1 kg, p 4. От 564 пациенти, включени в проучването, 398 ( 71%) влязоха в удължаването. Изследователите и участниците бяха заслепени за назначението на лечението на 1 година и участниците бяха преминали към лираглутид 2,4 mg и впоследствие на доза от 3,0 mg между седмици 70 и 96. За популацията от ITT с последно наблюдение По-нататък (LOCF), коригирана с плацебо средна загуба на тегло за лираглутид 3,0 mg е 5,8 kg в края на първата година.
Програмата SCALE - SCALE Maintenance trial
От 551 участници, които са се включили, 422 (77%) са загубили повече от 5% от скрининговото телесно тегло и са били рандомизирани на лираглутид 3,0 mg или плацебо. Групата с лираглутид има значително по-голямо намаляване на телесното тегло в сравнение с плацебо (6,2% срещу 0,2%, p
МАШИНА Проба за затлъстяване и преддиабет
Проучването SCALE за затлъстяване и преддиабет е голямо, рандомизирано, двойно-сляпо, плацебо-контролирано проучване, проведено в продължение на период от три години (първоначален период от 56 седмици, последван от 2-годишно удължаване при пациенти с преддиабет в началото), предназначено да тества хипотезата, че лираглутид може да постигне значителна загуба на тегло при голяма и разнообразна популация от пациенти, живеещи по целия свят 6. Хора с ИТМ ≥30 kg/m 2 или ≥27 kg/m 2 с лекувана или нелекувана дислипидемия или хипертония бяха рандомизирани в съотношение 2: 1, за да получават веднъж дневно подкожни лираглутид 3.0 mg инжекции или плацебо. Режимът на дозиране е подобен на предходните изпитвания и двете групи са получили консултации за промени в начина на живот. Пациенти, отговарящи на критериите за изключване от изпитването за поддържане на SCALE, и тези с лична или фамилна анамнеза за множествена ендокринна неоплазия 2 (MEN 2) или фамилен медуларен карцином на щитовидната жлеза (MTC) бяха изключени. На 56-та седмица ко-първичните крайни точки бяха промяна в телесното тегло спрямо изходното ниво, дял на участниците, загубили най-малко 5% телесно тегло, и дял на участниците, загубили поне 10% телесно тегло от рандомизиране.
Данните, съобщени по-долу, се отнасят до резултати от първоначалния 56-седмичен период на изпитването. Пациентите, рандомизирани на лираглутид, са имали значително по-голямо намаление на средното телесно тегло (8,0% срещу 2,6%, стр. 21. На 160-та седмица 1,8% пациенти, лекувани с лираглутид 3,0 mg, са развили диабет тип 2 в сравнение с 6,2% в плацебо групата. Рискът от развитие на диабет тип 2 е намален с 79% с лираглутид (съотношение на риска 0,21, стр. 21. Резултатите от това проучване потвърждават приложимостта на лираглутид като средство за отслабване, което подобрява различни кардио-метаболитни параметри и забавя появата на типа 2 диабет.
МАШИНА Проба за диабет
Проучването SCALE Diabetes е рандомизирано, двойно-сляпо, плацебо-контролирано, паралелно-групово проучване, предназначено да оцени ефикасността на лираглутид при пациенти със захарен диабет тип 2. Проведено е в продължение на 56 седмици с 12-седмичен период на проследяване на лекарството 7. Лица с ИТМ от най-малко 27 kg/m 2 и диабет тип 2 (HbA1c 7,0 до 10,0%) са изследвани за рандомизация. От 1361 участници, проверени за допустимост, 846 са рандомизирани в съотношение 2: 1: 1 спрямо лираглутид 3,0 mg, лираглутид 1,8 mg и плацебо групи. Режимът на дозиране следваше стандартния протокол и всички участници бяха насърчавани да следват интервенции в начина на живот през цялото време на изпитването. Критериите за изключване бяха подобни на проучването SCALE за затлъстяване и преддиабет. Ко-първичните крайни точки са относителна промяна в телесното тегло и делът на участниците, загубили най-малко 5% и 10% от рандомизираното телесно тегло.
Пациентите в групите с лираглутид 3,0 mg, лираглутид 1,8 mg и плацебо са имали средна загуба на тегло съответно 6,0% (6,4 kg), 4,7% (5,0 kg) и 2,0% (2,2 kg) в края на 56 седмици. Загубата на тегло при двете дози лираглутид е значително по-голяма от тази при плацебо (p 22, са по-чести в групата с лираглутид 3,0 mg, отколкото при плацебо (44,5% срещу 27,4%). Средното увеличение на честотата на пулса е значително по-високо и при двете дози лираглутид, отколкото при плацебо (стр
МАСШТАП съдебна апнея
Изпитването SCALE Sleep Apnea е 32-седмично рандомизирано, двойно-сляпо, плацебо-контролирано проучване, проведено в САЩ и Канада 8. Хора с диагноза умерена или тежка обструктивна сънна апнея чрез полисомнограма, които не желаят или не могат да използват лечение с непрекъснато положително налягане в дихателните пътища (CPAP) и имат ИТМ ≥ 30 kg/m 2, са рандомизирани в съотношение 1: 1, за да получават веднъж дневно подкожни инжекции лираглутид 3,0 mg или плацебо. Дозирането е следвано по стандартния протокол и двете групи са получили консултации относно модификациите на начина на живот. Лицата с диабет бяха изключени. Изследване на съня е проведено при скрининг на 12 седмици и в края на проучването на 32 седмици. Първичната крайна точка е промяна в индекса на апнея-хипопнея (AHI). Вторичните резултати включват промени в телесното тегло и гликемичния контрол. Пациентите, рандомизирани в група с лираглутид 3.0 mg, са имали значително по-голямо намаление на средното телесно тегло (5.7% спрямо 1.6%), имали са по-голям дял от пациентите, загубили поне 5% (46.3% срещу 18.5%) и 10% (23.4% спрямо 1,7%) от първоначалното телесно тегло в сравнение с плацебо (стр
Резултати за безопасността
Лираглутид и сърдечно-съдови резултати - LEADER проучване
През последното десетилетие американската FDA определи фармацевтичните компании да докажат, че всяко ново лекарство за диабет не увеличава риска от сърдечно-съдови събития. Първичната крайна точка обикновено е сравнение с неинфериорност с плацебо, често с предварително уточнена забележка, която трябва да бъде постигната, ако в последствие се направи тест за превъзходство, впоследствие се провежда тест за превъзходство. Ръководството на FDA, издадено през 2008 г. 25, изисква горна граница на предварително одобрение на двустранния 95% интервал на доверие за големи неблагоприятни сърдечно-съдови събития под 1,80 и горна граница след одобрение под 1,30. В този контекст наскоро бяха съобщени сърдечно-съдови ефекти на лираглутид, добавен към стандартната терапия при пациенти с диабет тип 2 26 .
В голямо, многоцентрово, двойно сляпо проучване, 9340 пациенти с диабет тип 2 и висок сърдечно-съдов риск са рандомизирани да получават лираглутид 1,8 mg дневно или плацебо и са проследени в продължение на 3,8 години. Първичният композитен резултат е смърт от сърдечно-съдови причини, нефатален инфаркт на миокарда или нефатален инсулт. Първичният резултат се наблюдава при значително по-малко пациенти в групата на лираглутид (13,0%), отколкото в групата на плацебо (14,9%), HR 0,87, 95% CI 0,78 до 0,97); стр
Сравнение на Liraglutide с други средства за отслабване
Указания от Американската асоциация по сърдечни заболявания/Американски колеж по кардиология/Обществото за затлъстяване препоръчват използването на многофакторен подход за управление на затлъстяването 28. Това включва започване на цялостни програми за намеса в начина на живот и фармакотерапия при лица с ИТМ ≥ 30 kg/m 2 или ≥ 27 kg/m 2 с коморбидни състояния като диабет тип 2, хипертония, дислипидемия или обструктивна сънна апнея, ако модификацията на начина на живот не е ефективна 29. Лираглутид може да бъде особено ефективен избор сред пациенти със затлъстяване с диабет тип 2 и може да се обмисли за тези с висок риск от сърдечно-съдови заболявания, като се има предвид благоприятен сигнал за сърдечно-съдовите резултати, наблюдавани в състава от 1,8 mg при популация от диабет; обаче ефектите от формулата от 3,0 mg върху сърдечно-съдовата заболеваемост и смъртност не са установени. Важно е да се отбележи, че безопасността и ефикасността на едновременното приложение на лираглутид с други средства за отслабване не е проучена и не е известно дали ефектите могат да бъдат синергични или дали страничните ефекти биха ограничили едновременната употреба. По-нататъшни проучвания на фармакологичните комбинирани терапии могат да бъдат оправдани.
Заключение
Финансиране
Д-р Нийланд е подкрепен с безвъзмездна помощ K23DK106520 от Националния институт по диабет и храносмилателни и бъбречни заболявания/Национални здравни институти и от стипендия на Dedman Family за клинична помощ от UT Southwestern.
Конфликт на интереси
Д-р Мехта и д-р Ниланд не декларират конфликт на интереси. Д-р Марсо е получавал безвъзмездни средства за научни изследвания и/или консултантски такси от Amylin и Novo Nordisk.
- Консумацията на кисело мляко е свързана с резултатите от управлението на теглото Резултати от систематичен преглед -
- Keto Quick Slim Medi Отзиви за отслабване 2017 Магазин - Управление на HazMat
- Henry Ford Wyandotte Управление на теглото Отслабване Хенри Форд Здравна система - Детройт, Мичиган
- LEFAY ИНТЕНЗИВНО УПРАВЛЕНИЕ НА ТЕГЛОТО Lefay Resort; SPA Lago Di Garda (Италия) Лечебни празници
- Билкови хапчета за отслабване Vital Max Keto Fat Fass Factor Factor Review (2019) Може ли да ви помогне да отслабнете