Юки Джанг
† Съвместна катедра по биомедицинско инженерство, Университет на Северна Каролина в Чапъл Хил и Държавен университет в Северна Каролина, Роли, Северна Каролина 27695, САЩ
‡ Център за нанотехнологии в доставката на лекарства и Отдел по молекулярна фармацевтика, UNC Eshelman School of Pharmacy, Университет на Северна Каролина в Chapel Hill, Chapel Hill, Северна Каролина 27599, САЩ
Qiongming Liu
§ Катедра по патология и клетъчна биология, Център за диабет Наоми Бери, Колумбийски университет, Ню Йорк, Ню Йорк 10032, САЩ
Jicheng Yu
† Съвместна катедра по биомедицинско инженерство, Университет на Северна Каролина в Чапъл Хил и Държавен университет на Северна Каролина, Роли, Северна Каролина 27695, САЩ
‡ Център за нанотехнологии в доставката на лекарства и Отдел по молекулярна фармацевтика, UNC Eshelman School of Pharmacy, Университет на Северна Каролина в Chapel Hill, Chapel Hill, Северна Каролина 27599, САЩ
Shuangjiang Yu
† Съвместна катедра по биомедицинско инженерство, Университет на Северна Каролина в Чапъл Хил и Държавен университет в Северна Каролина, Роли, Северна Каролина 27695, САЩ
‖ Ключова лаборатория за полимерни екоматериали, Институт по приложна химия в Чанчун, Китайска академия на науките, Чанчун, Дзилин 130022, Китай
Jinqiang Wang
† Съвместна катедра по биомедицинско инженерство, Университет на Северна Каролина в Чапъл Хил и Държавен университет в Северна Каролина, Роли, Северна Каролина 27695, САЩ
Ли Цян
§ Катедра по патология и клетъчна биология, Център за диабет Наоми Бери, Колумбийски университет, Ню Йорк, Ню Йорк 10032, САЩ
Жен Гу
† Съвместна катедра по биомедицинско инженерство, Университет на Северна Каролина в Чапъл Хил и Държавен университет в Северна Каролина, Роли, Северна Каролина 27695, САЩ
‡ Център за нанотехнологии в доставката на лекарства и Отдел по молекулярна фармацевтика, UNC Eshelman School of Pharmacy, Университет на Северна Каролина в Chapel Hill, Chapel Hill, Северна Каролина 27599, САЩ
⊥ Катедра по медицина, Университет на Северна Каролина в Chapel Hill, Chapel Hill, Северна Каролина 27599, САЩ
Свързани данни
Резюме
Затлъстяването е един от най-сериозните проблеми на общественото здраве през 21 век, който може да доведе до много съпътстващи заболявания като диабет тип 2, сърдечно-съдови заболявания и рак. Текущите лечения за затлъстяване, включително диета, физически упражнения, фармакологична терапия, както и операции са винаги свързани с ниска ефективност или нежелани системни странични ефекти. За да подобрим ефективността на лечението с минимизирани странични ефекти, ние разработихме пластир за транскутанно потъмняване, за да индуцираме локално трансформация на мастната тъкан. Този пластир, базиран на микроигли, може ефективно да доставя потъмняващи агенти до подкожните адипоцити по устойчив начин и да включва „потъмняването“ в целевата област. Демонстрирано е, че този пластир намалява размера на лекуваната мастна подложка, увеличава енергийните разходи на цялото тяло и подобрява диабета тип 2 in vivo в модел на мишка, предизвикана от затлъстяване.
Графичен резюме
Затлъстяването е класифицирано като болест от Американската медицинска асоциация през 2013 г. и е признато за един от най-сериозните проблеми на общественото здраве през 21 век, свързан с бързото глобално социално-икономическо развитие. 1 Нарушенията, свързани със затлъстяването, като диабет тип 2, сърдечно-съдови заболявания и рак, се превърнаха в глобална заплаха за човешкото здраве. По-специално в Съединените щати повече от една трета от възрастното население е със затлъстяване и разпространението ще скочи през следващите десетилетия. 2 Текущото лечение на затлъстяването включва ограничаване на приема на калории чрез диетични програми, насърчаване на енергийните разходи чрез физически упражнения, фармакологична терапия, както и бариатрични операции и липосукция. 3,4 Въпреки това, повечето терапевтични средства идват с нежелани странични ефекти върху човешки органи като гастроинтестин, черен дроб и бъбреци, 5,6 и операциите имат висок риск. 7 Следователно има спешно изискване да се използват ефективни методи за лечение на затлъстяването.
Неотдавнашни проучвания разкриха решаваща роля на кафявата мастна тъкан (НДНТ), основен орган за генериране на топлина, в енергийните разходи при бозайниците. 8,9 Известно е, че запасите от бяла мастна тъкан (WAT) надвишават енергията като триглицериди, което води до наддаване на тегло; като има предвид, че НДНТ разсейва енергията чрез производство на топлина чрез неподвижна термогенеза, което може да улесни потискането на затлъстяването. 10 Трансформацията на WAT в BAT осигурява алтернативен подход за лечение на затлъстяването и свързаните с него метаболитни нарушения, който привлича все по-голямо внимание през последното десетилетие. 11–13 Идентифицирани са разнообразни гени и пътища, които регулират развитието на адипоцити. 4,14 Въпреки това, многобройни средства за потъмняване, които могат да насърчат „потъмняване“ на WAT, се сблъскват с предизвикателства в клиничното приложение поради нежелани странични ефекти върху други органи в резултат на широкия спектър на насочване. 15–17
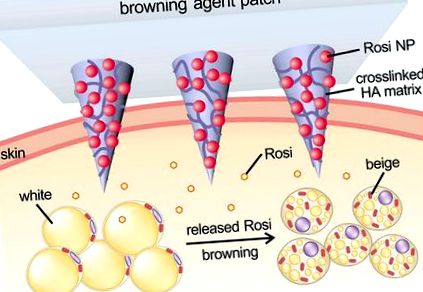
Тук ние съобщаваме за локално индуцирана технология за потъмняване, която се основава на разградим пластир с микроигли (MN), състоящ се от наночастици (NPs), заредени с лекарства и омрежена матрица (Фигура 1). Розиглитазон (Rosi) или CL 316243 се зарежда в NP като моделен агент за покафеняване. 18 НП могат да бъдат допълнително интегрирани в микродермално (MN) трансдермално устройство за трайно доставяне на лекарство в подкожната мастна тъкан. Пластирът MN осигурява локализиран, удобен и безболезнен метод на приложение. 19–22 В модел на мишка демонстрирахме, че този пластир с MN може да предложи локално доставяне на кафяви реагенти по безопасен и ефективен начин за инхибиране на хипертрофията на адипоцитите и последващото подобряване на метаболизма.
Схематична илюстрация на наситения с реагенти транскутанен MN пластир. Наночастиците (NP), капсулиращи розиглитазон (Rosi), глюкозна оксидаза (GOx) и каталаза (CAT), се приготвят от чувствителен на рН ацетално модифициран декстран и се покриват с алгинат. NPs се зареждат допълнително в пластира с микроиглена решетка, направен от омрежена матрица на хиалуроновата киселина (HA) за кафяво ремоделиране на бялата мазнина.
РЕЗУЛТАТИ И ДИСКУСИЯ
Синтез и характеризиране на натоварени с Рози NP.
Изработване и охарактеризиране на коригиращ агент MN-Array Patch.
NPs бяха допълнително вградени в полимерен пластир MN-масив за локално доставяне на реагенти за покафеняване. Накратко, NPs първо се зареждат в областта на върха на силиконова MN-форма чрез центрофугиране, след това с добавяне на основен разтвор. Като основен материал е избрана метакрилирана хиалуронова киселина (m-HA), като се има предвид нейната добра биосъвместимост и механични свойства. 31,32 Основният разтвор на m-HA, смесен с омрежител N, N′-метиленбис (акриламид) (MBA) и фотоинициатор, беше допълнително омрежен чрез реакция на полимеризация при излагане на UV светлина (365 nm, 9 mW/cm 2 за 30s). Омрежената матрица, базирана на HA, може да повиши сковаността на MN (Фигура S2) за ефективно проникване през кожата 19,33, както и да позволи продължително освобождаване на лекарството от MN върховете, което помага да се поддържат местни конститутивни високи концентрации на лекарството в мастни тъкани. MN-редицата съдържа 121 игли в пластир 7 × 7 mm 2 с интервал от центъра до центъра от 600 μm. Всеки MN беше с конусовидна форма, с диаметър 300 μm в основата и 800 μm височина (Фигура 2h). Увеличеното SEM изображение потвърждава разпределението на NP в върха (Фигура 2i).
In Vivo изследвания на МН върху постни мишки.
Индукция на покафеняване in vivo от MN петна при слаби мишки. (а) H & E оцветена част на ингвиналната мастна тъкан на напречното сечение на мишката, третирана с HA празен MN пластир (вляво), натоварен с Rosi NP MN пластир (в средата) и CL 316243 NP-натоварен MN пластир (вдясно) (скала: 25 μm). (b) Q-PCR анализ на генната експресия в ингвинална WAT, третирана с MN пластири, заредени с HA празен носител (EV), Rosi или CL 316243 (CL). NP зареден MN пластир. Лентите за грешки показват стандартна грешка на средната стойност (SEM), двустранен t-тест на Student, * P Фигура 4а). 39–41 По-голямата им загуба на телесно тегло се дължи на намалената мастна маса, особено на висцералния епидидимен WAT (eWAT) (Фигура 4b, c). ° С ). Промените в енергийната хомеостаза са причинени само от енергийните разходи, тъй като нито Rosi MN, нито CL 316243 са повлияли на приема на калории (Фигура 4г). Поразително е, че и двете лечения увеличават консумацията на кислород (Фигура 4f) в резултат на индуцирано покафеняване (Фигура 3). За разлика от CL 316243 MN, Rosi MN намалява двигателната активност по време на тъмния цикъл, когато мишките са по-активни (Фигура 4д), в съответствие с техните отделни механизми за покафеняване. Освен това, както Rosi, така и CL 316243 намаляват обменното съотношение на дишането (RER) (Фигура 4g), отразено от отделяния CO2/консумиран O2, което показва предпочитанието им към използването на мастни киселини след покафеняване, тъй като за пълно окисляване на въглехидратите са необходими само 75% кислород в сравнение с мастните киселини (съотношение 3: 4). Взети заедно, нашите калориметрични проучвания напълно подкрепят схващането, че доставянето на MN на реагентите за покафеняване на Rosi или CL 316243 е ефективен начин за предизвикване на покафеняване и подобряване на метаболизма.
15% инхибиране в края на това четириседмично лечение (Фигура 5b). Както Rosi MN, така и CL 316243 MN ефективно подобряват скоростта на глюкозния клирънс след инжектиране на болус на глюкоза, наречен интраперитонеален тест за толерантност към глюкоза (IPGTT) (Фигура 5в) и намаляват нивата на глюкоза в кръвта на гладно (диагностичен индикатор за диабет) от 140 mg/dL при контролни мишки до
110 mg/dL (Фигура 5г), което показва подобрение на инсулиновата чувствителност. Интригуващо е, че това подобрение е причинено от потъмняване, а не от сенсибилизиращата функция на инсулина на самата Rosi, тъй като CL 316243 показва същия ефект. Като последица от увеличеното покафеняване и използването на липиди, както виждаме на Фигура 4, наблюдавахме a
30% намаление на eWAT (Фигура 5д), но не и в класическия междулопаточен НДНТ (Фигура 5е). По-важното е, че MN доставянето на средства за потъмняване намалява локално ингвиналната мастна подложка. Размерите на третираните страни, или чрез Rosi MN, или CL 316243 MN, бяха намалени в сравнение с необработената страна (EV-R или EV-C) (Фигура 5g, h). з). В подкрепа на това, H&E оцветените разрези разкриват очевидно по-малки адипоцити в ингвиналната WAT само в групите, прилагани с лепенки, съдържащи лекарство, но не се наблюдава очевидно покафеняване на другото място, инжектирано с празни пластири (Фигура 5i). Кафявите адипоцитни гени са по-силно индуцирани в третираната страна, особено от Rosi MN (Фигура 5j), което показва ограничен ефект на покафеняване на MN пластирите. Като индикатор за подобрено здраве на мастната система, Adiponectin беше регулиран нагоре както в Rosi MN, така и в CL 316243 MN, третирана страна (Фигура 5j). Докато целта PPARγ надолу по веригата aP2 е индуцирана само от MN Rosi (Фигура 5j), допълнително подкрепяща локален ефект на MN пластира. Освен това, както е представено в H&E оцветени хистологични изображения на кожата на мишката, заобикаляща третираната с MN област след едномесечно приложение, има незначителни лезии в кожата, което показва отлична биосъвместимост на MN пластирите (Фигура S6).
In vivo затлъстяване и антидиабетни ефекти на MN пластири в HFD-индуциран модел на затлъстели мишки. (а) Снимка, илюстрираща мишките, лекувани с петна от кафяв агент от едната ингвинална страна (червена) и празен пластир от другата страна (синя). (b) Нормализирано телесно тегло на мишки без третиране или третиране с петна с кафяв агент. (c) IPGTT тест при мишки 2 седмици след третирането. (г) Нива на кръвната глюкоза при мишки, лекувани с петна или празни пластири след 16 часа на гладно. (д) Нормализиран размер на епидидималната мастна подложка при мишки с различни лечения. (е) Нормализирано тегло на размера на междулопаточната мастна подложка при мишки с различни лечения. (g) Съотношение на размера на обработената ингвинална мастна подложка към необработената страна. (h) Снимки на две страни на ингвинална мастна тъкан от затлъстели мишки 4 седмици след лечението. (i) H&E оцветяване на ингвинална мастна тъкан (скала: 50 μm). (j) Q-PCR анализ на експресията на адипоцитни гени в ингвиналните тъкани. (b − g) Лентите за грешки показват SD, двустранен t-тест на Student, * P 42,43
МЕТОДИ
Материали.
Всички химикали са закупени от Sigma-Aldrich, освен ако не е посочено друго и са използвани както са получени. Розиглитазон е поръчан от Abcam (Кеймбридж, Масачузетс). CL 316243 е закупен от Cayman Chemical (Ann Arbor, MI). Дейонизираната вода се приготвя чрез система за пречистване Millipore NanoPure (съпротивление по-високо от 18,2 MΩ cm -1).
Приготвяне на заредени с розиглитазон наночастици декстран.
Проучвания за освобождаване in vitro.
Профилът на in vitro освобождаване на Rosi от декстран наночастици беше оценен чрез инкубация на наночастици в 1 mL PBS буфер (NaCl, 137 mM; KCl, 2.7 mM; Na2HPO4, 10 mM; KH2PO4, 2 mM; pH 7.4) при 37 ° C върху орбитален шейкър, към който са добавени 100 mg/dL глюкоза, за да достигне нормогликемично ниво в човешкото тяло. В предварително определени моменти от време пробата се центрофугира (10000 rpm, 1 min) и 10 μL от супернатантата се изважда за анализ чрез измерване на UV-vis абсорбцията при 317 nm с помощта на Nanodrop 2000C спектрометър.
Изработване на пластир MN за коричнев агент.
In vivo проучвания на Браунинг при слаби мишки.
Използвани бяха осемседмични мъжки мишки C57BL/6, поръчани от Charles River (Raleigh, NC) или лабораторията Jackson. Протоколите за изследване на животни са одобрени от Институционалния комитет за грижи и употреба на животните в Държавния университет на Северна Каролина и Университета на Северна Каролина в Чапъл Хил или от Комитета за грижа и използване на животните в университета в Колумбия. Мишките бяха поставени в клетка при 22 ± 1 ° C със свободен достъп до вода и редовна чау-диета на 12-часов цикъл светлина/тъмнина. Мишките получиха адаптация най-малко 1 седмица преди експерименти. Три групи животни (n = 6) бяха лекувани с празен пластир HA MN (EV), натоварен с Rosi NP MN пластир (10 mg/kg) (Rosi) или> CL316243 NP, натоварен MN пластир (1 mg/kg) (CL), съответно, в ингвиналните области на всеки 3 дни. За непреки калориметрични изследвания мишките са били подложени на Комплексната лабораторна система за наблюдение на животните (CLAMS). По време на лечението се наблюдават метаболитни дейности, включително консумация на кислород, прием на храна, двигателна активност и телесно тегло. Шест дни след приложението, животните се умъртвяват и ингвиналните мастни тъкани се събират за хистологичен и РНК анализ. Интерскапуларната НДНТ и епидидималната WAT бяха претеглени.
Браунинг MN лечения с пластир върху диети, предизвикани от затлъстяване на мишки.
Мъжки мишки C57BL/6 са хранени с HFD (60% kcal от мазнини) в продължение на 8 седмици, за да предизвикат затлъстяване и инсулинова резистентност. Три групи с по пет мишки за всяка група бяха лекувани с празен HA, Rosi (10 mg/kg) или> CL316243 (1 mg/kg) чрез трансдермален пластир от едната страна на ингвиналните области под изофлуранова анестезия. Другата страна на ингвиналната тъкан на всяка мишка се администрира с празен пластир от микроигла на HA. Пластирът се сменя на всеки 3 дни в продължение на 4 седмици. По време на периода на лечение се проследява телесното тегло. Тестът за толерантност към глюкозата се провежда при мишки 3 седмици след лечението. Мишките са гладували в продължение на 16 часа (една нощ) преди приложение на глюкоза. Мишките бяха интраперитонеално инжектирани с глюкоза при 2 g/kg, разредена в PBS, и нивата на кръвната глюкоза бяха проследявани с течение на времето. В края на 4-седмичното лечение с MN животните бяха евтаназирани чрез задушаване на CO2 и бяха събрани мастни тъкани (ингвинална WAT, епидидимна WAT и интерскапуларна BAT) за анализи. Кожните тъкани около третираните области също бяха събрани за оценка на биосъвместимостта на MN пластирите.
Допълнителен материал
гъвкава информация
ПРИЗНАВАНИЯ
Тази работа беше подкрепена с безвъзмездна помощ от NC TraCS, наградите за клинична и транслационна наука на NIH (CTSA, NIH Grant No. 1UL1TR001111) в UNC-CH, и NIH Grant Nos. R00DK97455 (L.Q.) и P30DK063608 (L.Q.). Признаваме използването на Аналитичния инструментариум (AIF) в NC State, който се поддържа от Щат Северна Каролина и Националната научна фондация (NSF). Тестовете за деформация са направени с помощта на DTS деламинатор, подкрепен от UNC Research Opportunity Initiative. Всички животни са били третирани в съответствие с Ръководството за грижа и използване на лабораторни животни, одобрено от Институционалния комитет за грижи и употреба на животните (IACUC) към Университета на Северна Каролина в Чапъл Хил и Държавния университет на Северна Каролина, или от Колумбийския университет за грижа за животните и Комитета за използване.
Бележки под линия
Поддържащата информация е достъпна безплатно на уебсайта на публикациите на ACS на адрес DOI: 10.1021/acsnano.7b04348.
Поддържащ експериментален раздел, таблица S1 и фигури S1-S6, както е отбелязано в текста (PDF)
Авторите не декларират конкурентен финансов интерес.
- Инсулиновият рецепторен субстрат-1 инхибира затлъстяването, предизвикано от диета с високо съдържание на мазнини, чрез покафеняване на бял мастен
- Механизъм на потискане на затлъстяването от енергията на креатина в мастната тъкан - Казак - 2018 - The FASEB
- Диетата с високо съдържание на мазнини диференцирано влияе върху възпалението на мастната тъкан и размера на адипоцитите в
- Влияние на затлъстяването върху женското плодовитост и лечение на плодовитостта - Murizah M Zain, Robert J Norman,
- Загубата на отделяне на протеин 3 отслабва затлъстяването, причинено от западната диета, системно възпаление и