Изпратено: 11 декември 2019 г. Преглед: 6 април 2020 г. Публикувано: 6 май 2020 г.
Начало> Книги> Нови прозрения в метаболитния синдром [Работно заглавие]
Резюме
Повечето заболявания, причиняващи внезапна смърт или внезапно настъпване на сериозно ограничаване на качеството на живот, са тромботични заболявания. Миокардният инфаркт често се причинява от тромботична оклузия на коронарните артериални клонове. Исхемичният инсулт също се причинява от запушване на мозъчните артерии с тромби. При пациенти, приети в болница и обездвижени, венозната тромбоемболия, причиняваща белодробна емболия, е основна причина за смърт. Рискът от сърдечно-съдови събития се влияе от приема на храна. И все пак механизмът между специфичния прием на храна и риска от тромботични заболявания все още предстои да бъде изяснен. Последният напредък на компютърните и информационни технологии ни позволява да опишем сложни биологични явления като тромбоза от основните принципи на физиката и химията. Свързването на кръвния поток, тромбоцитите, коагулацията и фибринолизата ни позволява да разберем допринасящата роля на всеки фактор за образуването на тромби. И все пак точната роля на приема на храна за влияние върху риска от тромбоза все още предстои да бъде изяснена. Съчетаването на основни изследвания и мащабни клинични изследвания допълнително ще изясни ролята на различните видове прием на храна в риска от тромбоза.
Ключови думи
- инфаркт на миокарда
- удар
- артериална тромбоза
- тромбоцит
- коагулация
информация за глава и автор
Автор
Шиня Гото *
- Катедра по медицина (кардиология), Медицински факултет на университета Токай, Исехара, Япония
* Адресирайте цялата кореспонденция на: [email protected]
От редактирания том
Нови прозрения в метаболитния синдром [Работно заглавие]
Д-р Акиказу Такада
1. Въведение
Тромбозата е водещата причина за смърт в света. Всъщност атеротромбозата, включително коронарните артериални заболявания и мозъчно-съдовите заболявания, е основната причина за смърт в различни региони на света [1]. Венозната тромбоза, включително дълбока венозна тромбоза и белодробна емболия, е третата причина за смърт при хоспитализирани пациенти [2]. Тромбозата е заболяване, причинено от тромби, образувани в различни съдове. Основният симптом се различава значително в зависимост от мястото, където се развиват тромбите. Обикновено артериалната тромбоза като инфаркт на миокарда и исхемичен инсулт е симптоматична дори когато тромбите са малки (напр. По-малко от 1 mm в диаметър) [3]. От друга страна, венозната тромбоза е асимптоматична, докато тромбите станат значително по-големи, като тези, които запушват няколко белодробни артерии, за да причинят белодробна емболия [4]. Както при артериалните, така и при венозните тромбози тромбоцитите са клетки, които допринасят за първоначалното образуване на тромби. Коагулацията и фибринолизата са системи, необходими за регулиране размера на фибриновите тромби.
Трябва да се отбележи, че има хомогенност на рисковите фактори за различни артериални/венозни тромбози, въпреки широките вариации на клиничната проява [5]. Проучването на Framingham демонстрира, че пушенето на цигари, захарният диабет (DM), дислипидемията и хипертонията са силни предиктори за бъдещото начало на артериална тромбоза, представена от остър миокарден инфаркт [6]. Последните международни регистри също потвърждават, че тези рискови фактори допринасят за повтарянето на сърдечно-съдови събития [7]. Освен това международните регистри също предлагат тези параметри като рискови фактори на венозна тромбоза [8]. Тези клинични наблюдения предполагат наличието на общи пътища за поява на артериална и венозна тромбоза [9].
Регистърът на Фрамингам предлага допринасящата роля на затлъстяването и по-малкото физическо натоварване като предиктори за бъдещото разпространение на рисковите фактори. Тези аномалии, представени като синдром на висцерално затлъстяване, се наричат „метаболитен синдром“. При пациенти с метаболитен синдром инсулиновата резистентност е един от основните фактори, допринасящи за това [10]. Повишеното телесно тегло, високото кръвно налягане и дислипидемията са чести прояви на метаболитен синдром. Дългосрочното излагане на висококалорична диета и липсата на добри упражнения се предполагат като подчертаващи механизми за появата на метаболитни синдроми. Предполага се, че рискът от тромботични заболявания, включително артериална и венозна тромбоза, е висок при пациенти с метаболитен синдром.
2. Адхезия на тромбоцитите на мястото на ендотелни наранявания
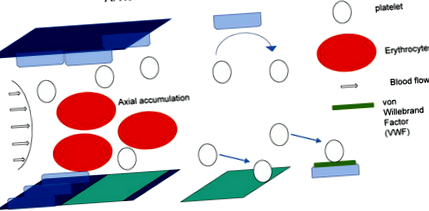
Фигура 1.
Роля на еритроцитите и притока на кръв в адхезията на тромбоцитите на мястото на ендотелни увреждания. Тази цифра демонстрира триизмерното разпределение на еритроцитите, тромбоцитите и ендотелните клетки. Еритроцитите се натрупват в центъра на кръвния поток чрез биореологични ефекти. Съответно, тромбоцитите циркулират близо до ендотелните клетки. В присъствието на нормално функциониращи ендотелни клетки, тромбоцитите не се прилепват, нито се активират, а просто се връщат към кръвния поток (панел А). Ако функцията на ендотелните клетки е била нарушена от различни стимулации, тромбоцитите се прилепват и активират чрез взаимодействието им с фактор на фон Вилебранд (VWF).
Потенциалното въздействие на еритроцитите за появата и растежа на тромбозата за първи път привлича интереса на изследователите през 60-те години [14]. Биореологично аксиално натрупване на течащи тромбоцити също беше признато по същото време [15]. Клиничните проучвания също подкрепят схващането, че по-високите стойности на хематокрита са свързани с по-висок риск от тромботични заболявания като миокарден инфаркт [16]. Тези резултати категорично предполагат биофизичната роля на еритроцитите за образуването на тромби. Тези реологични ефекти трудно биха могли да бъдат контролирани чрез прием на храна. В друг аспект еритроцитите също влияят върху функцията на тромбоцитите с биохимична модулация [17, 18, 19]. Всъщност, еритроцитите са огромен източник на ADP [20], който е един от най-мощните стимулиращи тромбоцитите средства [21, 22]. Съществуват потенциални ефекти от приема на храна за въздействие върху компонентите на еритроцитите, които могат да повлияят на тромбогенността на тромбоцитите [23, 24].
Последният напредък в компютърните технологии ни позволи да прогнозираме структурата и функцията на VWF, свързан с GPIbα, от физическото движение на атомите и водните молекули [25, 26]. По метода може да се предвиди физическа сила, генерирана от свързване на VWF с GPIbα. Адхезията на тромбоцитите при увредена стена на съда е обобщена на Фигура 2. Тромбоцитите са клетки с диаметър приблизително 5 μm. Но когато тромбоцитите са залепнали на мястото на увреждане на съда, само част от тромбоцитите са свързани с VWF. Молекулярната динамична прогноза разкрива, че единичната връзка на VWF и GPIbα може да генерира сила на свързване приблизително 70 pN [25]. Динамичната сила на течността, приложена върху тромбоцитите, достига до няколкостотин pN, когато клетката получава сила на отделяне от артериалния кръвен поток. Теоретично няколко връзки между VWF и GPIbα са достатъчни, за да спрат прилепването на тромбоцитите към съдовата стена. Механизмът на образуване на тромби е сложен процес, но адхезията на тромбоцитите в условията на кръвен поток вече може да бъде изградена от физическо движение на атоми и водни молекули.
Фигура 2.
Адхезия на тромбоцитите на мястото на ендотелно увреждане при условия на кръвен поток. Адхезията на тромбоцитите се медиира изключително от неговия гликопротеин (GP) Ibα свързване с фактор на von Willebrand (VWF). Прилепналите тромбоцити получават динамична сила на течността, но тромбоцитите продължават да се придържат, докато силата на отделяне стане по-голяма от силата на свързване, генерирана между VWF и GPIbα.
От особено значение е ендотелните увреждания да не се причиняват само от остра физическа или химическа стимулация. В последната ера хората се радват на по-дълъг живот от тези, които са живели преди стотици години. Точно както носенето на човек, корабната система остарява, когато хората остареят. По-продължителното излагане на стената на съда на атерогенни липиди като LDL холестерол и свързаната с него локална биологична реакция причинява атеросклероза [27, 28]. Антитромботичният потенциал на ендотелната клетка при пациенти с атеросклероза е намален в сравнение с по-младите нормални. Освен това, разкъсването на плаката излага субендотелните тромботични материали на лумена на съда. По този начин атеротромботичните събития се случват често [29] в ерата на застаряващото общество. Първоначалното събитие, водещо до симптоматична атеротромбоза, винаги е адхезия на тромбоцитите на мястото на увреждане на ендотела.
Разбирайки механизма на атеросклерозата и атеротромбозата, е доста лесно да се разбере, че различните видове прием на храна влияят на риска от тромбоза. Що се отнася до хранителния фактор, има гореща дискусия относно холестерола. Някои предполагат потенциална полза от ограничаването на холестерола за предотвратяване на атеротромбоза. Другият предполага, че няма връзка между дневния прием на холестерол и риска от риск от атеротромботични събития.
3. Активиране на коагулационна каскада и фибринолиза
Симптоматични атеротромботични събития като остър миокарден инфаркт се появяват, когато артурният клон, проникващ в органа, е запушен от тромби. Диаметърът на съдовете за перфузия на органи е значително по-голям от една клетка на тромбоцитите. Всъщност диаметърът на тромбоцитите е само 2–5 μm, докато диаметърът на миокардния перфузионен коронарен артериален клон е 2–3 mm. Размерът на диаметъра на съда обикновено е с 1000 повече от размера на диаметъра на тромбоцитите. Нереалистично е да си представим, че коронарните артериални клонове са запушени от тромбоцитни тромби. Всъщност, когато коронарните артериални тромби, причиняващи миокарден инфаркт, се аспирират чрез тромбо-аспирационна терапия, основният компонент на оклузивните тромби е фибрин (Фигура 3). Забележително е, че фибриновите фибрили се откриват около активирани тромбоцити (Фигура 3 е продуктът в сътрудничество с проф. Юджиро Асада от Университета Миядзаки).
Фигура 3.
Основни компоненти на тромбите, причиняващи остър миокарден инфаркт. Проби от тромби са аспирирани от пациенти с остър миокарден инфаркт. Основните резултати и протоколи от проучването са публикувани другаде [53]. Тук са показани резултатите от електронната микроскопия. Около активирани тромбоцити могат да се видят фибринови фибрили (стрелка).
Фигура 4.
Модел на свързване на кръвен поток, тромбоцити, коагулация и фибринолиза. Моделира се образуването на тромби на мястото на ендотелна травма. Там са изложени неактивирани тромбоцити (NP), прилепнали на мястото на ендотелно увреждане чрез фактор на von Willebrand (VWF) и колаген. NP стават активирани тромбоцити (AP) чрез тяхното взаимодействие с VWF/колаген (①). AP има потенциал да преобразува протромбин в тромбин на тяхната мембранна повърхност (②). След производството на тромбин от протромбин (③), тромбинът превръща разтворимия фибриноген във фибринови тромби. (④) тромбинът също има функция за допълнително активиране на тромбоцитите чрез стимулация на тромбиновия рецептор. (⑤) Фибринолитичната система също е включена в този модел. Функционалните ендотелни клетки конститутивно освобождават както тъканния тип активатор на плазминоген (t-PA: ⑥), така и инхибитор на плазминогенния активатор (PAI) -1 (⑦). T-PA превръща плазминогена в плазмин, който има фибринолитична активност (⑧), освен ако не се инактивира чрез свързване с PAI-1. Плазминът е силен ензим, способен да разгражда фибрина. Неговата функция незабавно се неутрализира чрез свързването му с а2-плазминов инхибитор, за да образува плазминов а2-плазминов инхибиторен комплекс (PIC: ⑨).
Има няколко коагулационни фактора, чиято функция се регулира силно от приема на храна. Gla-домейнът на коагулационните фактори играе решаваща роля в натрупването на коагулационни фактори около изложени негативно заредени фосфолипиди върху активирани тромбоцити [36]. Gla-домейнът също играе решаваща роля за ензимната функция на коагулационните фактори. Карбоксилирането на Gla-домена се медиира от витамин К. По този начин коагулационната каскада не работи добре при липса на витамин К или при пациенти, приемащи инхибитор на витамин К. Забележително е, че има много храни, включително ферментирала храна, за които е известно, че съдържат много витамин К. Необходимо е строго ограничаване на храните, за да се запазят антикоагулантните ефекти на инхибиторите на витамин К. Напоследък се предупреждава за по-голямо натоварване на витамин К за здравето [37].
Количеството фибрин, образувано на мястото на ендотелното увреждане, е намалено от ефекта на присъщата фибринолиза. Фибринолизата е сложен път, но подробностите за които са опростени, за да бъдат включени, както е показано на Фигура 4. Съдовите ендотелни клетки имат балансирани роли за фибринолиза чрез освобождаване както на фибринолитичен тъканен тип плазминогенен активатор (t-PA: ⑥), така и на този антифибринолитични ефекти на инхибитора на плазминогенов активатор (PAI) -1 (⑦). И двамата се освобождават конститутивно от ендотелните клетки. Но скоростта на освобождаването им се контролира индивидуално в отделни ендотелни клетки. Когато скоростта на освобождаване на t-PA се увеличи, количеството фибрин, образувано около ендотелните клетки, става по-малко. Той става по-голям в случай, когато скоростта на освобождаване на PAI-1 се увеличи. Безплатният t-PA има потенциал да преобразува плазминоген в плазмин. (⑧) Плазминът е силна протеаза, която може да разтвори много функционални протеини, включително фибриноген. За да се избегне твърде много разграждане на протеини, активността на плазмина се неутрализира незабавно от функцията на α2-плазминов инхибитор (α2-PI: ⑨).
Предишна публикация предполага засилено освобождаване на PAI-1 след остър миокарден инфаркт и неговата роля за увеличения рецидив на миокарден инфаркт [38]. Експериментите с животни разкриват, че оцветителят за храна на кроцин намалява активността на PAI-1 и предотвратява тромбозата [39]. При хората се съобщава за повишена активност на PAI-1 по време на прекалено голям прием на мазнини [40]. Съобщава се също, че общата фибринолитична активност при хората е ниска при пациенти със затлъстяване [41]. Намалената фибринолитична активност при пациенти, приемащи твърде много липиди, е една от потенциалните причини за повишен риск от тромбоза при тези пациенти.
4. Роля на различните видове прием на храна за риска от тромбоза
Има много доклади, които предполагат увеличаване/намаляване на риска от тромбоза при прием на различни храни и напитки. Проучването на Framingham предполага, че консумацията на кафе е свързана с по-нисък риск от инфаркт на миокарда [42]. Въпреки това, влиянието на приема на кафе за началото и рецидива на миокарден инфаркт все още се обсъжда, тъй като други доклади предполагат по-висок процент на внезапна сърдечна смърт при прием на кафе при пациенти след миокарден инфаркт [43]. Хората имат консенсус, че приемът на храна трябва да повлияе на риска от артериална и венозна тромбоза. Проблемът е, че все още е трудно да се посочи коя храна намалява/увеличава риска от тромбоза.
Старите епидемиологични проучвания предполагат, че рискът от инфаркт на миокарда се е увеличил при японците, имигрирали на Хавай или Калифорния, отколкото този на пребиваващите в Япония. Те имат еднакъв генетичен произход. Факторите на околната среда, включително храната, трябва да допринесат за промяната в риска от население при преместване в САЩ, отколкото престоя в Япония. По-ниската сърдечно-съдова смъртност в Япония все още се отбелязва в международния регистър на пациенти с атеротромбоза или неклапно предсърдно мъждене. Въпреки епидемиологичните данни, все още е трудно да се установи коя храна специално модулира скоростта на тромбоза.
Има много специфични диети, които потенциално влияят на тромботичния риск. Сред тях приемът на натрий трябва да бъде един от най-утвърдените фактори за избягване на сърдечно-съдови заболявания. Ниският прием на натрий очевидно намалява риска от сърдечна недостатъчност [44], но неговите преки ефекти върху тромбозата все още предстои да бъдат изяснени. Средиземноморската диета е свързана и с по-нисък риск от сърдечно-съдови заболявания [45]. Но все още е трудно да се идентифицира специфичното съдържание на средиземноморската диета, свързано с намаляването на риска от сърдечно-съдови заболявания. Растителната диета изглежда полезна за намаляване на риска от сърдечно-съдови заболявания, но има както добри, така и лоши качества [46]. Връзката между храната и риска от сърдечно-съдови заболявания (най-вече артериална тромбоза) е сложна.
Неотдавнашна публикация предполага положителната връзка между приема на червено и преработено месо и риска от сърдечно-съдови заболявания. Това проучване също така предполага отрицателната връзка между приема на кисело мляко, сирене и яйца и риска от сърдечно-съдови заболявания [47]. Проучването за наблюдение е полезно за намиране на потенциални допринасящи фактори, но все пак включва много потенциални пристрастия. Точно като лекарствена или медицинска намеса, рандомизираните проучвания, сравняващи разнообразие от прием на храна с твърда крайна точка на сърдечно-съдова смърт, инфаркт на миокарда и исхемичен инсулт, ще ни дадат повече представа. В действителност обаче е трудно да се проектират такива изпитания, защото хората имат право да ядат каквото им харесва. Трудно е да се направи ограничение в приема на храна за дълъг период от време. Комбинацията от наблюдателно проучване и проучване за изясняване на механизма ще ни даде най-добрите налични доказателства сега.
5. Метаболитен синдром и тромбоза: поглед от механизма
Метаболитният синдром се характеризира като наличие на три очевидни характеристики, включително висцерално затлъстяване, проявяващо се като увеличаване на обиколката на талията, дислипидемия, хипертония и висока кръвна глюкоза. Подчертаването на патофизиологията е инсулинова резистентност и натрупване на липиди. Прави впечатление, че различни цитокини (адипоцитокини) са идентифицирани от мастната тъкан. Адипонектинът е този, определен като фактор, намаляващ риска от тромбоза чрез предотвратяване на ендотелна дисфункция [48]. Наистина, намалената плазмена концентрация на адипонектин, наблюдавана при пациенти със затлъстяване, може да предполага потенциалната регулаторна роля на адипонектин за появата на тромботични заболявания [49]. Въпреки трудностите при разбирането на точната връзка между различните цитокини и адипонектин [50], забележителна е очевидната връзка между метаболитния синдром и намаления адипонектин. Различните параметри на коагулацията и фибринолизата също се влияят при пациенти с метаболитен синдром [51]. Разумно е да се препоръча редовно упражнение за предотвратяване на метаболитен синдром и бъдеща поява на тромбоза [52].
6. Заключение
Очевидно приемът на храна влияе дълбоко на риска от тромботични заболявания като артериални и венозни тромботични заболявания. Очакват се дълбоко надеждни популационни клинични проучвания или добре проектирани проучвания в регистъра. Прецизно разберете механизма на тромботичната болест от твърда наука, като преструктуриране на биологични явления от физическото движение на атомите.
Благодарности
Shinya Goto признава финансовата подкрепа от MEXT/JSPS KAKENHI 17 K19669, 18H01726 и 19H03661. SG признава независима подкрепа за безвъзмездна помощ от Bristol-Myers Squibb (33999603). SG също така признава безвъзмездната подкрепа от възпоменателната фондация Vehicle Racing и фондация Nakatani за напредък в измервателните технологии в биомедицинското инженерство. SG получи финансиране за научни изследвания от Sanofi, Pfizer и Ono.
- Диетата с високо съдържание на мазнини намалява образуването на бутират, но увеличава сукцината, възпалението, чернодробните мазнини
- Дългосрочен ефект на диетата със скумрия върху кръвното налягане, серумните липиди и образуването на тромбоксан през
- Нека да преминем отвъд таксономията в описанието на диетата, тествайки подход, основан на черти на плячка – хищник
- Как се справя диетата на Аткинс в холестерола
- Как стана диетата DASH - манекени