Резюме
Заден план
Екзозомите от говеждо мляко се изучават за ролята им на биоактивни хранителни съединения и като средство за доставка на лекарства. И двете линии на изследване се сближават по отношение на имунната функция, например, имунната регулация чрез абсорбиране на микроРНК, капсулирани в млечните екзозоми през границите на видовете, и възможността екзозомите и техните товари да предизвикат имунен отговор, ако се използват при доставка на лекарства. Това проучване оценява бионаличността на свързани с имунитета микроРНК от говеждо мляко и промените в плазмените концентрации на цитокини след консумация на мляко при хора и секрецията на цитокини от мононуклеарни клетки на човешка периферна кръв (PBMC), култивирани с млечни екзозоми, трансфектирани с имунорелевантни микроРНК.
Резултати
Проби от човешка плазма се събират преди и на интервали от време след млечно хранене и се анализират за концентрации на шест имунорелевантни микроРНК и девет цитокини. Пиковите плазмени концентрации на miR-15b-5p, miR-21-5p, miR-106b-5p и miR-223-3p са били 60 ± 9,80% до 162 ± 31,80% по-високи след консумация на мляко (Ct стойности 23 ± 1,2 до 26 ± 1,1 цикъла) в сравнение с изходните стойности (P 0,05). Когато PBMC културите от гладни субекти бяха допълнени с млечни екзозоми, които бяха трансфектирани с имунорелевантни микроРНК, концентрациите на IL-1β, IL-6, IL-10 и TNF-alpha бяха с 29 ± 12% до 220 ± 33% по-високи отколкото контролите, култивирани с нетрансфектирани екзозоми (P 0,05).
Заключения
МикроРНК в екзозомите от говеждо мляко са бионалични. Екзозомите на млякото не предизвикват повишаване на плазмените цитокини след перорално приложение.
Пробна регистрация
ISRCTN идентификационен номер на регистъра: 16329971. Ретроспективно регистриран на 7 февруари 2019 г.
Заден план
Екзозомите са наноразмерни частици, които играят съществена роля в комуникацията между клетките [1]. Комуникацията се постига чрез прехвърляне на различни товари като различни видове РНК, протеини и липиди от донори към клетки реципиенти [1,2,3]. Сред екзозомните товари микроРНК (miRs) представляват особен интерес, тъй като хибридизират с комплементарни последователности в 3′-нетранслирани региони в иРНК и заглушават гени чрез задействане на разграждането на иРНК или предотвратяване на транслацията на иРНК [4, 5]. Повече от 60% от хората (Homo sapiens, hsa) mRNAs съдържат предполагаеми места за свързване за приблизително 2000 miRs, кодирани в човешкия геном [6, 7]. MiRs регулират практически всяка генна мрежа при хората и са замесени в множество физиологични и патологични състояния при хората [8, 9]. Отрицателната регулация на гените от miRs е от особено значение за фина настройка на регулаторните вериги в имунния отговор [10].
Традиционно, miRs се считат за ендогенни регулатори на гени, в съответствие с наблюденията, че miRs са кодирани от ендогенни гени и загубата на miR съзряване при Dicer нокаут мишки е ембрионална летална [11,12,13,14,15,16]. Парадигмата, че miRs се получават изключително от ендогенен синтез, беше оспорена в доклади, предполагащи, че диетичните miRs в растенията и говедата (Bos taurus, bta) млякото е бионалично и допринася за натрупването на miRs в тялото при хора и животни [17, 18]. Например, през 2012 г. се появиха доказателства, че MIR-168a от ориз (Oryza sativa; оса-MIR-168a) се открива в човешки и животински серуми и оса-MIR-168a намалява експресията на LDL рецепторен адаптер протеин 1mRNA, като по този начин инхибира експресията на LDL рецептор в черния дроб на мишка [17]. Капсулирането на miRs в екзозомите придава устойчивост на суровите условия в млекопреработвателните предприятия и стомашно-чревния тракт на човека и впоследствие улеснява чревната абсорбция на miRs [19,20,21,22]. Откритията относно бионаличността на млечните miRs са потвърдени от пет независими лаборатории (прегледани в [23]). Този преглед също така обсъжда ограниченията на проучванията, които не са показали бионаличността на млечните miRs.
Изследванията на miRs и техните екзозомни черупки в говеждото мляко придобиха значителна сила в две линии на изследване, а именно ролята на miRs и екзозомите като биоактивни хранителни съединения и използването на млечните екзозоми като средства за доставка на лекарства. Например, данните сочат, че изчерпването на храната от млечните екзозоми и РНК предизвиква фенотипи като 40-кратно увеличение на пуриновите метаболити в човешки и миши телесни течности и тъкани и умерена загуба на сила на сцепление при мишки [24, 25]. Екзозомите на млякото са използвани за доставяне на лекарства до туморни места при мишки [26, 27]. И двете линии на изследване се сближават в имунната функция, например имунната регулация от miRs през границите на видовете и възможността за неблагоприятни ефекти, причинени от прилагането на имуногенни екзозоми при доставка на лекарства.
Екзозомите от говеждо мляко съдържат miRs, които са замесени в имунната функция, например miR-15b-5p, miR-21-5p, miR-34a-5p, miR-106b-5p, miR-155-5p и miR-223- 3р [7, 10, 28]. Тези miRs имат нуклеотидни последователности, идентични на човешките ортолози и следователно ще се свържат с комплементарни последователности в човешка иРНК [29]. Това проучване оценява бионаличността на свързаните с имунитета микроРНК от говеждо мляко и имунните отговори на хранене с мляко при хора, както и секрецията на цитокини от мононуклеарни клетки на човешка периферна кръв (PBMC), култивирани с miR-трансфектирани млечни екзозоми.
Резултати
MiRs анализи в говеждо мляко и екзозоми от говеждо мляко
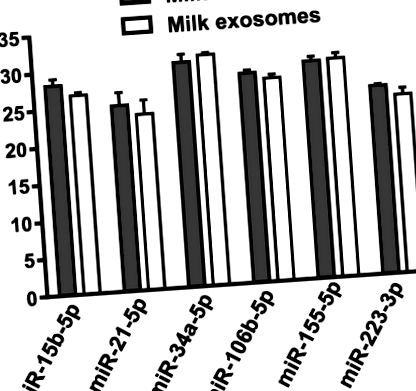
Количествата на шестте miR, количествено определени с помощта на RT-qPCR анализи, са сходни в говеждото мляко и екзозомите от говеждо мляко. Когато използвате фиг. 1
Количествени PCR анализи с обратна транскриптаза на свързани с имунитет miRs в говеждо мляко и екзозоми от говеждо мляко от равен обем мляко. Стойности означава ± SEM (н = 3). Ct Праг на цикъла
Плазмени нива на свързани с имунитета miRs
Предишен доклад предполага, че miR анализът може да бъде объркан от замърсяване на NucleoSpin miR плазмени колони с микробни РНК, но не можахме да възпроизведем тези открития [30]. Тествахме за замърсяване на колони чрез преминаване на вода с молекулярна биология през третирани с хипохлорит и необработени колони и сравнихме стойностите на Ct на шестте miRs в двете обработки чрез RT-qPCR (н = 5 на лечение). Стойностите на Ct са по-големи от 35 във всички тествани проби. Въпреки липсата на замърсяване, грешихме предпазливо и третирахме колони с 0,5% натриев хипохлорит преди извличане на miR от плазмата [30].
Концентрации на цитокини в плазмата
Консумацията на мляко няма ефект върху концентрациите на цитокини в човешката плазма. Девет цитокини бяха включени в персонализирания мултиплекс анализ, въз основа на обосновката, че отделните линии на имунните клетки секретират различни цитокини. От деветте тествани цитокини само TNF-алфа се открива в плазмата, събрана преди и след консумацията на мляко; видимото повишаване на плазмените концентрации на TNF-алфа три часа след консумацията на мляко в сравнение с изходното ниво не е статистически значимо (стр = 0,08 за еднопосочна ANOVA; Фиг. 2). Тези резултати предполагат, че консумацията на мляко не предизвиква повишаване на концентрацията на цитокини в човешката плазма.
Графични графики на плазмената концентрация на TNF-алфа преди и на интервали от време след млечно хранене. Кутиите представляват 5-ия и 95-ия процентил, хоризонталните ленти са медианите, а лентите за грешки показват минимални и максимални стойности. стр = 0,08 спрямо час 0 (еднопосочен ANOVA и многократни сравнения на Sidak posthoc тест; н = 5). TNF-алфа Фактор на туморна некроза-алфа
Концентрации на цитокини в културална среда PBMC
Консумацията на мляко само по себе си не прави PBMC, за да увеличи нетната секреция на IL-1β, IL-6, IL-10 и TNF-alpha в сравнение с PBMC, събрани преди консумация на мляко ex vitro. Въпреки това, PBMC от участници, консумиращи мляко, произвеждат значително по-високи нива на тези цитокини след стимулация с конканавалин А (ConA) за 24 часа (фиг. 3). Само лечението с ConA не предизвиква промени в концентрациите на цитокини в хранителната среда. За среда, събрана на 48 часа и 72 часа, моделите на концентрации на цитокини са същите като на първите 24 часа култура (Допълнителни файлове 1 и 2). Концентрациите на IL-2, IL-4, IL-5, IL-17A и интерферон гама (IFN-y) на 24, 48 и 72 часа от култури на PBMCs, изолирани преди и шест часа след млечно хранене, не са били повлияни от консумация на мляко или ConA (Таблица 3).
Дискусия
Заключение
Млечните екзозоми трябва да се разглеждат по-нататък като жизнеспособна възможност за доставяне на лекарства и регулаторна РНК чрез диета.
Методи
Участници
Дванадесет привидно здрави възрастни участваха в това проучване [7 мъже, 5 жени; възраст (средно ± SD, години): 28,8 ± 3,51; индекс на телесна маса (средно ± SD, kg/m 2): 23,9 ± 2,40]. За анализи на цитокини в плазмата беше взета проба от подкохорта от пет субекта [2 мъже, 3 жени; възраст (средно ± SD, години): 28.4 ± 0.58 y; индекс на телесна маса (средно ± SD, kg/m 2): 22,4 ± 1,65]. Критериите за изключване включват бременност, тютюнопушене, алергии към мляко и здравословни проблеми. Съветът за институционален преглед в университета в Небраска-Линкълн одобри този протокол и всички субекти подписаха формуляр за информирано съгласие. Това проучване е регистрирано ретроспективно като клинично изпитване с регистър ISCRTN (ISRCTN16329971).
Уча дизайн
Количествено определяне на miRs в говеждо мляко и екзозоми, получени от говеждо мляко
Определихме присъствие на имунни свързани miRs в говеждо мляко и екзозоми от говеждо мляко, като използваме количествена PCR с обратна транскрипция (RT-qPCR). Говеждо мляко (1% масленост) се получава от местен хранителен магазин. Екзозомите бяха изолирани чрез ултрацентрифугиране, както беше описано по-рано с малки модификации [21]. РНК се изолира от говеждо мляко и екзозоми от говеждо мляко и се транскрибира обратно чрез използване на miScript комплект за обратна транскрипция, следвайки инструкциите на производителя (Qiagen). RT-qPCR анализи за шест свързани с имунитета miRs бяха извършени, използвайки SYBR Green (Qiagen) и универсалния обратен праймер, включен в комплекта плюс праймери, специфични за отделни miRs (Таблица 4).
Анализ на miR на плазмата
По-голямата част от говежди miRs имат нуклеотидни последователности, идентични с техните човешки ортолози. Следователно, количествената PCR с обратна транскрипция (RT-qPCR) не прави разлика между зрели miR-15b-5p от говеда и miR-21-5p, miR-34a-5p, miR-106b-5p, miR-155-5p, miR -223-3p и miR-1-3p [29]. MiR-1 не се открива в говеждо мляко и е използван като отрицателна контрола [53, 54]. MiRs бяха изолирани от плазмата с помощта на плазмен комплект NucleoSpin miRNA (Macherey-Nagel) и анализирани чрез количествена PCR с обратна транскрипция (RT-qPCR), както е описано по-горе. Heintz-Buschart и сътр. съобщава, че спинови колони за пречистване на РНК могат да бъдат замърсени с микробни РНК и да дадат фалшиво положителни резултати при miR анализ [30]. Въпреки че не можахме да възпроизведем замърсяване на въртящи се колони, ние предпочетохме да грешим от страна на предпазливостта и пречистихме колоните с 0,5% натриев хипохлорит преди употреба [30]. Площите под кривите (AUC) на плазмените концентрации на miRs спрямо кривите на времето бяха изчислени с помощта на линейното трапецовидно правило и бяха използвани за оценка на привидната бионаличност на miRs [55].
Анализ на цитокините
PBMC се събират преди и шест часа след консумацията на мляко и се суспендират в RPMI-1640, допълнени с 10% (обемни) автоложна плазма, 1% пеницилин/стрептомицин и 0,1% натриев пируват. РВМС се отглеждат в колби с култура Т25 в краен обем от 5 ml среда при плътност 2 × 106 клетки/ml. Бяха приготвени две аликвотни части; едната аликвотна част се третира с ConA при крайна концентрация 15 μg/ml, а втората аликвотна част се третира с разтворител (контрол на носителя). Клетките се култивират до три дни и супернатантите на средата се събират на 24 h, 48 h и 72 h след започване на културата. Концентрациите на цитокини в безклетъчните супернатанти бяха определени с помощта на персонализиран комплект за имуноанализ на човешки цитокини/хемокини с магнитни перли (EMD Millipore) за IL-1β, IL-2, IL-4, IL-5, IL-6, IL- 10, IL-17A, IFN-γ и TNF-alpha съгласно инструкциите на производителя (Millipore Billerica, Inc). Пробите бяха анализирани с помощта на система за четене Bio-Plex Magpix и софтуер Bio-Plex Manager (Bio-Rad, Inc.).
PBMC култури с натоварени с miR екзозоми
PBMC от кръв на гладно при хора са култивирани с млечни екзозоми или екзозоми, които са трансфектирани със смес от синтетични имунорелевантни miRs (miR-15b-5p, miR-21-5p, miR-155-5p и miR-223-3p) или разбъркан miR при клетъчна плътност 10 5 клетки/ml, както е описано по-горе [31]. Разбърканият miR е проектиран чрез рандомизиране на нуклеотидните последователности от четирите свързани с имунитета miR. Две различни концентрации на екзозоми (1 × 10 5 или 1 × 10 10 екзозомни частици/ml) бяха използвани в PBMC култури. Екзозомно допълнените PBMC култури се третират с ConA или разтворител, както е описано по-горе. Безклетъчни супернатанти за култура се събират 24 и 48 часа след започване на културата и се анализират за цитокини с помощта на комплекта Milliplex.
статистически анализи
Двупосочен ANOVA и еднопосочен ANOVA бяха използвани при тестване на ефектите на две и една независими променливи, съответно. Posthoc тестът на Sidak е използван при сравняване на лечения с определен контрол, докато posthoc тестът на Tukey е използван при сравняване на всички групи. AUC са изчислени с помощта на GraphPad Prism 6 (софтуер GraphPad). Данните за фармакокинетиката бяха анализирани чрез използване на многократно измерване на ANOVA Fisher’s защитен тест за най-малка значимост за сравнения post hoc. За анализ на цитокините е използван тест за сбор на ранг на Friedman, последван от двойни сравнения, използващи тест за множествено сравнение Nemenyi. Данните се отчитат като средни стойности ± SEM. Ефектите от лечението се считат за статистически значими, ако P
Наличност на данни и материали
Всички данни, генерирани по време на това проучване, са включени в тази публикувана статия и нейните допълнителни файлове 1 и 2.
- Връзка между нивото на карбамид в млякото, храненето с протеини и екскрецията на азот в урината при високо
- Nestle Nesquik Double Chocolate Преглед с нискомаслено шоколадово мляко; Том; s Diet Quest
- Замяна на мляко, сирене и кисело мляко за диета без млечни продукти - манекени
- Връзки между педиатри и компании за мляко за кърмачета
- Ново проучване установява, че млякото хидратира тялото по-добре от водата