Субекти
Резюме
Предназначение
Моногенният диабет представлява 1-2% от случаите на диабет. Често не се диагностицира, което може да доведе до неподходящо лечение. Това проучване е проведено, за да се оцени разпространението на моногенния диабет в кохорта юноши с наднормено тегло/затлъстяване, диагностицирани с диабет тип 2 (T2D).
Методи
Секвенирането с помощта на персонализиран моногенен генен панел за диабет е извършено върху расово/етнически разнообразна кохорта от 488 юноши с наднормено тегло/затлъстяване с T2D в клиничните изпитвания за лечение на диабет тип 2 при юноши и младежи (ДНЕС). Бяха анализирани връзките между наличието на моногенен вариант на диабет и клиничните характеристики и времето до неуспех на лечението.
Резултати
Повече от 4% (22/488) са имали генетични варианти, причиняващи моногенен диабет (седем GCK, седем HNF4A, пет HNF1A, две INS, и едно KLF11). Пациентите с моногенен диабет са имали статистически, но не клинично значим по-нисък индекс на телесна маса (ИТМ) z-резултат, по-нисък инсулин на гладно и по-висок глюкоза на гладно. Повечето (6/7) пациенти с HNF4A варианти бързо се провалиха ДНЕС лечение в изследваните групи (коефициент на риск = 5,03, P = 0,0002), докато никой с GCK варианти неуспешно лечение.
Заключение
Откритието на 4,5% от пациентите с моногенен диабет в кохорта с наднормено тегло/затлъстяване на деца и юноши с T2D предполага, че диагнозата моногенен диабет трябва да се обмисли при деца и юноши без свързани с диабет автоантитела и поддържан С-пептид, независимо от ИТМ, тъй като може да насочва подходящо клинично управление.
Въведение
Въпреки че T2D е бил исторически открит главно при възрастни с наднормено тегло над 40-годишна възраст, напоследък нарастването на юношите с наднормено тегло или затлъстяването е довело до повишена честота на T2D при млади популации. Поради нарастващото разпространение на T2D при подрастващите и липсата на данни относно специфичните за подрастващите методи за лечение на T2D, проучването за лечение на диабет тип 2 при юноши и младежи (ДНЕС) анализира ефективността на метформин самостоятелно или в комбинация с розиглитазон или начин на живот промени при юноши с наскоро диагностициран T2D. 12 Приблизително половината (48,3%) от 699 участници, лекувани само с метформин, поддържат гликемичен контрол, докато комбинацията от метформин и розиглитазон показва малко, но значително подобрение в трайността на гликемичния контрол (61,4% поддържан контрол, 25,3% намаляване на първичния резултат поява в сравнение само с метформин, P = 0,006) за относително кратка продължителност на лечението (пациентите са проследявани средно 3,86 години). 13 В настоящото проучване анализирахме разпространението на моногенния диабет при участниците в проучването ДНЕС и резултатите от тях.
Материали и методи
Характеристики на пациента
Участниците в проучването TODAY са юноши на възраст 10–17 години, диагностицирани с T2D съгласно критериите на Американската диабетна асоциация в рамките на 2 години от записването в проучването. Протоколът за изследването TODAY е одобрен от институционалния съвет за преглед във всяка участваща институция (ClinicalTrials.gov: NCT00081328) и е получено информирано съгласие от всички субекти. Критериите за допустимост също включват индекс на телесна маса (ИТМ) над 85-ия персентил, като същевременно отчита възрастта и пола, отрицателен за свързаните с диабета автоантитела (GAD65 и ICA512) и C-пептид на гладно ≥0,20 nmol/L. След период на въвеждане, в който гликемичният контрол (HbA1c 12, 13
Това проучване анализира ДНК от подгрупа от 488 юноши (177 мъже и 311 жени) от общата кохорта ДНЕС от 699 участници. Някои участници ДНЕС не са разполагали с ДНК за анализ, тъй като не са присъствали на посещение по време на периода на събиране на ДНК или защото са отказали да дадат съгласието си да предоставят генетични данни. Освен това от този анализ бяха изключени всички участници с неопределена раса/етническа принадлежност или с раса/етническа принадлежност с малък размер на извадката. Данните за обекта, включени в този анализ, са испанци (н = 217), неиспанско черно (NHB, н = 166), или неиспанско бяло (NHW, н = 105) и не показа очевидни разлики от цялата ДНЕС група с тези раси/етноси (Допълнителни таблици S1 и S2 онлайн).
Методи за секвениране
Вариантен анализ
Нечести (14 Тези насоки са създадени, за да стандартизират сложния процес на класифициране на вариантите в категории („патогенни“, „вероятно патогенни“, „несигурни значими“, „вероятно доброкачествени“ или „доброкачествени“) въз основа на данни за популацията, изчислителни данни, функционални данни и данни за сегрегация Критерии (допълнителна таблица S5) бяха оценени за всеки вариант и патогенността беше определена въз основа на общите доказателства съгласно алгоритъма на насоките ACMG/AMP.
Статистически анализ
Резултати
Моногенни варианти на гена за диабет
13 гена, за които се съобщава, че причиняват MODY по време на дизайна на изследването, са анализирани за нечести кодиращи и варианти на мястото на снаждане в тази кохорта (допълнителна таблица S6). Двадесет и шест цитирани по-рано варианти MODY бяха оценени съгласно критериите ACMG/AMP, а 18 бяха класифицирани като патогенни или вероятно патогенни (Таблица 1), докато осем бяха класифицирани като доброкачествени, вероятно доброкачествени или варианти с несигурна значимост (VUS) (Допълнителна таблица S7). Бяха открити тридесет нови варианта и четири от тези варианти бяха класифицирани като патогенни или вероятно патогенни, докато 26 бяха VUS (допълнителна таблица S8). Счита се, че пациентите с патогенни или вероятни патогенни варианти имат моногенен диабет. Като цяло бяха открити 22 индивида с 22 различни патогенни или вероятни патогенни варианта; т.е. 22/488 от анализираните, или 4,5% от тази проба от участниците ДНЕС, са имали моногенен диабет. Пациенти с моногенен диабет са открити във всяка от трите категории раса/етническа принадлежност и във всички лечебни групи на клиничното изпитване TODAY (Таблица 1, Допълнителна таблица S2). Докато в това проучване са открити варианти на гени, които не са MODY, нито един не е определен като патогенен или вероятно патогенен за моногенен диабет или моногенни форми на затлъстяване (допълнителна таблица S9).
Характеристики на пациенти с моногенни варианти на гена за диабет и резултати от проучването
Характеристики в най-ранната налична времева точка (ИТМ z-резултат, HbA1c, кръвно налягане, триглицериди и липидни мерки бяха от скрининговото посещение, докато глюкозата на гладно, инсулинът на гладно, инсулиногенният индекс и DXA бяха от изходното посещение) на пациенти с патогенни или вероятно патогенни моногенни варианти на диабета (н = 22) са сравнени с тези без моногенен диабет (н = 426) (Таблица 2, Допълнителна таблица S10). Хората с моногенен диабет показват по-нисък ИТМ z-резултати (2,05 срещу 2,32, P = 0,004), по-висока глюкоза на гладно (6,65 срещу 6,08 mmol/L, P = 0,02), по-нисък инсулин на гладно (152,1 срещу 213,9 pmol/L, P = 0,03) и по-висок общ холестерол (4,50 срещу 3,98 mmol/L, P = 0,003) в сравнение с лица без моногенен диабет. Тези асоциации все още бяха значими, когато се коригираха за ИТМ z-резултат (допълнителна таблица S10). Отделени от генната етиология, моногенните подгрупи на диабета показват сходни тенденции в характеристиките на пациента, въпреки че обикновено са недостатъчно способни да откриват значителни разлики.
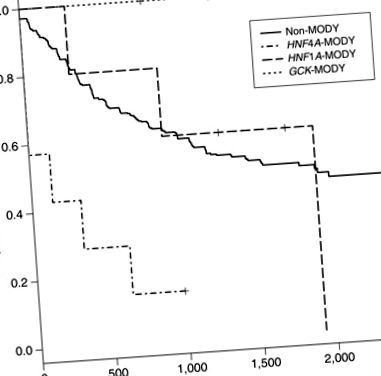
Анализите на неуспех до лечението, основният резултат от проучването TODAY, сравняват незасегнатите лица (н = 426) с лица с HNF1A-МОДИ, HNF4A-MODY и GCK-MODY (Фигура 1). Няма пациенти с GCK-MODY (0/7) неуспешно лечение в проучването TODAY. Във всичките три проучвателни групи 6 от 7 от субектите с HNF4A-MODY неуспешно лечение през първите 2 години от проучването, с коефициент на риск 5,03 (2,18–11,58, 95% доверителен интервал) (P = 0,0002) в сравнение с пациенти без моногенен диабет. Трима пациенти с HNF4A-MODY загубиха гликемичния контрол при първото си проучване след изходното ниво. Няма значителна разлика в терапевтичния отговор на лица с HNF1A-MODY в сравнение с индивиди без моногенен диабет.
Крива на преживяемост без неуспех на зрелия диабет на младите (MODY) генни подтипове и незасегнатите пациенти. х-оста се дефинира като дни след изходното посещение до началото на интервала на отказ. Събитията се определят като повишен гликиран хемоглобин (> 8,0%) за период от 6 месеца или невъзможност да се отучи участникът от инсулин в рамките на 3 месеца след започване на лечението в проучването Опции за лечение на диабет тип 2 при юноши и младежи (ДНЕС). Съотношение на опасност (HR) за всеки подтип: GCK-MODY HR = недефинирано (няма събития), HNF1A-MODY HR = 1,26 (0,40–4,02 95% доверителен интервал) P = 0,7 и HNF4A-MODY HR = 5,03 (2,18–11,58 95% доверителен интервал) P = 0,0002.
Дискусия
Въпреки че патогенни и вероятно патогенни моногенни генетични варианти на диабета бяха открити във всяка раса/етническа принадлежност, по-голям дял от участниците в NHW носеха варианти на моногенен диабет (допълнителна таблица S2). По същия начин повече участници в NHB носят цитирани преди това варианти на моногенен диабет, прекласифицирани като VUS, вероятно доброкачествени или доброкачествени варианти. Съотношението на шансовете за участниците в NHB, носещи прекласифицирани варианти, е 2,15 в сравнение с NHW, 3,84 в сравнение с испанците и 3,10 в сравнение с комбинираните популации NHW и испанци. Предполагаме, че тази тенденция се дължи на разчитането на стандартите и насоките ACMG/AMP на предварително публикувани данни за генетични варианти. Предишни проучвания за моногенен диабет са се фокусирали главно върху европейските популации, което може да причини пристрастия при класифицирането на вариантите. Недостатъчното представяне на популациите на малцинствата в генетичните изследвания е добре известно, което трябва да се обърне внимание, за да бъде прецизната генетична медицина ефективна за всички раси/етноси. На този етап е важно да се признае, че варианти на моногенния диабет могат и са били открити при множество различни раси/етноси.
Чрез дизайна на генния панел имаме потенциално ограничено откриване на пациенти с моногенен диабет в тази кохорта. Тъй като има сравнително малко съобщени патогенни варианти в 27-те не-MODY гени в сравнение с броя на докладваните патогенни варианти на ген MODY, вариантите за кодиране в не-MODY гени са по-малко вероятно да бъдат класифицирани като патогенни или вероятно патогенни. Въпреки че откриването на по-патогенни или вероятни патогенни варианти в по-рядко срещаните моногенни гени за диабет може да се увеличи в бъдеще, тъй като не успяхме да дефинираме каквито и да било вероятни патогенни или патогенни варианти в не-MODY моногенни гени за диабет, специфичните за MODY генни панели могат да бъдат по-подходящ подход за проучвания за скрининг за моногенен диабет по това време. Също така има потенциално други неизвестни причинителни моногенни гени за диабет или неексонични/сплайсинг варианти, които не са оценени с помощта на нашия генен панел.
Открихме по-голяма част от хората с HNF4A-MODY от очакваното в нашата кохорта (Таблица 1). Докато HNF1A-MODY представлява приблизително 30-50% от MODY диагнозите и HNF4A-MODY представлява по-малко от 10%, наблюдавахме повече пациенти с HNF4A-MODY, отколкото с HNF1A-МОДИ. 20 Интересно, HNF4A-MODY се свързва с повишено тегло при раждане и макрозомия в неонаталния стадий, независимо от генотипа на майката, но се влошава от майката със същата мутация и свързаната с нея хипергликемична вътрематочна среда. 21 Макрозомията е свързана със състоянието на наднормено тегло или затлъстяване през юношеството и зрелостта. 22 По този начин може да има връзка между HNF4A-MODY с по-висок ИТМ, който може да причини HNF4A-MODY да бъде погрешно диагностициран като T2D, когато се използва ИТМ като критерий за моногенен диабет. Предполагаме, че ДНЕС проучването на критериите за включване (ИТМ ≥85-и персентил за възраст и пол) може да е създало пристрастие към подбора към HNF4A-MODY в сравнение с другите генно специфични подгрупи; това обаче остава да се докаже. По-нататъшни проучвания, включващи теглото при раждане и разпространението на T2D неправилно диагностициране на пациенти с HNF4A-MODY са необходими за проверка на тази хипотеза.
Констатациите от това проучване имат силни последици за информирането на практиката за управление на диабета при младите хора. Открихме индивиди с моногенен диабет при всички раси/етноси в кохорта от подрастващи с наднормено тегло и затлъстяване, диагностицирани с T2D, пораждайки загриженост относно препоръчваната в момента употреба на ИТМ и препоръчваната по-рано употреба на раса/етническа принадлежност за подбор на пациенти за генетични тестове. Предлагаме при светските тенденции за увеличаване на затлъстяването при деца и юноши моногенният диабет да се разглежда като потенциална етиология при свързани с диабета автоантитела-отрицателни и С-пептид-положителни юноши, независимо от ИТМ. Въпреки малкия обем на извадката от нашата кохорта, отговорът на лечението, основан на диагнозата моногенен диабет, е в съответствие с прогнозираните резултати, което показва важността на генетичното тестване на моногенния диабет и правилната генетична интерпретация за осигуряване на оптимално лечение на младежи с диабет.
Препратки
Tattersall RB, Fajans SS. Разлика между наследяването на класически младежки и младежки тип диабет с настъпване на зрялост. Диабет. 1975; 24: 44–53.
Murphy R, Ellard S, Hattersley AT. Клинични последици от молекулярно-генетичната класификация на моногенния бета-клетъчен диабет. Nat Clin Pract Endocrinol Metab 2008; 4: 200–213.
- Скрининг на рискови фактори за диабет тип 2 при юноши с наднормено тегло и затлъстяване в училищни условия
- Предиктори на повтарящия се исхемичен инсулт при пациенти със затлъстяване със захарен диабет тип 2 А
- Изследване на прогресията от непоносимост към глюкоза до диабет тип 2 при затлъстели деца - ScienceDirect
- Качество на грижите за роднини от първа степен на пациенти с диабет тип 2, диагностицирани с диабет в
- MODY Рядък тип диабет - клиничен съветник