Резюме
1. Въведение
Хроничната бъбречна болест (ХБН) е широко разпространено заболяване с нарастващо разпространение в съвременните общества [1]. Нарушенията на липидите са често срещани при тази група пациенти. При повечето пациенти с ХБН се наблюдава атерогенна дислипидемия [2]. Наличието на дислипидемия при пациенти с бъбречни заболявания не само увеличава риска от сърдечно-съдови заболявания, но също така ускорява прогресирането на хроничното бъбречно заболяване до неговия краен стадий [1]. Подобряването на дислипидемията и понижаването на оксидативния стрес, възпалителните процеси, инсулиновата чувствителност и нивата на остатъчните липопротеини може да доведе до намаляване на сърдечно-съдовата тежест [1]. Смята се, че хиперхолестеролемията, хипертриглицеридемията и повишените нива на липопротеин-холестерол с ниска плътност са решаващи фактори за риска от сърдечно-съдови заболявания (ССЗ) при пациенти с ХБН [3]. Хранителните интервенции могат да засилят полезния ефект от лечението и играят важна роля за запазването на цялостното благосъстояние на пациентите с хронична бъбречна недостатъчност, тъй като целта на подходящата диета е да се намали рискът от сърдечно-съдови събития, да се предотврати недохранването и да се възпрепятства прогресията на бъбречно заболяване [3,4,5,6].
2. Нарушения на холестерола при ХБН
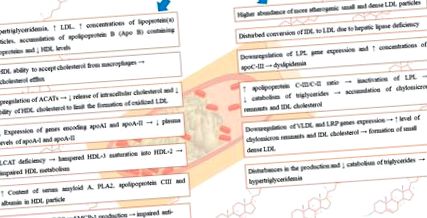
Многобройни проучвания показват връзка между бъбречната дисфункция и нарушенията в метаболизма на липопротеините, което води до дислипидемия и последващо натрупване на атерогенни частици [7]. В хода на хроничното бъбречно заболяване често се наблюдават следните нарушения: повишени нива на VLDL, IDL, триглицериди, нормални до повишени нива на LDL, но в същото време повишени концентрации на окислен LDL, HDL дефицит и дисфункция, намалени нива на аполипопротеин A-1, натрупването на аполипопротеин В (Апо В), съдържащи липопротеини, както и по-високо съотношение на аполипопротеин С-III/C-II [7]. Аномалиите по отношение на липопротеините варират в зависимост от степента на бъбречно увреждане, етиологията на първичното заболяване, наличието на нефротичен синдром (NS), а в случай на пациенти, които се нуждаят от бъбречна заместителна терапия, също и методът на бъбречна заместителна терапия - хемодиализа (HD) или перитонеална диализа (PD) [8]. Променените нива на липопротеини могат да стимулират прогресирането на увреждането на бъбречната функция [9,10]. Нарушенията в нивата на липопротеините, възникващи в хода на ХБН, са обобщени на Фигура 1 .
Обобщение на нарушенията в нивата на липопротеините, възникващи в хода на ХБН.
2.1. Нарушения на холестерола при ХБН Етап 2–3a, 3b и 4
Дефицитът на чернодробна липаза (HL), който се наблюдава при хронична бъбречна недостатъчност, води до дефектна трансформация на IDL до LDL, повишаване на серумната IDL, обогатяване на LDL с TG и хипертриглицеридемия [20,29]. Изследвания върху плъхове разкриват, че при хронично бъбречно заболяване иРНК на чернодробната липаза е понижена и следователно производството, активността и освобождаването на HL се нарушават. Предполага се, че механизмът на това явление е свързан със вторичния хиперпаратиреоидизъм, тъй като предотвратяването на излишък от ПТХ чрез PTX или лечението с верапамил (което блокира ефектите на ПТХ) коригира компрометирания метаболизъм на чернодробната липаза [29]. Нещо повече, клирънсът на VLDL е нарушен при хронична бъбречна недостатъчност поради значително понижаване на експресията на гена на VLDL рецептора и изобилието на протеини, което в резултат води до повишени плазмени нива на VLDL и триглицериди [20,30,31].
Освен намалените нива на HDL, при ХБН се наблюдава и намалена активност на свързаните с HDL ензими, включително параоксоназа [32].
2.2. Нарушения на холестерола при ESRD (5-та)
Намалените нива на HDL при ESRD могат да бъдат свързани със значително намалена плазмена концентрация на ApoA-I, тъй като тя е решаващата протеинова съставка на HDL [20]. Също хипоалбуминемията, която често присъства в ESRD в резултат на възпаление, недохранване и т.н., може да допринесе за по-ниски серумни нива на HDL поради факта, че HDL получава значително количество от своето съдържание на холестерол от албумин. Албумините действат като носител на свободен холестерол от периферните тъкани до HDL-3 [20,43].
При пациенти с ESRD се наблюдава значително намалена активност и концентрация на LCAT в плазмата [37,44]. При пациенти в краен стадий на бъбречно заболяване (ESRD) неензимното гликиране на apoA-I води до намалено активиране на LCAT, което води до по-висок клирънс на apoA-I от циркулацията и до затруднени противовъзпалителни и антиоксидантни свойства на HDL [45 ]. Дефицитът на LCAT не само допринася за намаляване на нивото на HDL, нарушено съзряване на HDL и увеличаване на серумните нива на пред-бета HDL частици, но също така може да ускори разграждането на HDL [20]. Ускорената деградация на HDL е свързана с преференциално свързване с ендоцитния рецептор в черния дроб, което води до незрели HDL частици, интернализация и деградация в популацията на ESRD [20]. Сред допълнителните фактори, които намаляват липопротеин липазната активност при ESRD, са следните: ниски нива на зряла HDL частица (която е ApoE и ApoC донор), но високи нива на пре-бета HDL (които действат по обратен начин), намалена ApoC-II/ApoC-III съотношение, по-ниска физическа активност, нарушено преобразуване на тироксин (Т4) в три-йодтиронин (Т3), както и инсулинова резистентност [20]. Доказано е, че HDL от пациенти с краен стадий на ХБН е прооксидант поради факта, че претърпява окислителна модификация [37].
Според проучвания, свързаните с ESRD промени в модела на плазмените липопротеини могат да бъдат значително променени чрез диализна модалност [20]. Например, нивата на серумен холестерол и LDL холестерол често са в рамките или под нормалните граници при пациенти с ESRD, подложени на хемодиализа, докато при пациенти на перитонеална диализа те са повишени.
2.3. Нарушения на холестерола при диализирани пациенти
2.3.1. Хемодиализа
Общите и LDL нивата на холестерола, както и не-HDL холестеролът обикновено остават в нормалните граници [42,49]. При пациенти с ESRD, подложени на хемодиализа, се наблюдава намалено ниво на апоАИ, което е свързано с неговия засилен катаболизъм. Освен това при тези пациенти са наблюдавани по-високи нива на анти-apoAI автоантитела, което води до намалени нива на ApoAI и дисфункция на тези протеини [33]. Attman et al. [47] предполагат, че при пациенти на диализа се наблюдават умерени повишения на апоВ и апоЕ и значително увеличение на концентрациите на апоС-III. При пациенти с HD нивата на ApoA-IV са повишени. Повишаването на апоС-III и VLDL-холестерол и по-ниските нива на HDL холестерол се наблюдават дори при пациенти без хиперлипидемия [46,47,50]. Attman et al. [46,47] също демонстрира увеличаване на апоС-III в апоВ-съдържащи липопротеини и в нивата на богати на триглицериди апоВ-съдържащи липопротеини, което доведе до значително покачване на апоВ-съдържащите липопротеини в IDL9.
Резултатите от изследването, проведено от Lee et al. не разкри значителни разлики в реактивността на липопротеин липаза между VLDL и IDL от HD и от пациенти преди диализа [51].
Някои проучвания показват липса на значителни разлики в плазмената концентрация на CETP между пациентите на хемодиализа и нормалните пациенти [20,52,53]. Хроничното бъбречно заболяване не само стимулира намаляването на концентрацията на HDL, но също така променя състава на този липопротеин [54]. Поради наличието на засилено системно възпаление и оксидативен стрес, се наблюдава намаляване на антиоксиданта, противовъзпалителни функции на HDL или дори превръщането на HDL в прооксидант/провъзпалителна частица [20,55] . При пациенти на хемодиализа се наблюдава значително намаляване на плазмените нива на параоксоназа и глутатион пероксидаза, придружени от тежка загуба на HDL антиоксидант капацитет [37]. Yamamoto et al. [56] демонстрира повишено съдържание на серумен амилоид А, PLA2, аполипопротеин CIII и албумин в HDL частици, идващи от диализирани пациенти. Нещо повече, способността на такива HDL частици да приемат холестерол от макрофагите е намалена, което в резултат води до нарушен холестеролов отлив. Ribeiro et al. [57] демонстрира значително натрупване на oxLDL, особено при пациенти с HD. Изглежда, че основните характеристики на бъбречната дислипидемия остават основно непроменени по време на HD, но дислипидемията може да бъде умерено отслабена по време на продължителна HD [46].
2.3.2. Перитонеална диализа (PD)
Пациентите с PD в сравнение с пациентите с HD имат по-изразено увеличение на атерогенните липопротеини [46].
2.4. Нарушения на холестерола при пациенти с трансплантация
3. Риск, свързан с профила на лошия холестерол и ползи, свързани с понижаване на липидите при пациенти с ХБН
Увеличението на сърдечно-съдовата заболеваемост/смъртност при пациенти с ХБН е свързано с наличието на оксидативен стрес и възпаление [7,68]. Първото условие активира транскрипционни фактори, което води до освобождаване на възпалителни цитокини и активиране на макрофаги, докато последното е свързано с производството на реактивни кислородни видове (ROS) и насърчаването на оксидативен стрес в тъканите [68]. Счита се, че състоянието на повишен оксидативен стрес при пациенти с ХБН е свързано с по-високи концентрации на уремични токсини [68]. Също така, нивата на антиоксидантните ензими, включително супероксиддисмутаза, каталаза и глутатионпероксидаза, са намалени при пациенти с ХБН [68].
Друг механизъм, свързан с повишен риск от сърдечно-съдова болест на ХБН, е вредното въздействие на ХБН върху скоростта на HDL-медиирано обратно поемане на холестерол от периферните тъкани и разтоварване на това количество холестерол в черния дроб [34,74]. Дефектният HDL-медииран обратен прием на холестерол е свързан с понижаването на регулирането на лецитин-холестерол ацилтрансферазата, намаленото производство и засиления катаболизъм на аполипопротеин А1, както и повишеното регулиране на ацил-коензим А холестерол ацилтрансфераза-1 [75]. Освен това модификациите на аполипопротеин А1 водят до увреждане на способността на HDL да се свързва с машината, която медиира изтичането на холестерол чрез ATP-свързващи касетни транспортери А1 и G1 [34,76]. Тези апо-AI модификации могат също така да ограничат свързването на HDL с рецептора за поглъщане-B1, което в резултат води до дефектно изхвърляне на HDL-C товар в черния дроб [34,77].
3.1. Деца/Юношеско население
3.2. Възрастно население
U-образната крива, изобразяваща връзката между TC и смъртността, изглежда по-линейна след корекцията за серумен албумин [93,95,96]. Тезата за въздействието на възпалението и недохранването при пациенти на диализа беше потвърдена от голямо, 10-годишно проспективно проучване на японски пациенти с HD [93], което показа независима връзка между нисък TC и по-висок C-реактивен протеин (CRP) и смъртност при пациенти с нисък албумин. В друго проспективно проучване на диализирани пациенти увеличаването на изходното TC от 1 mmol/L е свързано с намаляване на смъртността от всички причини при наличие на възпаление/недохранване [96].
Според проучвания излишният риск, свързан с повишен LDL-C, намалява заедно с намаляването на eGFR [97]. Tonelli et al. [98] демонстрира, че коефициентът на риск [HR] (95% доверителен интервал [CI]) на инцидента на миокарден инфаркт (MI), свързан с LDL-C 44,9 mmol/L (в сравнение с 2,6–3,39 mmol/L [100–131 mg/dL]) е 3,01 (2,46–3,69), 2,30 (2,00–2,65) и 2,06 (1,59–2,67) за пациенти с eGFR ≥90, 60–89,9 и 15–59,9 ml/min/1,73 m 2, съответно [97,98]. Връзката между LDL-C и риска от MI изглежда линейна при LDL-C над 2,6 mmol/L (100 mg/dL). Експериментални проучвания потвърдиха, че дислипидемията засилва липидната пероксидация и предизвиква реакции на свободни радикали [3,4].
маса 1
Обобщение на резултатите от проучвания относно липидни нарушения при хронично бъбречно заболяване (ХБН).
- Диета и правилно хранене на пациенти с ерозивен гастрит
- Диета на GIST - правилно хранене за пациенти с рак на GIST Групата на спасителните плотове
- Хранителни практики и прием на храна сред некритично болни, постоперативни възрастни пациенти
- Лекари, които не са научени да обсъждат диета, хранене с пациентите - Chicago Tribune
- Серията „Храната е лекарство“ Ролята на храненето в подобряването на качеството на живот Храненето в палиативно отношение